Dr. Chittaranjan Das
Das Hauptaugenmerk unseres Labors liegt auf dem Verständnis der funktionellen Rolle deubiquitinierender Enzyme (Deubiquitinasen oder DUBs) in zellulären Signalwegen, insbesondere solchen, die an der Neurodegeneration (allmählicher Verlust von Neuronen) beteiligt sind, wie Alzheimer-Krankheit (AD) und Parkinson-Krankheit (PD). Eine Vielzahl von biologischen Prozessen wird durch die reversible, posttranslationale Modifikation von Proteinen durch die kovalente Bindung von Ubiquitin, einem hochkonservierten eukaryotischen Polypeptid mit 76 Resten, gesteuert. Die Ubiquitinierung kann als das Startereignis einer Signalkaskade (Ubiquitin-Signalisierung) angesehen werden, die schließlich durch die hydrolytische Entfernung des Ubiquitin-Tags durch einen DUB beendet wird. Eine Untersuchung des menschlichen Genoms zeigt das Vorhandensein von etwa 90 DUBs, was auf ihre Beteiligung an einer Vielzahl biochemischer Wege hindeutet. Unser Ansatz zur Untersuchung von DUBs basiert auf der kombinierten Anwendung einer Reihe von Werkzeugen, die die chemische Synthese von niedermolekularen Sonden, Röntgenkristallographie und Massenspektrometrie-basierte Proteomik umfassen.
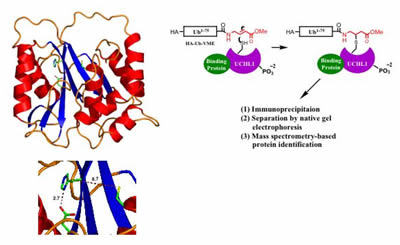
Die durch Röntgenkristallographie bestimmte Struktur von UCHL1 legt nahe, dass das Enzym zwei Zustände annehmen kann, einen inaktiven Zustand (in dem die katalytischen Reste falsch ausgerichtet sind, links dargestellt) und einen mutmaßlich aktiven Zustand – in dem die Reste durch Wechselwirkung des Proteins mit unbekannten Cofaktoren in Ausrichtung gebracht werden. Eine vorgeschlagene Methode zur Identifizierung von Cofaktoren von UCHL1 über aktivitätsbasierte Reinigung aus Ganzzellextrakten (rechts).
Derzeit untersuchen wir die normale Funktion des neuronalen DUB Ubiquitin C-terminale Hydrolase L1 (UCHL1)- ein PD-assoziiertes, neuronenspezifisches Protein unbekannter physiologischer Funktion. Unsere Bemühungen in diese Richtung zielen darauf ab, zelldurchlässige niedermolekulare Inhibitoren von UCHL1 zu entwickeln, die verwendet werden können, um seine Funktion (sowohl normal als auch krankheitsassoziiert) zu untersuchen, seine Bindungspartner durch affinitätsbasierte Reinigung aus Ganzzellextrakten zu bestimmen und die molekulare Grundlage dafür zu definieren, wie eine natürlich vorkommende Variante dieses Enzyms – in dem Ser an der Position 18 durch Tyr (genannt S18Y-Polymorph) substituiert ist – vor der Parkinson-Krankheit (PD) schützt. Neben UCHL1 führen wir auch strukturelle und mechanistische Untersuchungen anderer verwandter Enzyme durch, von denen angenommen wird, dass sie an grundlegenden biochemischen Prozessen wie DNA-Reparatur, Histonmodifikation und Endozytose von Plasmamembranproteinen beteiligt sind.
Ausbildung
- Ph.D., Indisches Institut für Wissenschaft, 2001
- Postdoktorand, Harvard Medical School und Brandeis University, 2006
Anerkennungen
- Senior Research Fellowship, University Grants Commission, Indien , 1996
Publikationen
Publikationsliste