Ácidos, Bases y pH
|
|||||||||
ÁCIDOS Y SUS BASES CONJUGADAS
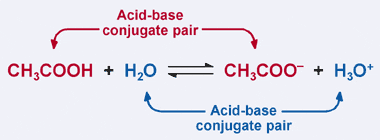
Recuerde la definición Bronsted-Lowry de un ácido: un ácido es un donante de protones. Claramente, en nuestro ejemplo anterior, el ácido acético dona su protón al H2O en la reacción hacia adelante, lo que resulta en la formación del ion acetato. Sin embargo, en la reacción inversa, el ion acetato acepta un protón de H3O+ para revertir a CH3COOH. De la definición Bronsted-Lowry, una base es un aceptor de protones.
|
por Lo tanto, el acetato de iones actúa como una base en la reacción inversa, y es llamada base conjugada de ácido acético. El ácido acético y el ion acetato se conocen como un par conjugado ácido–base. Curiosamente, hay un segundo par de conjugados ácido–base en la reacción anterior. Observe cómo en la reacción inversa, H3O + dona un protón (convirtiéndolo en ácido), mientras que en la reacción hacia adelante, H2O acepta un protón (convirtiéndolo en una base). H2O y H3O+ son un par ácido-base conjugado, con H3O+ siendo el ácido conjugado y H2O siendo la base conjugada.
In a conjugate acid–base pair, the conjugate acid has one more proton than its corresponding conjugate base.