12.4: Evaporación y condensación
Evaporación
Un charco de agua que se deja sin perturbar finalmente desaparece. Las moléculas líquidas escapan a la fase gaseosa, convirtiéndose en vapor de agua. La vaporización es el proceso en el que un líquido se convierte en gas. La evaporación es la conversión de un líquido a su vapor por debajo de la temperatura de ebullición del líquido. Si el agua se mantiene en un recipiente cerrado, las moléculas de vapor de agua no tienen la oportunidad de escapar al entorno y, por lo tanto, el nivel del agua no cambia. A medida que algunas moléculas de agua se convierten en vapor, un número igual de moléculas de vapor de agua se condensan de nuevo en el estado líquido. La condensación es el cambio de estado de un gas a un líquido.
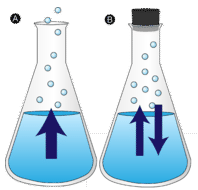
Para que una molécula líquida escape al estado gaseoso, la molécula debe tener suficiente energía cinética para superar las fuerzas de atracción intermoleculares en el líquido. Recuerde que una muestra de líquido dada tendrá moléculas con una amplia gama de energías cinéticas. Las moléculas líquidas que tienen este cierto umbral de energía cinética escapan de la superficie y se convierten en vapor. Como resultado, las moléculas líquidas que quedan ahora tienen menor energía cinética. A medida que se produce la evaporación, la temperatura del líquido restante disminuye. Ha observado los efectos del enfriamiento por evaporación. En un día caluroso, las moléculas de agua de la transpiración absorben el calor corporal y se evaporan de la superficie de la piel. El proceso de evaporación deja el sudor restante más fresco, que a su vez absorbe más calor de su cuerpo.
Un líquido determinado se evaporará más rápidamente cuando se calienta. Esto se debe a que el proceso de calentamiento resulta en una mayor fracción de las moléculas del líquido que tienen la energía cinética necesaria para escapar de la superficie del líquido. La siguiente figura muestra la distribución de energía cinética de moléculas líquidas a dos temperaturas. El número de moléculas que tienen la energía cinética requerida para evaporarse se muestra en el área sombreada debajo de la curva a la derecha. El líquido de mayor temperatura \(\left (T_2 \ right)\) tiene más moléculas capaces de escapar a la fase de vapor que el líquido de menor temperatura \(\left( T_1 \right)\).
A 29.029 pies \(\izquierda (8848 \: \text{m} \derecha)\), el Monte Everest en la cordillera del Himalaya en la frontera entre China y Nepal es el punto más alto de la tierra. Su altitud presenta muchos problemas prácticos para los escaladores. El contenido de oxígeno del aire es mucho más bajo que al nivel del mar, por lo que es necesario llevar tanques de oxígeno (aunque algunos escaladores han alcanzado el pico sin oxígeno). Otro problema es el de hervir agua para cocinar alimentos. Aunque el agua hierve a \(100^\text{o} \text{C}\) a nivel del mar, el punto de ebullición en la parte superior del Monte Everest es solo alrededor de \(70^\text{o} \text{C}\). Esta diferencia hace que sea muy difícil obtener una taza de té decente (lo que definitivamente frustró a algunos de los escaladores británicos).