17.3: La Formación de Iones Complejos
El Efecto de la Formación de Iones Complejos sobre la Solubilidad
¿Qué sucede con la solubilidad de una sal escasamente soluble si se agrega a la solución un ligando que forma un ion complejo estable? Un ejemplo de esto ocurre en la fotografía convencional en blanco y negro. Recuerde que la película fotográfica en blanco y negro contiene microcristales sensibles a la luz de AgBr, o mezclas de AgBr y otros haluros de plata. AgBr es una sal escasamente soluble, con un Ksp de 5,35 × 10-13 a 25°C. Cuando se abre el obturador de la cámara, la luz del objeto fotografiado golpea algunos de los cristales de la película e inicia una reacción fotoquímica que convierte AgBr en metal negro Ag. Las imágenes negativas estables y bien formadas aparecen en tonos de gris, correspondientes al número de granos de AgBr convertidos, con las áreas expuestas a la mayor luz siendo las más oscuras. Para fijar la imagen y evitar que más cristales AgBr se conviertan en metal Ag durante el procesamiento de la película, el AgBr sin reaccionar en la película se elimina mediante una reacción de complejación para disolver la sal escasamente soluble.
La reacción para la disolución del bromuro de plata es la siguiente:
\
con
\
El equilibrio se encuentra muy a la izquierda, y las concentraciones de equilibrio de iones Ag+ y Br− son muy bajas (7,31 × 10-7 M). Como resultado, eliminar AgBr sin reaccionar de un solo rollo de película usando agua pura requeriría decenas de miles de litros de agua y una gran cantidad de tiempo. El principio de Le Chatelier nos dice, sin embargo, que podemos conducir la reacción a la derecha eliminando uno de los productos, lo que hará que más AgBr se disuelva. El ion bromuro es difícil de eliminar químicamente, pero el ion plata forma una variedad de complejos estables de dos coordenadas con ligandos neutros, como el amoníaco, o con ligandos aniónicos, como el cianuro o el tiosulfato (S2O32−). En el procesamiento fotográfico, el exceso de AgBr se disuelve utilizando una solución concentrada de tiosulfato de sodio.
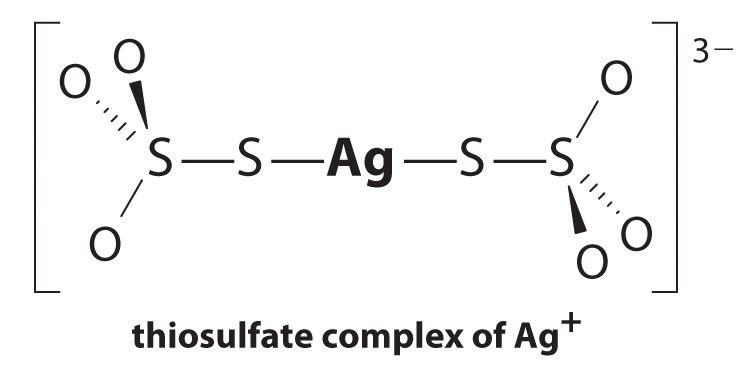
La reacción de Ag+ con tiosulfato es la siguiente:
\^{3−}_{(aq)} \label{17.3.5a}\]
con
\
La magnitud de la constante de equilibrio indica que casi todos los iones Ag + en solución serán complejados inmediatamente por tiosulfato para formar 3 -. Podemos ver el efecto de tiosulfato en la solubilidad de AgBr por escrito la correspondiente reacciones y sumándolas:
\\ \mathrm{Ag^+(aq)}+\mathrm{2S_2O_3^{2-}(aq)}\rightleftharpoons\mathrm{^{3-}(aq)}\hspace{3mm}K_\textrm f&=2.9 \ horas 10^{13}
\\ \mathrm{AgBr(s)}+\mathrm{2S_2O_3^{2-}(aq)}\rightleftharpoons\mathrm{^{3-}(aq)}+\mathrm{Br^-(aq)}\hspace{3mm}K&=K_{\textrm{sp}}K_{\textrm f} = 15 \ end{align} \ label{17.3.6}\)
La comparación de K con Ksp muestra que la formación del ion complejo aumenta la solubilidad de AgBr en aproximadamente 3 × 1013. El aumento espectacular de la solubilidad, combinado con el bajo costo y la baja toxicidad, explica por qué el tiosulfato de sodio se usa casi universalmente para desarrollar películas en blanco y negro. Si se desea, la plata puede recuperarse de la solución de tiosulfato utilizando cualquiera de varios métodos y reciclarse.
Si un ion complejo tiene un Kf grande, la formación de un ion complejo puede aumentar dramáticamente la solubilidad de sales escasamente solubles.
Ejemplo \(\Índice de página{2}\)
Debido al efecto común de iones, podríamos esperar que una sal como AgCl sea mucho menos soluble en una solución concentrada de KCl que en agua. Tal suposición sería incorrecta, sin embargo, porque ignora el hecho de que el ion de plata tiende a formar un complejo de dos coordenadas con iones cloruro (AgCl2 -). Calcular la solubilidad de AgCl en cada situación:
- en agua pura
- en solución KCl de 1,0 M, ignorando la formación de iones complejos
- la misma solución que en la parte (b), excepto teniendo en cuenta la formación de iones complejos, suponiendo que AgCl2-es el único complejo Ag+ que se forma en concentraciones significativas
A 25°C, Ksp = 1,77 × 10-10 para AgCl y Kf = 1.1 × 105 para AgCl2 -.
Dado: Ksp de AgCl, Kf de AgCl2− y concentración de KCl
Solicitado: solubilidad de AgCl en agua y en solución de KCl con y sin formación de iones complejos
Estrategia:
- Escriba la expresión del producto de solubilidad para AgCl y calcule la concentración de Ag+ y Cl-en agua.
- Calcular la concentración de Ag+ en la solución de KCl.
- Escribir ecuaciones químicas equilibradas para la disolución de AgCl y para la formación del complejo AgCl2. Suma las dos ecuaciones y calcula la constante de equilibrio para el equilibrio general.
- Escriba la expresión constante de equilibrio para la reacción general. Resuelve para la concentración del ion complejo.
Solución
- A Si dejamos que x sea igual a la solubilidad de AgCl, entonces en equilibrio = = x M. Sustituyendo este valor en la expresión del producto de solubilidad,
Por lo tanto, la solubilidad del AgCl en agua pura a 25°C es de 1,33 × 10-5 M.
- B Si x es igual a la solubilidad de AgCl en la solución de KCl, entonces en equilibrio = x M y = (1.0 + x) M. Sustituyendo estos valores en la expresión del producto de solubilidad y suponiendo que x << 1.0,
Si el efecto de iones comunes fuera el único factor importante, predeciríamos que el AgCl es aproximadamente cinco órdenes de magnitud menos soluble en una solución de KCl de 1.0 M que en agua.
- C Para tener en cuenta los efectos de la formación de iones complejos, primero debemos escribir las ecuaciones de equilibrio tanto para la disolución como para la formación de iones complejos. Agregar las ecuaciones correspondientes a Ksp y Kf nos da una ecuación que describe la disolución de AgCl en una solución de KCl. La constante de equilibrio para la reacción es, por lo tanto, el producto de Ksp y Kf:
\\ \mathrm{Ag^+(aq)}+\mathrm{2Cl^{ – }} \ rightleftharpones\mathrm {^{ – }}\hspace{3mm}K_ \ textrm f&=1.1 \ times10^{5}
\\ \mathrm{AgCl(s)}+\mathrm{Cl^{-}}\rightleftharpoons\mathrm{^{-}}\hspace{3mm}K&=K_{\textrm{sp}}K_{\textrm f}=1.9 \ times10^{-5}\end{align}\)
D Si dejamos que x sea igual a la solubilidad de AgCl en la solución de KCl, entonces en equilibrio = x y = 1.0-x. Sustituyendo estas cantidades en la expresión constante de equilibrio para la reacción neta y suponiendo que x << 1.0,
Es decir, AgCl se disuelve en 1,0 M KCl para producir una solución de 1,9 × 10-5 M del ion complejo AgCl2. Por lo tanto, predicemos que el AgCl tiene aproximadamente la misma solubilidad en una solución de KCl de 1,0 M que en agua pura, que es 105 veces mayor que la predicha sobre la base del efecto iónico común. (De hecho, la solubilidad medida de AgCl en 1,0 M KCl es casi un factor de 10 mayor que la del agua pura, en gran parte debido a la formación de otros complejos que contienen cloruro.)
Ejercicio \(\Índice de página{2}\)
Calcular la solubilidad del yoduro de mercurio(II) (HgI2) en cada situación:
- agua pura
- una solución de 3,0 M de NaI, suponiendo que 2-es la única especie que contiene Hg presente en cantidades significativas
Ksp = 2,9 × 10-29 para HgI2 y Kf = 6,8 × 1029 para 2−.
Respuesta
- 1.9 × 10-10 M
- 1.4 M
Los agentes complejantes, moléculas o iones que aumentan la solubilidad de las sales metálicas mediante la formación de complejos metálicos solubles, son componentes comunes de los detergentes para ropa. Los ácidos carboxílicos de cadena larga, los componentes principales de los jabones, forman sales insolubles con Ca2+ y Mg2+, que están presentes en altas concentraciones en agua “dura”. La precipitación de estas sales produce un anillo de bañera y le da un tinte gris a la ropa. La adición de un agente complejante como pirofosfato (O3POPO34−, o P2O74−) o trifosfato (P3O105−) a los detergentes evita que las sales de magnesio y calcio se precipiten porque la constante de equilibrio para la formación de iones complejos es grande:
con
Sin embargo, los fosfatos pueden causar daños ambientales al promover la eutrofización, el crecimiento de cantidades excesivas de algas en un cuerpo de agua, que eventualmente puede conducir a grandes disminuciones en los niveles de oxígeno disuelto que matan a los peces y otros organismos acuáticos. En consecuencia, muchos Estados de los Estados Unidos han prohibido el uso de detergentes que contengan fosfato, y Francia ha prohibido su uso a partir de 2007. Los detergentes “sin fosfato” contienen diferentes tipos de agentes complejantes, como derivados del ácido acético u otros ácidos carboxílicos. El desarrollo de sustitutos de fosfato es un área de intensa investigación.
Los ablandadores de agua comerciales también utilizan un agente complejante para tratar el agua dura al pasar el agua sobre resinas de intercambio iónico, que son sales de sodio complejas. Cuando el agua fluye sobre la resina, el ion de sodio se disuelve y las sales insolubles precipitan sobre la superficie de la resina. El agua tratada de esta manera tiene un sabor más salado debido a la presencia de Na+, pero contiene menos minerales disueltos.
Otra aplicación de agentes complejantes se encuentra en la medicina. A diferencia de los rayos X, las imágenes por resonancia magnética (RM) pueden proporcionar imágenes relativamente buenas de tejidos blandos, como los órganos internos. La RMN se basa en las propiedades magnéticas del núcleo 1H de átomos de hidrógeno en el agua, que es un componente importante de los tejidos blandos. Debido a que las propiedades del agua no dependen mucho de si está dentro de una célula o en la sangre, es difícil obtener imágenes detalladas de estos tejidos que tienen un buen contraste. Para resolver este problema, los científicos han desarrollado una clase de complejos metálicos conocidos como “agentes de contraste de RMN”.”Inyectar un agente de contraste de RMN en un paciente afecta selectivamente las propiedades magnéticas del agua en células de tejidos normales, tumores o vasos sanguíneos y permite a los médicos “ver” cada uno de ellos por separado (Figura \(\pageIndex{2}\)). Uno de los iones metálicos más importantes para esta aplicación es Gd3+, que con siete electrones no emparejados es altamente paramagnético. Debido a que Gd3+(aq) es bastante tóxico, debe administrarse como un complejo muy estable que no se disocia en el cuerpo y puede ser excretado intacto por los riñones. Los agentes complejantes utilizados para el gadolinio son ligandos como el DTPA5 (ácido pentaacético de dietileno triamina), cuya forma completamente protonada se muestra aquí.
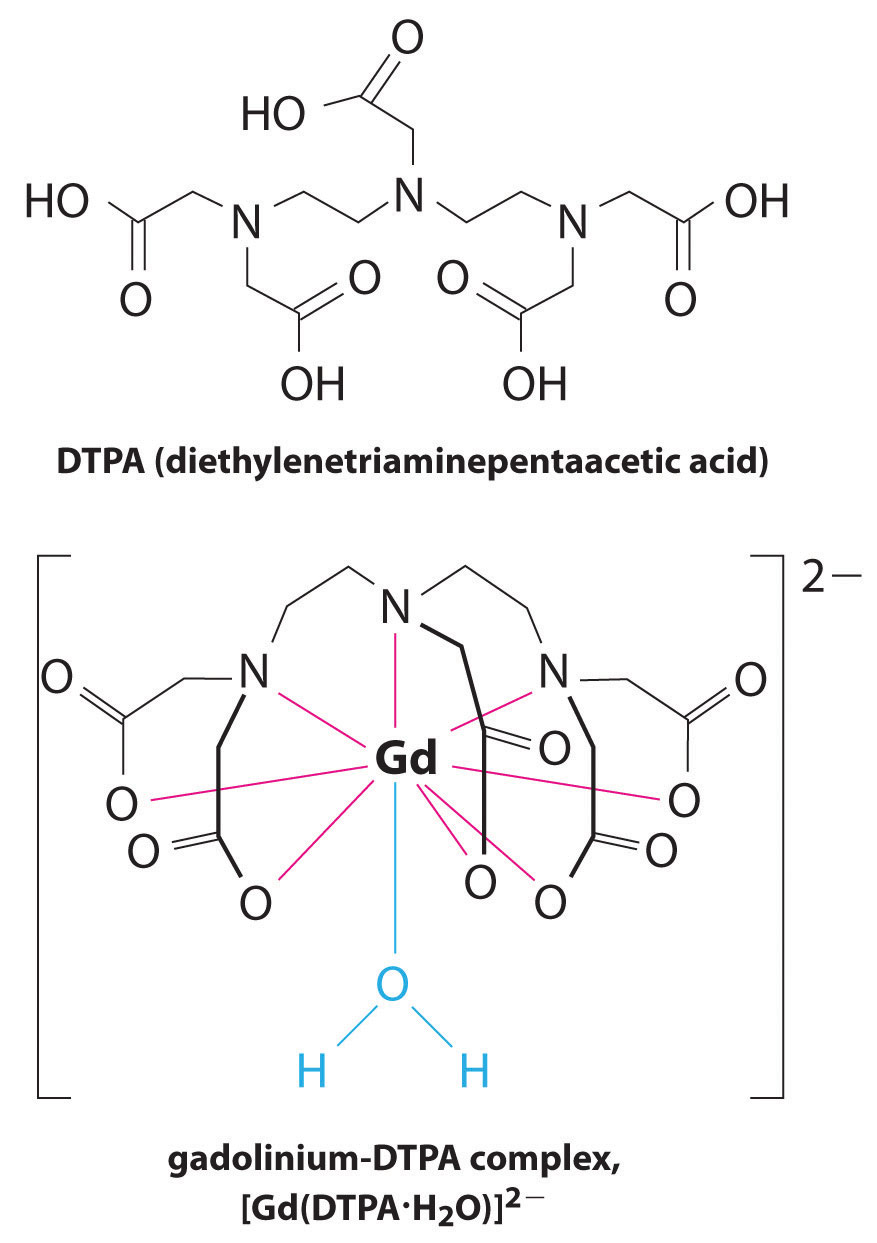
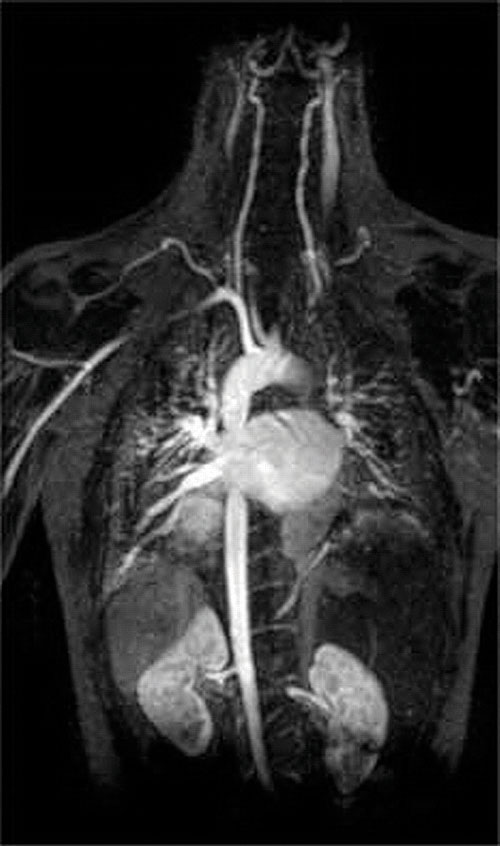
Figura \(\pageIndex{2}\): Imagen de resonancia magnética del Corazón, las Arterias y las Venas. Cuando se inyecta a un paciente un catión metálico paramagnético en forma de un complejo estable conocido como agente de contraste de RMN, las propiedades magnéticas del agua en las células se alteran. Debido a que los diferentes ambientes en diferentes tipos de células responden de manera diferente, un médico puede obtener imágenes detalladas de los tejidos blandos.