2.3: Monóxido de carbono y backbonding
Propiedades generales
El CO es un ligando dativo de tipo L que no afecta el estado de oxidación del centro del metal al unirse, pero aumenta el recuento total de electrones en dos unidades. Recientemente hemos visto que realmente hay dos interacciones de unión en juego en el ligando carbonilo: una interacción de ligando a metal n → dσ y una interacción de metal a ligando dn → π*. Esta última interacción se llama backbonding, porque el metal dona densidad electrónica de vuelta al ligando. Para recordarme la existencia de backbonding, me gusta usar la estructura de resonancia de la mano derecha siempre que sea posible; sin embargo, es importante recordar tratar el CO como un ligando de tipo L, sin importar la forma de resonancia que se dibuje.

Interacciones orbitales en M = C = O.
El CO es un fuerte donante σ (o base σ) y un buen aceptor π (o ácido π). Las propiedades del CO ligado dependen profundamente de la identidad del centro del metal. Más específicamente, las propiedades electrónicas del centro del metal dictan la importancia del backbonding en complejos de carbonilo metálico. Sin rodeos, los centros metálicos más ricos en electrones son mejores en el backbonding al CO. ¿Por qué es importante determinar la fuerza del backbonding?
La espectroscopia infrarroja se ha utilizado para apoyar empíricamente la idea del backbonding. La siguiente tabla organiza algunos complejos de carbonilo metálico en orden “periódico” y proporciona la frecuencia correspondiente al modo de estiramiento C=O. Observe que, sin excepción, cada CO complejo tiene una frecuencia de estiramiento inferior a la del CO libre. ¡El Backbonding es el culpable! El orden de enlace C–O en monóxido de carbono complejado es (casi siempre) inferior al del CO libre.

Frecuencias de estiramiento C = O en complejos metal-carbonilo. ¿Hay algo raro aquí?
La figura de arriba muestra un claro aumento en la frecuencia (un aumento en el orden de los bonos C–O) a medida que nos movemos de izquierda a derecha a través de la tabla periódica. Este hallazgo puede parecer extraño si consideramos que el número de electrones d en el metal neutro aumenta a medida que nos movemos de izquierda a derecha. ¿No deberían los centros metálicos con más electrones d ser mejores en el backbonding (y más “ricos en electrones”)? ¿Qué está pasando aquí? Recordemos la tendencia periódica de la energía orbital. A medida que nos movemos de izquierda a derecha, las energías orbitales d disminuyen y las energías de los orbitales dn y π* se separan. Como resultado, la interacción orbital de backbonding se vuelve peor (recuerde que las interacciones orbitales fuertes requieren energías orbitales bien emparejadas) a medida que avanzamos hacia los metales de transición tardía más electronegativos! Podemos hacer una analogía con los esmaltes y éteres de enol de la química orgánica. El átomo de oxígeno más electronegativo en los éteres de enol es un donante de electrones peor que el átomo de nitrógeno de la enamina.

La importancia del backbonding depende de la electronegatividad del metal y de su densidad electrónica.
Por supuesto, la contribución de otros ligandos en el centro del metal al backbonding tampoco se puede olvidar. Lógicamente, los ligandos que donan electrones tenderán a hacer el backbond más fuerte (hacen que el metal sea un mejor donante de electrones), mientras que los ligandos que retiran electrones empeorarán el backbonding. La adición de ligandos de fosfina ricos en electrones a un centro de metal, por ejemplo, disminuye la frecuencia de estiramiento de CO debido a la mejora del backbonding.
Los ligandos carbonilos son famosos por ser capaces de unir múltiples centros metálicos. La unión en complejos carbonílicos puenteados puede ser “tradicional” o deslocalizada, dependiendo de la estructura del complejo y el modo de puenteo. La variedad de modos de puente proviene de los diferentes donantes y aceptadores de electrones presentes en el ligando CO (y la posibilidad de enlace deslocalizado). Los modos de puente conocidos se muestran en la siguiente figura.
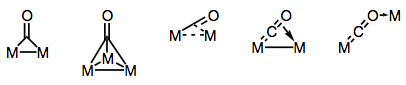
¡Construyendo puentes con ligandos carbonílicos!