7.4: Complejo III
El Complejo III acepta electrones del Complejo I y del Complejo II. Los electrones llegan en forma de ubiquinol, UQH2, que libera dos electrones y dos protones y se convierte de nuevo en ubiquinona, UQ. La ubiquinona luego regresa al Complejo I o al Complejo II para recolectar más electrones.
- El complejo III es el destino de los electrones que llegan tanto del Complejo I como del Complejo II.
- El complejo III utiliza energía liberada en transferencias de electrones cuesta abajo para bombear más protones a través de la membrana mitocondrial interna.
- El gradiente de protones a través de la membrana se utiliza para impulsar la formación de ATP en el Complejo V.
- El complejo III envía sus electrones al Complejo IV.
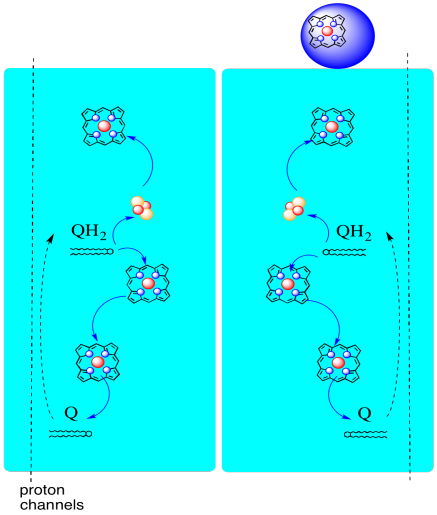
La trayectoria de los electrones a través del Complejo III se muestra a continuación. Tenga en cuenta que el complejo es una estructura dimérica, con dos rutas equivalentes: una a la izquierda y otra a la derecha. Los electrones se liberan de UQH2, ubiquinol, en el centro de la imagen, viajando hacia arriba hasta el citocromo c móvil en la parte superior. Una segunda vía de electrones permite viajar hacia abajo en la imagen, hacia otra molécula de ubiquinona, que recicla los electrones en un bucle.
- El complejo III presenta una vía de electrones inusual y divergente.
- Un electrón viaja hacia el citocromo c.
- El segundo electrón es finalmente reciclado en otro ubiquinol.
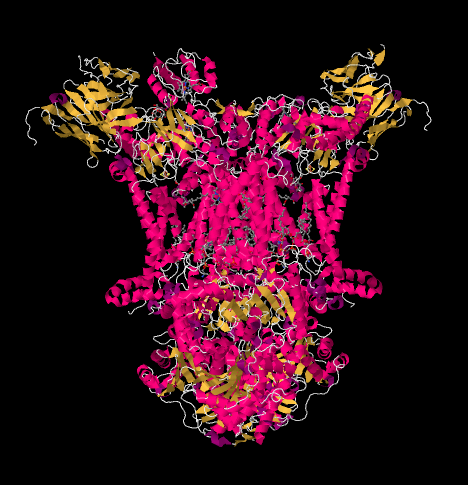
La estructura de rayos X del Complejo III se muestra en forma de dibujos animados a continuación. La membrana mitocondrial interna cruzaría la parte media superior del complejo. La mayoría de los proyectos complejos a continuación, en la matriz (la parte inferior de la imagen, en esta orientación), aunque una cantidad significativa también sobresale en el espacio intermembrana.
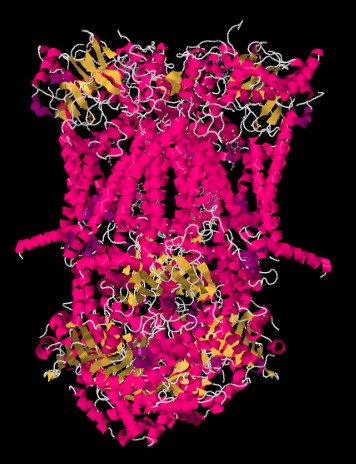
El complejo III continúa la cadena de transporte de electrones, enviando electrones a un mayor potencial de reducción (y menor energía libre) y hacia un encuentro con el oxígeno molecular en el Complejo IV. Los protones también se bombean desde la matriz mitocondrial, a través de la membrana mitocondrial interna y hacia el espacio intermembrana. Al mismo tiempo, una segunda ruta de electrones resulta en un reciclaje efectivo de la mitad de los electrones que entran en el complejo, aumentando el número de protones bombeados por electrón que llegan al Complejo III.
- Se ha sugerido que el bucle de reciclaje de electrones proporciona un mecanismo para extraer más protones de la matriz.
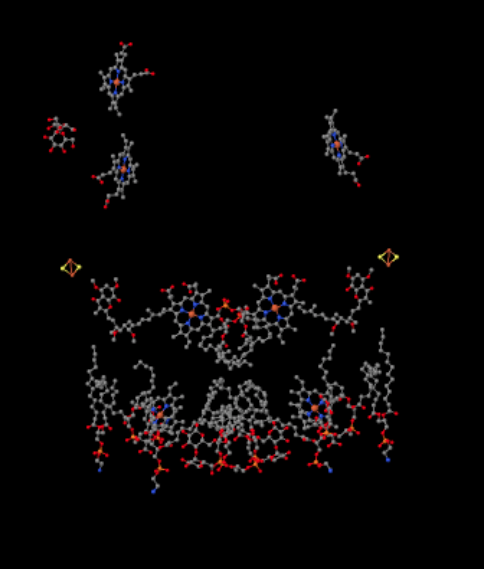
Podemos ver esta disposición inusual si ignoramos las proteínas para revelar los ligandos, a continuación. El complejo puede verse más claramente como un dímero; la mitad izquierda de la imagen es exactamente la misma que la derecha, aunque se refleja de manera opuesta. Los electrones entran en el complejo a través del portador móvil, ubiquinol, visible en el lado derecho e izquierdo de la imagen aproximadamente a mitad de camino; se puede ver el anillo y una cadena colgando de él.
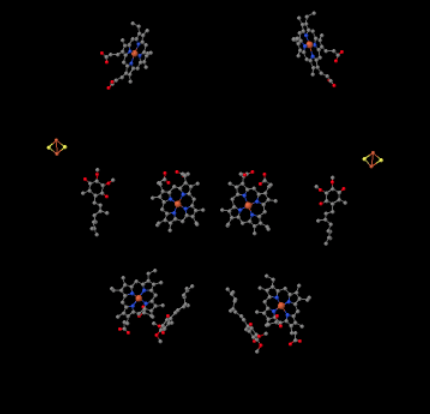
Cuando UQH2 se une al Complejo III, un electrón se envía a un cúmulo de FeS, mientras que el segundo se envía a un centro hemo de hierro, llamado hemo BL. El cúmulo de FeS es visible justo por encima del ubiquinol y hasta el borde de la imagen. El hemo BL está hacia el centro de la imagen.
Aunque no se ve en la imagen de rayos X que se muestra, este clúster FeS es diferente a los que vio anteriormente. Este se mantiene en su lugar con diferentes cadenas laterales de aminoácidos. No se puede ver eso en la imagen porque toda la proteína se ha dejado fuera, junto con los aminoácidos que se unen al grupo. Mientras que la mayoría de los grupos de FeS se mantienen en su lugar exclusivamente por cisteínas, este grupo se mantiene en su lugar por dos cisteiens en un lado, pero por dos histidinas en el otro. Este peculiar cúmulo de FeS se llama cúmulo de Rieske.
Los clústeres de Rieske son importantes porque son “clústeres de FeS de alto potencial”. Esto significa que tienen un potencial de reducción excepcionalmente positivo en comparación con otros clústeres de FeS. El potencial de reducción de cualquier ligando en una proteína depende en gran medida de su entorno, por lo que hay una amplia gama de valores en la mayoría de los casos. Eso es cierto para los racimos de hierro y azufre; los cúmulos de Rieske tienen potenciales de reducción que van de -1,0 V a aproximadamente +0,05 V. Los cúmulos de Rieske tienen potenciales que van de aproximadamente 0 V a aproximadamente 0,4 V.
Desde el cúmulo de FeS, el electrón se envía a otro centro hemo de hierro en una unidad unida a membrana llamada citocromo c1. El citocromo c1 se puede ver en la parte superior de la imagen. Debido a que esta imagen está orientada de la misma manera que las otras estructuras de rayos X del complejo respiratorio, podemos ver que este electrón se transporta hacia el espacio intermembrana. Finalmente, este electrón se transfiere a otro hemo, pero este hemo está unido a una pequeña proteína móvil, llamada citocromo c. El citocromo c es otro portador móvil de electrones. Lleva el electrón al complejo IV. Volveremos al citocromo c un poco más tarde.
Antes de llegar a eso, ¿a dónde va el otro electrón? Del hemo BL, el segundo electrón pasa a otro complejo de porfirina de hierro, el hemo BH. Eso es hacia la parte inferior de la imagen, por lo que este electrón está siendo enviado de vuelta a la matriz. Esperando por el hemo BL, sin embargo, hay otra ubiquinona, UQ. Está esperando el electrón. En realidad, esperará a dos, luego dejará su muelle y regresará al sitio de unión del ubiquinol (UQH2) para liberar los electrones de nuevo.
¿Por qué molestarse? ¿Por qué no enviar los electrones en su camino correctamente la primera vez? Parece que se están reciclando por alguna razón. Se cree que esta desviación permite bombear protones adicionales a través de la membrana mitocondrial. Cuando la segunda ubiquinona se reduce a ubiquinol a través de la aceptación de dos electrones, también recoge dos protones más de la matriz de abajo. Esos protones eventualmente pasarán hacia el espacio intermembrana cuando el ubiquinol se oxide de nuevo. Este reciclaje, y exprimir un par de protones adicionales para aumentar el gradiente de protones, se llama bucle Q.
La ventaja del bucle Q se explica en el siguiente diagrama. En el diagrama, las entradas al complejo III se muestran en rojo, las salidas en azul y los elementos reciclados en verde. Si un ubiquinol simplemente entregara sus electrones y protones y se hiciera, habría dos protones entregados por ubiquinol. Eso es una salida de protones por electrón que fue de entrada.
Un segundo ubiquinol haría exactamente lo mismo. Habría cuatro protones de salida para cuatro electrones de entrada inicial. Eso sigue siendo una salida de protones por electrón que fue de entrada.
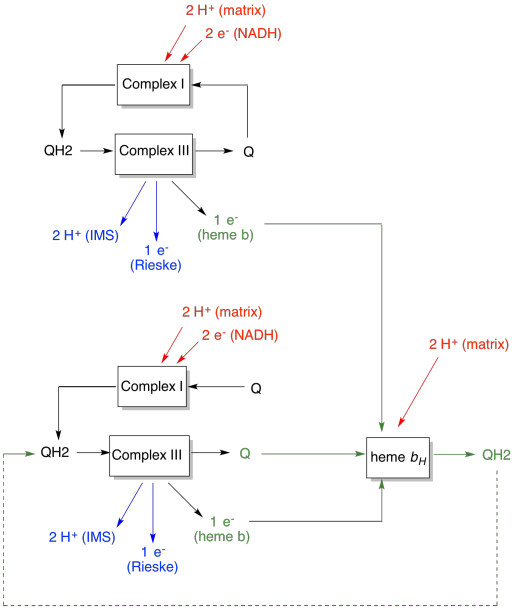
Si, en cambio, se recicla un electrón cada vez, entonces cada segundo ubiquinol conduce a la entrega de un par adicional de protones. Esto se debe a que al recoger los electrones reciclados, una ubiquinona ha tenido que viajar de regreso al lado de la matriz de la membrana y recoger dos protones más. En general, eso significa que se entregan seis protones para cuatro electrones de entrada, o 1,5 protones de salida por electrón de entrada. Dado que el gradiente de protones es lo que genera el ATP, al aumentar el número de protones bombeados por electrón que entra, la eficiencia aumenta.
- El Q-loop aumenta el número de protones bombeados por entrada de electrón en el sistema.
Ahora volvamos al portador de electrones saliente, el citocromo c, que transportará los electrones al Complejo IV. En la imagen de abajo, a partir de una estructura de cristal de rayos X diferente, el Complejo se ha encontrado con un acoplamiento de ciclocromo c en el sitio de unión. El citocromo c es una proteína globular rosada unida en la parte superior de la imagen, en la mitad izquierda del dímero, tal como lo vemos aquí. Está en el borde del espacio intermembrana, que es un medio acuoso. A diferencia de la ubiquinona, que se desliza a través de la bicapa lipídica de la membrana, el citocromo c rueda o se desliza o nada por encima de la parte superior hasta su destino.
La misma vista se muestra a continuación sin la proteína. La parte inferior de la imagen está bastante llena de lípidos, y hay un azúcar colgando en la parte superior izquierda, pero justo en la parte superior se puede ver la porfirina de hierro que se encuentra dentro del citocromo c.
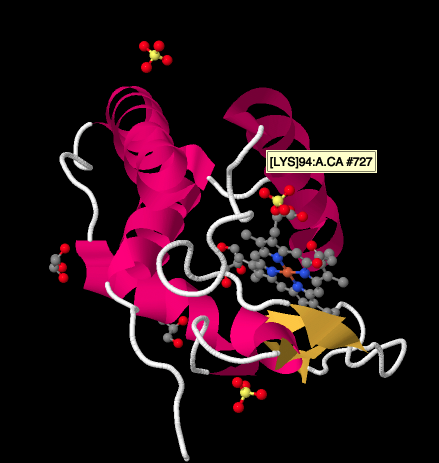
Una mirada más cercana a una estructura de rayos X de un ciclocromo c, a continuación, muestra una imagen relativamente simple en comparación con los complejos que hemos estado viendo. Hay un par de hélices, un par de hojas, algunos bucles, y esa porfirina de hierro o hemo de nuevo. Unos pocos iones sulfato están flotando cerca, así como un par de moléculas de glicerol, probablemente introducidas durante la purificación o cristalización de la proteína. Tenga en cuenta que el hemo se encuentra en el borde de la proteína. Esa ubicación puede facilitar la transferencia de electrones desde el Complejo III o al Complejo IV.
- El citocromo c es el destino final de los electrones que se mueven a través del Complejo III.
- El citocromo c es un portador móvil de un electrón.
- El citocromo c es en realidad una pequeña proteína hidrofílica.
- El citocromo c se encuentra por encima de la membrana mitocondrial, en el borde del espacio intermembrana.
¿Qué impide que el ciclocromo c deambule hacia el espacio intermembrana? Si lo hiciera, interrumpiría el flujo eficiente de electrones. Es posible que el citocromo c se mueva hacia adelante y hacia atrás entre el Complejo III y el Complejo IV a través de un mecanismo llamado “dirección”. En la dirección, el transportista es guiado a lo largo de un camino a través de cargas complementarias. Por ejemplo, si la membrana está cargada negativamente debido a grupos polares en la superficie de la membrana, entonces las cargas positivas en la superficie del citocromo c pueden restringir su movimiento a la superficie de la membrana. Eso por sí solo reduciría su movilidad de tres dimensiones (en cualquier lugar del espacio intermembrana) a dos dimensiones (en cualquier lugar de la superficie de la membrana). Es posible que las interacciones adicionales reduzcan su movilidad aún más a una pista unidimensional entre los dos complejos.
- La dirección, basada en cargas complementarias, evita que el citocromo c se pierda en el espacio intermembrana.
Ejercicio \(\Índice de página{1}\)
Sugieren posibles residuos de aminoácidos en la superficie del citocromo c que pueden ayudarlo a permanecer en una superficie de membrana con carga negativa.
Respuesta
La arginina y la lisina están cargadas positivamente a pH neutro.
Ejercicio \(\Índice de página{2}\)
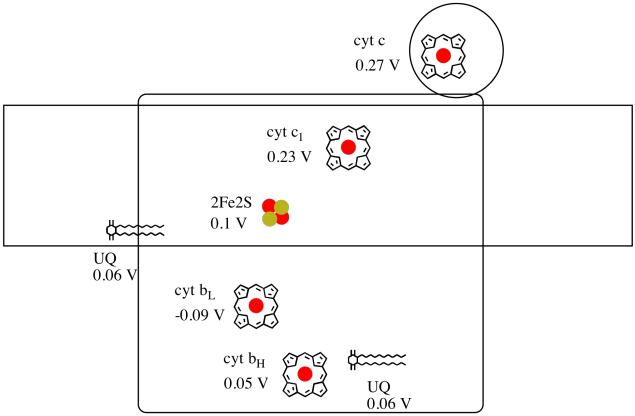
Es difícil medir el potencial de reducción de un sitio individual dentro de una proteína. Sin embargo, los investigadores han podido estimar estos valores midiendo espectros de EPR bajo diversas condiciones. Asumiendo los potenciales de reducción a continuación, dibuje un diagrama de progreso de reacción para el transporte de un electrón desde el donante inicial de ubiquinona hasta el citocromo c.
 Respuesta
Respuesta
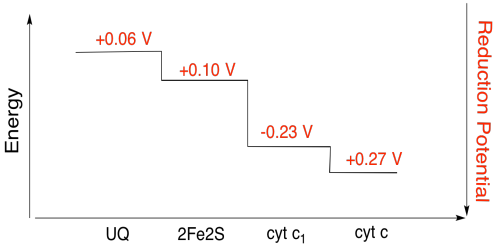
Ejercicio \(\Índice de página{3}\)
Utilizando los valores de la figura anterior, calcule el cambio de energía cuando se transfiere un electrón del cúmulo de 2Fe2S al citocromo c1.
Respuesta
Asumiendo que los potenciales de reducción son:
2Fe2S(buey) + e- → 2Fe2S(rojo) Eored = 0.10 V
cyt c1(buey) + e- → cyt c1(rojo) Eored = 0.230 V
Entonces la diferencia de potencial para la reacción, ΔEo = 0.23 – (0,10) V = 0,13 V.
La relación de Faraday ΔG = – n F ΔEo da
ΔG = – 1 x 96.485 J V-1 mol-1 x 0,13 V = 12.543 J mol-1 = 12.5 kJ mol-1
Ejercicio \(\Índice de página{4}\)
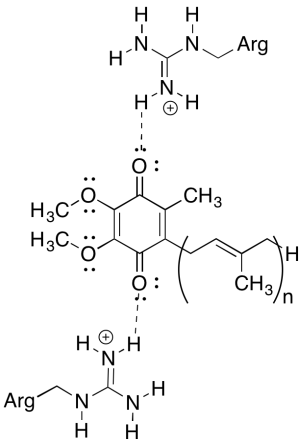
Una de las cosas desconcertantes de este complejo es que, en el ciclo de reciclaje de electrones, la transferencia de electrones parece ir de una ubiquinona inicial a una ubiquinona final, sin una fuerza impulsora general. Sin embargo, los potenciales de reducción son muy sensibles al medio ambiente. Mostrar cómo los residuos de arginina cercanos podrían hacer que el potencial de reducción de una ubiquinona sea más positivo.
Respuesta
Los residuos positivos de arginina conferirían una carga positiva parcial a la ubiquinona a través de enlaces de hidrógeno; la ubiquinona tendría un potencial de reducción más positivo como resultado.
Vea la página de enfoque sobre la estructura del Complejo III en Biochemistry Online.
Estructura cristalina de rayos X del Complejo III de: Gao, X., Wen, X., Esser, L., Quinn, B., Yu, L., Yu, C.-A., Xia, D. Base estructural para la reducción de quinona en el complejo bc1: un análisis comparativo de las estructuras cristalinas del citocromo mitocondrial bc1 con sustrato unido e inhibidores en el sitio Qi. Biochemistry 2003, 4, 9067-9080. (1 NTZ)
Estructura cristalina de rayos X del Complejo III con citocromo c unido de: Solmaz, S. R., Hunte, C. Estructura del complejo III con citocromo c unido en estado reducido y definición de una interfaz de núcleo mínima para transferencia de electricidad. J. Biol. Chem. 2008, 283, 17542-17549. (3CXH)
Estructura cristalina de rayos X del citocromo c de: Enguita, F. J., Pohl, E., Turner, D. L., Santos, H., Carrondo, M. A. Evidencia estructural de una vía de transferencia de protones junto con reducción de hemo del citocromo c” de Methylophilus methylotrophus. J. Biol. Inorg. Chem. 2006 11, 189. (1OAE)
Atribución
Chris P Schaller, Ph. D., (Colegio de San Benito / Universidad de San Juan)