Anticoagulación con citrato durante la TRCR para lesión renal aguda
- Lesión renal aguda
- Manejo de la AKI: terapias de reemplazo renal para la AKI
- Hemodiálisis, hemofiltración y hemodiafiltración
- Inicio y sincronización de la TRR para IRC-TRR intermitente frente a TRR continua
- La anticoagulación durante la terapia continua de reemplazo renal (TRCR)
- Citrato: el mecanismo de su acción anticoagulante y su aplicación en TRCR
- Alteraciones metabólicas potenciales durante la TRCR con anticoagulación con citrato
- Monitorización bioquímica de los pacientes que reciben TRCR con citrato anticoagulado
Lesión renal aguda
La lesión renal aguda (AKI), un síndrome clínico con muchas causas posibles, se define simplemente como una disminución abrupta de la función renal durante un período de horas o días, evidenciada por un aumento reciente de la concentración de creatinina sérica y/o reducción de la producción de orina .
Es distinta de la enfermedad renal crónica (ERC) en la que la disminución de la función renal es lenta pero irreversible, y se produce durante un período de meses y años. Por supuesto, la AKI puede ocurrir en personas con ERC subyacente, y un diagnóstico de AKI se asocia con un riesgo mayor de lo normal de un diagnóstico final de ERC .
Las directrices acordadas internacionalmente establecen que se puede hacer un diagnóstico de ICSA si:
• la creatinina sérica aumenta ≥ 0,3 mg/dL (26,5 µmol/L) en 48 horas; o
• ha habido un aumento del 50% o mayor de la creatinina sérica en los últimos 7 días; o
• el volumen de orina es
La ICSA abarca todo el espectro de gravedad desde una disminución leve de la función renal (ICSA en estadio 1) insuficiencia renal (estadio 3 AKI). La estadificación depende de la medida de la creatinina sérica, con o sin datos de la producción de orina (Tabla I)
|
Etapa |
Creatinina Sérica |
Producción de orina |
|
1 |
1.5-1.9 aumento de 0,3 mg/dL (26,5 µmol/L) veces el valor basal |
durante 6-12 horas |
|
2 |
2.0-2.9 veces la línea de base |
⩾ 12 horas |
|
3 |
3.0 veces el valor basal |
duranteO |
TABLA I: Las tres etapas de severidad de la AKI (de ref. 1)
Las causas de la IRA se clasifican convencionalmente en tres categorías: prerrenal; renal (intrínseca); y postrenal, enfatizando el hecho de que la AKI puede tener una etiología renal específica, pero también puede ser el resultado de un problema primario fuera del riñón.
Cualquier afección que tenga el efecto de reducir el flujo sanguíneo al riñón (perfusión renal) es una causa potencial de IRA prerenal; estas afecciones incluyen: hipovolemia debido a vómitos, diarrea, hemorragia, quemaduras o shock séptico; y reducción del gasto cardíaco debido, por ejemplo, a insuficiencia cardíaca e insuficiencia hepática (cirrosis). La causa principal de la AKI intrínseca es la necrosis tubular renal, resultante de la isquemia renal o de la ingestión de drogas/toxinas nefrotóxicas.
La sepsis, la causa más común de IRA en los enfermos críticos, se debe en parte a una lesión renal intrínseca mal definida similar a la necrosis tubular renal . Finalmente, el AKI postrenal es el resultado de cualquier afección que obstruya el flujo de orina distal al riñón; estos incluyen: cálculos renales (cálculos), enfermedad de la próstata (tumor/hipertrofia), disfunción de la vejiga y estenosis uretral.
Manejo de la AKI: terapias de reemplazo renal para la AKI
No hay un tratamiento específico para la AKI y el manejo es en gran medida de apoyo con un tratamiento dirigido a la causa subyacente. La retirada de fármacos nefrotóxicos, la reanimación con líquidos y la corrección de la alteración de electrolitos y ácido-base forman parte de este tratamiento general de apoyo . Puede ser necesaria la administración de fármacos vasopresores o inotrópicos para restablecer la presión arterial y el gasto cardíaco normales.
La terapia de reemplazo renal (TRR), el enfoque de este artículo, representa el tratamiento de último recurso para pacientes con IAK grave que no responde al tratamiento de apoyo conservador. Alrededor del 23% de los pacientes de la UCI con ICA (es decir, alrededor del 13% de todos los pacientes de la UCI) reciben TRR .
Terapia de reemplazo renal (RRT) es el término genérico para todos los tratamientos que buscan reemplazar la función renal. El trasplante de riñón de donante a personas con enfermedad renal en etapa terminal puede considerarse la última RTR, pero el término se reserva más a menudo para aquellas terapias que reemplazan el filtrado de sangre y las funciones homeostáticas del riñón por diálisis, un proceso que utiliza una membrana semipermeable como filtro de sangre. Hay dos tipos amplios de RTR dialítica disponibles para el tratamiento de la IRA (y, para el caso, la ERC en etapa terminal): diálisis peritoneal y hemodiálisis.
Por el contrario, la hemodiálisis implica filtrar la sangre en una máquina fuera del cuerpo (extracorpórea). La sangre se bombea al filtro/dializador, donde se eliminan los productos de desecho y el exceso de líquido, y luego se devuelve al cuerpo. Este circuito extracorpóreo (la máquina de diálisis y sus tubos de conexión desde y hacia el paciente) es un entorno procoagulante.
Hemodiálisis, hemofiltración y hemodiafiltración
Las máquinas modernas de diálisis tienen la opción de hemofiltración (HF) y hemodiálisis (HD), lo que permite la posibilidad de tres modalidades dialíticas diferentes para el tratamiento de la IRA: hemodiálisis (HD), hemofiltración (HF) y hemodiafiltración (HDF).
En el núcleo de las tres modalidades está la membrana semipermeable que constituye un filtro de sangre. A medida que la sangre bombeada desde el paciente fluye por un lado de esta membrana, el exceso de agua y los solutos residuales pasan a través de la membrana. El filtrado o efluente se bombea a los residuos a medida que la sangre filtrada se devuelve al paciente.
El proceso de hemodiálisis (EH) implica el uso de un líquido de diálisis que fluye de forma continua y contracorriente a la sangre del otro lado de la membrana. La composición y el caudal del fluido de diálisis garantizan un gradiente de concentración constante a través de la membrana semipermeable con respecto a los solutos sanguíneos. Estos gradientes de concentración a su vez facilitan la difusión controlada de moléculas de soluto a través de la membrana.
Para solutos como la urea y la creatinina, que deben eliminarse de la sangre, el gradiente de concentración es tal que la dirección de difusión es de la sangre al líquido de diálisis, mientras que para solutos como el bicarbonato, que a menudo se debe agregar a la sangre para corregir la acidosis asociada con la AKI grave, el líquido de diálisis con una alta concentración de bicarbonato en relación con la sangre garantiza que la difusión sea en la dirección opuesta, desde el líquido de diálisis a la sangre. El ajuste de la composición del fluido de diálisis y del caudal permite, por lo tanto, la corrección metabólica específica del paciente.
El exceso de líquidos es a menudo una característica de la AKI que se corrige durante la hemodiálisis. Esto se logra mediante ultrafiltración, que depende del gradiente de presión hidrostática que existe a través de la membrana semipermeable. La presión hidrostática positiva relativa en el lado sanguíneo de la membrana “empuja” efectivamente el agua de la sangre al líquido de diálisis.
Esta ultrafiltración también facilita el paso de moléculas de soluto, que son arrastradas junto con el agua durante la ultrafiltración por un mecanismo llamado convección de soluto (o arrastre de solvente). El efecto combinado de la difusión de solutos, la convección de solutos y la ultrafiltración durante la hemodiálisis tiene como objetivo garantizar que el volumen y la composición del fluido dentro del compartimiento extracelular e intracelular se restaure, lo más cerca posible, de lo que pertenece a aquellos con riñones que funcionan normalmente.
La hemodiafiltración (HDF) es la combinación de HF y HD. Permite un aclaramiento óptimo de solutos de bajo peso molecular por difusión al fluido de diálisis, combinado con un aclaramiento óptimo de solutos de alto peso molecular por convección y ultrafiltración. Al igual que con HF, HDF requiere fluido de reemplazo continuo; y al igual que con HD, HDF requiere fluido de diálisis.
Inicio y sincronización de la TRR para IRC-TRR intermitente frente a TRR continua
Todas las terapias de reemplazo renal (DP, HD, IC y HDF) se pueden administrar de forma intermitente (es decir, normalmente en sesiones de 3-4 horas) o continua hasta que se restablezca la función renal. Para los pacientes con insuficiencia renal terminal, que requieren RTR de por vida (crónica), el tratamiento es exclusivamente hemodiálisis intermitente (ECI), casi invariablemente administrado en cuatro sesiones por hora, tres veces a la semana .
Los pacientes con IKA solo tienen un requisito temporal de RTR para apoyar la función renal durante la resolución de la enfermedad crítica/aguda que precipitó la IKA. La duración media de la RRT entre los pacientes con AKI es de alrededor de 13 días , aunque en casos particulares solo puede ser necesaria durante unos pocos días o prolongarse durante muchas semanas.
Los indicadores tradicionales (absolutos) para el inicio de RRT en AKI incluyen:
• hiperpotasemia (potasio plasmático > 6,0-6,5 mmol/L)
• uremia grave (urea plasmática > 30 mmol/L)
• signos de encefalopatía urémica
• acidosis (pH • edema pulmonar agudo
Puede ser beneficioso comenzar el tratamiento antes de estos efectos extremos de AKI son evidentes, pero el momento óptimo para iniciar (y detener) RRT no está claro y es objeto de investigación en curso . En la actualidad no hay datos fiables que respalden un tipo particular de RRT para AKI y, en consecuencia, se han empleado todos los tipos de RRT.
Las guías actuales, sin embargo, reflejan un consenso de que, cualquiera que sea la modalidad, la TRR se debe administrar de forma continua en lugar de intermitente a los pacientes más críticos (hemodinámicamente inestables). Encuestas recientes indican que hoy en día las terapias continuas de reemplazo renal (TRRC) se utilizan con mucha más frecuencia que las terapias intermitentes para la IRA, y que la TRRC más utilizada es la hemofiltración venosa venosa continua (FVVHV), seguida de la hemodiafiltración venosa venosa continua (FVVHV).
La anticoagulación durante la terapia continua de reemplazo renal (TRCR)
TRCR, al igual que todas las demás terapias de reemplazo renal, excepto la diálisis peritoneal, implica el bombeo de sangre a través de un circuito extracorpóreo no fisiológico. La propiedad inherente de la sangre para coagularse (coagularse) en contacto con superficies no fisiológicas determina que para mantener un circuito extracorpóreo “libre de coágulos” del paciente, la sangre debe ser anticoagulada.
La TRCR tiene una necesidad particular de anticoagulación, en comparación con las modalidades intermitentes, debido a las sesiones de tratamiento prolongadas y a la velocidad relativamente lenta a la que se bombea sangre a través del circuito . Además, la sangre de los pacientes que requieren TRCR a menudo ya está en un estado procoagulante relativo debido a una enfermedad crítica subyacente (por ejemplo, sepsis) o trauma .
Durante muchos años, la heparina, ya sea heparina no fraccionada (UF) o heparina de bajo peso molecular (HBPM), fue el único anticoagulante utilizado en procedimientos dialíticos, incluida la TRCR. La heparina se sigue utilizando; es un medio de anticoagulación barato y generalmente seguro para la mayoría de los pacientes que requieren TRR.
Sin embargo, la anticoagulación sistémica con heparina, que no se puede evitar, inevitablemente conlleva un mayor riesgo de sangrado, por lo que la anticoagulación con heparina durante los procedimientos dialíticos está absolutamente contraindicada para aquellos que actualmente sangran o tienen un riesgo de sangrado superior al normal.
Además, la heparina puede, en una pequeña minoría (
Los posibles riesgos de sangrado y de HIT-II asociados con el uso de heparina destacaron la necesidad de un anticoagulante alternativo para algunos pacientes que requieren TRR. Citrato siempre una alternativa. La anticoagulación regional con citrato del circuito de diálisis, utilizada por primera vez con éxito a principios de la década de 1980 , se reservó originalmente para esa pequeña minoría de pacientes para los que la heparina está contraindicada. Eso cambió con los resultados de ensayos controlados aleatorios que compararon TRCR anticoagulada con heparina con TRCR anticoagulada con citrato; estos demostraron que el citrato es un anticoagulante más eficaz y seguro que la heparina .
En consecuencia, el citrato ha surgido en los últimos años como el anticoagulante de elección para todos los pacientes con IRA que requieren TRCR . Las unidades de cuidados intensivos de todo el mundo informan ahora de que han pasado de la heparina a la anticoagulación con citrato regional para la TRCR . Algunas autoridades incluso recomiendan el uso de anticoagulación con citrato en lugar de heparina para la hemodiálisis intermitente (crónica) (EIC).
Citrato: el mecanismo de su acción anticoagulante y su aplicación en TRCR
El citrato, que se ha utilizado para anticoagular / preservar la sangre donada para transfusiones durante más de un siglo , previene la coagulación de la sangre a través de su capacidad para unirse (quelatar) al calcio ionizado (aCi) que circula en el plasma sanguíneo. Estea es un cofactor necesario tanto para la agregación plaquetaria como para varios pasos clave en las vías de coagulación intrínseca y extrínseca que son responsables de la producción de fibrina y, por lo tanto, de la formación de coágulos de fibrina.
La coagulación sanguínea se previene mediante la reducción de la concentración plasmática de aCi a alrededor de 0,35 mmol/L (rango normal de referencia 1,15-1,30 mmol/L). Este estado no fisiológico, severamente hipocalcémico, se logra elevando la concentración plasmática de citrato a alrededor de 3 mmol/L (concentración plasmática normal de citrato ~0,1 mmol/L ).
Aunque Morabito et al. describen diferencias en detalle, todos los protocolos de anticoagulación con citrato durante la TRCR implican la infusión continua de una solución que contiene citrato (generalmente citrato trisódico o solución ácido-citrato-dextrosa (ACD)) a la línea de prefiltro/diálisis, cerca de donde sale el paciente, ya sea como solución separada o combinada con líquido de reemplazo de la predilución. El caudal de esta infusión se ajusta para lograr una concentración de citrato en sangre de ~3 mmol/L y, por lo tanto, una plasmático de alrededor de 0,35 mmol/L.
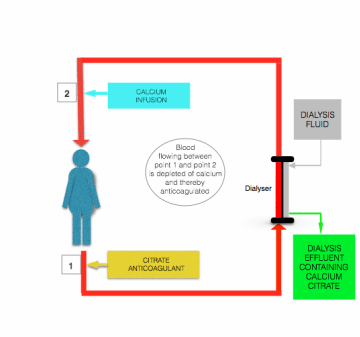
La hipocalcemia inducida por infusión de citrato se corrige antes de que la sangre regrese al paciente, mediante infusión de una solución que contiene calcio (cloruro de calcio o gluconato de calcio) a la línea de postfiltro cerca de donde ingresa al paciente (ver la figura anterior).
La principal ventaja de seguridad de la anticoagulación con citrato sobre la anticoagulación con heparina es que la anticoagulación se limita al circuito extracorpóreo. Esta llamada “anticoagulación regional” se logra porque la mayor parte del citrato infundido se elimina (como aniones de citrato o quelato de citrato de calcio) de la sangre durante el paso a través del filtro/dializador .
Cualquier citrato restante en la sangre postfiltro se diluye en la circulación sistémica y se metaboliza rápidamente a dióxido de carbono y agua mediante el ciclo de Krebs dependiente del oxígeno en las mitocondrias de las células tisulares (predominantemente células hepáticas ).
El metabolismo del citrato está asociado con la producción de bicarbonato: por cada citrato de 1 mmol metabolizado, se genera bicarbonato de 3 mmol. El aclaramiento rápido del citrato (la semivida del citrato en sangre es normalmente de unos 5 minutos ) a través de esta vía principalmente hepática garantiza normalmente la ausencia de anticoagulación sistémica durante la TRCR y, por lo tanto, ningún riesgo adicional de hemorragia.
Alteraciones metabólicas potenciales durante la TRCR con anticoagulación con citrato
La aparente reticencia a adoptar completamente la TRCR con anticoagulación con citrato en todos los pacientes con IAK hasta hace poco se ha atribuido a la preocupación por las alteraciones ácido-base y electrolíticas que pueden ocurrir en los pacientes que reciben el tratamiento .
Se han notificado las siguientes alteraciones electrolíticas y ácido-base en pacientes tratados con TRCR anticoagulada con citrato :
• hipocalcemia/hipercalcemia
• hipomagnesia/hipermagnesia
• hiponatremia/hipernatremia
• alcalosis metabólica
• acidosis metabólica
Estas alteraciones pueden surgir por varias razones, pero la acumulación de citrato en la circulación periférica (toxicidad por citrato) puede ser fundamental para la mayoría de estas alteraciones. Las razones por las que el citrato puede acumularse durante la TRCR incluyen:
• Alteración del metabolismo del citrato debido a una enfermedad hepática y/o reducción de la entrega de oxígeno debido a una perfusión inadecuada (p. ej. en shock séptico / cardiogénico)
• Reducción progresiva de la permeabilidad de la membrana durante la diálisis con la consiguiente reducción de la filtración de citrato y aumento concomitante de la administración de citrato a la circulación sistémica
• Error operativo: aumento accidental de la velocidad de infusión de citrato al circuito extracorpóreo y aumento concomitante de la administración de citrato a la circulación sistémica
• Transfusión de productos sanguíneos: el conservante de citrato presente en los productos sanguíneos aumenta la carga de citrato en la circulación sistémica derivada de la TRCR
Independientemente de la causa, la acumulación de citrato en la circulación periférica puede provocar quelación de citrato del calcio ionizado circulante, con la consiguiente reducción de la concentración de calcio ionizado en plasma (hipocalcemia). Si la hipocalcemia es suficientemente grave puede causar arritmia cardíaca y, en última instancia, paro cardíaco .
Aunque el calcio ionizado en plasma se reduce durante la acumulación de citrato (toxicidad), el calcio total aumenta (lo que indica hipercalcemia) porque el calcio unido al citrato se incluye en el calcio total medido. Aumento de la proporción de calcio ionizado total (normalmente 2,0) a > 2.se ha encontrado que 1 es la señal más fiable de toxicidad por citrato en ausencia de una estimación de citrato plasmático disponible de forma rutinaria .
El riesgo de aumento de sodio plasmático (hipernatremia) asociado a la anticoagulación con citrato se debe al alto contenido de sodio (hipertonía) de algunas soluciones de citrato utilizadas en TRCR. Por ejemplo, la solución al 4% de citrato trisódico que se utiliza en algunos protocolos contiene sodio a una concentración de 420 mmol/L. En la práctica, el uso de líquidos de diálisis/reemplazo hipotónicos puede mitigar este riesgo y la hipernatremia es, por lo general, una complicación rara de la anticoagulación con citrato .
El riesgo de hipomagnesia (magnesio sérico reducido) durante la anticoagulación con citrato refleja el hecho de que, al igual que el calcio, el magnesio es un ion divalente que también puede unirse al citrato (quelato). Si las pérdidas de magnesio debidas a la acción quelante del citrato no se compensan completamente con el magnesio en los líquidos de diálisis/reemplazo, puede ocurrir hipomagnesia .
Monitorización bioquímica de los pacientes que reciben TRCR con citrato anticoagulado
Las pruebas en el punto de atención utilizando un analizador de gases sanguíneos ubicado dentro de la unidad de cuidados intensivos permiten la medición rápida y conveniente de la mayoría de los parámetros (calcio ionizado, pH, bicarbonato, exceso de base, sodio y lactato), pero la estimación de calcio y magnesio totales en suero generalmente no está disponible en estas plataformas y las muestras deben enviarse al laboratorio para estas mediciones.
Dos estudios recientes proporcionan evidencia de que algunos analizadores de gases sanguíneos pueden no ser confiables para medir el calcio ionizado a concentraciones extremadamente bajas y no fisiológicas (~0.3 mmol / L) presentes en la sangre postfiltro, aunque su capacidad para medir con precisión el calcio ionizado en plasma en la circulación sistémica (donde la concentración es mucho mayor) no está en duda.
|
Parámetro medido |
Intervalo de monitorización |
Valores objetivo o aprox. rangos de referencia |
Finalidad de la medición |
Acción correctiva si está fuera del objetivo |
|
Concentración de calcio ionizado (a) posterior al filtrado, es decir, muestras de sangre del puerto posterior al filtrado. |
Dentro de 1 hora desde el inicio y después de cualquier cambio de dosis de citrato, luego cada 4-6 horas |
0.25-0.35 mmol / L |
|
Ajuste de la dosis de citrato: aumentar sia > 0,35, disminuir sia |
|
Calcio ionizado sistémico (aCi), es decir, muestras de sangre del paciente |
Línea de base (antes de comenzar), luego 1 hora después de comenzar, luego al menos cada 4-6 horas |
1.15-1.30 mmol / L |
|
Ajuste de la velocidad de infusión de calcio; aumento sia 1.30 |
|
Calcio total sistémico (TotCa), i. e. muestra de sangre del paciente (TotCa =a + calcio unido a albúmina + calcio unido a citrato) |
Al menos cada 12-24 horas (debe ser simultánea a la estimación sistémica de calcio ionizado) |
Solo se requiere para la determinación de Relación totCa :a (ver a continuación) |
||
|
Relación entre el calcio total y el calcio ionizado (TotCa:a) |
Al menos cada 12-24 horas |
Para detectar acumulación/toxicidad de citrato, a veces llamado “bloqueo de citrato” |
Las opciones incluyen:
|
|
|
Análisis de gasometría arterial
|
Basal (antes de comenzar). Dentro de 1 hora de inicio, luego al menos cada 4-6 horas. |
pH 7,35-7,45 bicarbonato 23-28 mmol / L BE–2-+3 mmol / L |
Para detectar alteraciones ácido-base: alcalosis metabólica acidosis metabólica |
Las opciones en el caso de alcalosis metabólica incluyen:
|
|
Sodio sérico |
Una vez al día |
135-145 mmol / L |
Para detectar hipernatremia / hiponatremia |
Frecuencia rara-verificar el líquido de diálisis/reemplazo correcto |
|
Lactato sérico |
Basal (antes de comenzar), luego según las necesidades clínicas |
Para ayudar a identificar a aquellos que están en riesgo de toxicidad por citrato |
Considere, junto con la relación TotCa:Tot, el riesgo de toxicidad por citrato |
|
|
Magnesio en suero |
Al menos una vez al día |
Para detectar hipomagnesia |
Corrección con infusión de magnesio |
TABLA II: Monitorización bioquímica durante la TRCR anticoagulada con citrato (Ref 24)