Canales y transportadores de iones de cloruro: desde curiosidades de la naturaleza y la fuente de enfermedades humanas hasta objetivos de fármacos
Publicado: 20 de agosto 2013 | |
Al principio de su educación de pregrado, el estudiante se introduce en varios tipos de proteínas de membrana integral: receptores, proteínas de adhesión, canales iónicos, bombas iónicas y transportadores iónicos. A medida que avanzan en sus estudios, descubren que las familias de genes y las estructuras proteicas discretas son responsables de estas diferentes clases de proteínas y nunca hay ninguna razón para considerar que podría haber ambigüedad en la asignación de una proteína en particular a su clase de proteína apropiada.
Esto satisface prácticamente todos los casos, desde el aula hasta el laboratorio de investigación hasta que consideramos los canales de cloruro. Sabemos que existen, que son importantes y que pueden ser buenos blancos de medicamentos en varias áreas de enfermedad, pero hasta hace poco, han permanecido un poco estigmatizados y pasados de moda en el mundo de la terapéutica. La falta de ligandos selectivos no ha ayudado en absoluto. La única excepción a esto ha sido el receptor GABA-A que está acoplado a un canal de cloruro intrínseco que se abre al unirse al neurotransmisor inhibitorio GABA. Las benzodiacepinas han potenciado este receptor desde que el Valium estuvo disponible en la década de 1960, proporcionando efectos sedantes y anticonvulsivos. Esto introduce un concepto importante: hay varias familias de genes y diferentes tipos de proteínas que se pueden describir como canales de cloruro.
Esto contrasta con lo que entendemos de los canales iónicos selectivos de cationes, donde hay poca flexibilidad en la estructura de la proteína que puede formar un poro que es selectivo para el potasio, el sodio o el calcio; la diversidad de estos canales iónicos es provocada por las variaciones en los dominios de la proteína distintos del poro que influyen en el comportamiento de apertura y cierre. Para ser justos, no parece haber muchas razones fisiológicas por las que un canal de aniones deba exhibir selectividad de cloruro, ya que hay poco papel fisiológico en el transporte de membrana de otros haluros o aniones pequeños; cualquier canal de aniones será por defecto un canal de cloruro desde un punto de vista fisiológico. Por otro lado, las corrientes de membrana de potasio, sodio y calcio juegan diferentes roles fundamentales y la permeabilidad selectiva de la membrana a estos cationes es crucial para la función celular y, de hecho, para la vida misma.
Los receptores GABA-A son miembros de las familias de canales iónicos activados por ligando pentámero cys-loop, que incluyen varios tipos de canales activados por neurotransmisores excitatorios e inhibitorios. La proteína reguladora transmembrana de fibrosis quística (CFTR) es un canal de cloruro regulado por nucleótidos. Es un miembro de la diversa familia de transportadores de casetes de unión a ATP (ABC) y es el único que no parece transportar ningún sustrato a través de una membrana, sino que funciona como un canal de cloruro. La familia CLC de canales de cloruro dependientes de voltaje surge de otra familia génica distinta y tiene una estructura general única entre las proteínas de membrana. Esta familia de proteínas ha traído muchas sorpresas en los últimos 30 años y los miembros de esta familia se presentarán aquí y también cómo podrían considerarse objetivos de medicamentos.
Otros desarrollos interesantes del campo de los canales de cloruro han surgido tras la identificación molecular de proteínas subyacentes a los canales de cloruro activado por calcio (ClCa). Funcionalmente, conocemos sus funciones fisiológicas desde hace algún tiempo, pero la reciente identificación molecular de las proteínas del canal ha permitido el desarrollo de herramientas moleculares y farmacológicas para sondear y alterar su actividad. Esta revisión se centra en el potencial farmacológico de atacar los canales de ClCa y las proteínas CLC; su función y localización subcelular se resumen en la Figura 1.
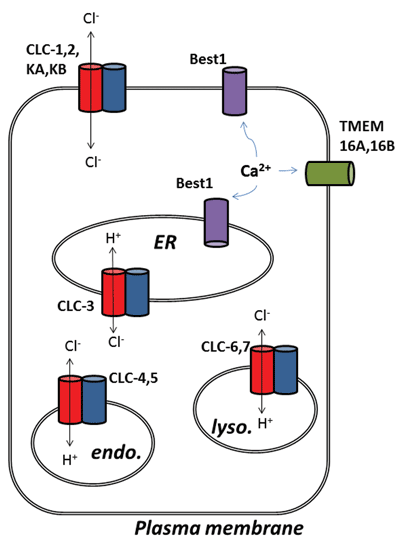
Gráfico 1
Introducción a las proteínas CLC
Los nueve miembros de esta familia de proteínas son CLC-1 a 7, CLC-KA y KB. El miembro fundador, CLC-1, es el canal de cloruro controlado por voltaje del músculo esquelético y se discutirá a continuación. Se han llevado a cabo muchos estudios funcionales en un homólogo con el título honorífico de CLC-0, aislado del órgano eléctrico Electroplax, que permite al rayo aturdir a sus víctimas acuáticas. La reconstitución de CLC-0 en bicapas lipídicas y el registro electrofisiológico de las corrientes que fluyen a través de canales iónicos individuales revelaron una propiedad intrigante. Por lo general, cuando se registra la corriente de un pequeño parche de membrana que contiene un solo canal iónico, se observan fluctuaciones entre dos amplitudes de corriente: una que representa el canal cerrado y la otra que representa la corriente que fluye a través del canal abierto. Las fluctuaciones reflejan transiciones entre estados cinéticos abiertos y cerrados. Con el CLC-0, sin embargo, fue evidente que la proteína de un solo canal iónico consistía en dos poros equivalentes que podían abrirse de forma independiente1. Por lo tanto, se describió este canal como de doble cañón (Figura 2). Por lo tanto, no fue de gran sorpresa que las estructuras cristalinas de homólogos de bacterias entéricas revelaran que el complejo proteico era un dímero, con cada subunidad poseyendo una trayectoria conductora de iones (Figura 2).
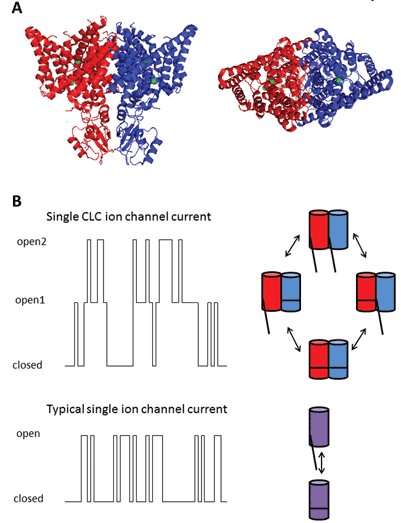
Gráfico 2
La segunda sorpresa surgió cuando se llevaron a cabo experimentos funcionales detallados con CLC-ec1 de E. coli. En lugar de funcionar como un canal de cloruro, como su pariente perdido hace mucho tiempo en el músculo esquelético de los vertebrados, el CLC-ec1 es un transportador de intercambio 2Cl-/H+, o antiportador, con estequiometría de intercambio estricta 2:13. Esta proteína es importante para la supervivencia de bacterias entéricas en ph4 bajo y es probable que explote un gradiente de cloruro para mantener el pH celular en un nivel tolerable. Por lo tanto, los CLC procarióticos podrían ser blancos de los inhibidores para tratar la infección patógena por E. coli o salmonela4. El descubrimiento del comportamiento de intercambio iónico estimuló naturalmente nuevos esfuerzos para determinar si alguno de estos intercambios de cloruro por protones existía en los CLCS de mamíferos, en el supuesto de que el intercambio de Cl–/H+ podría ser la verdadera función de los CLCs arquetípicos y los identificados como canales de cloruro podrían ser simplemente excepciones a la regla. Este parece ser el caso, ya que hay fuertes pruebas de que CLC-3 a CLC-7 funcionan como transportadores de intercambio 2Cl–/H+, residiendo principalmente en orgánulos intracelulares, mientras que CLC-1, CLC-2, KA y KB son canales iónicos verdaderos conductores de cloruro de membrana plasmática5-9. Debido a que la propiedad arquetípica del CLC es el transporte de intercambio, que se encuentra en todas las formas de vida celular, la última subclase de proteínas, los canales de cloruro de buena fe, pueden considerarse transportadores de cloruro “rotos”, que han perdido el acoplamiento del transporte de cloruro al movimiento de un segundo ion sustrato.
CLC-1
Este fundador de la familia CLC es el canal de cloruro activado por voltaje del músculo esquelético y sirve para regular el potencial de membrana y repolarizar la membrana después de los potenciales de acción para relajar el músculo. En la mayoría de los tejidos, esperaríamos que los canales de potasio desempeñaran este papel, lo que hacen en el músculo cardíaco y liso, así como en la excitabilidad de la membrana reguladora en otros tipos de células. El sistema de túbulos transversales es una extensión de la membrana plasmática (sarcolema) y penetra en el tejido contráctil. Es fundamental para la rápida propagación de la actividad eléctrica en todo el músculo y orquesta la contracción rápida y controlada. El flujo de potasio de las células musculares hacia el espacio confinado del túbulo en t elevaría la concentración extracelular de potasio y colapsaría este gradiente iónico, lo que llevaría a una prolongada despolarización de la membrana. Con los canales de cloruro desempeñando el papel predominante de repolarización, esto se evita. La pérdida de mutaciones funcionales en CLC-1 conduce a miotonía en hombres, cabras y ratones (para una revisión reciente, véase 10) y se caracteriza por un deterioro de la relajación muscular, consistente con la pérdida de una corriente de membrana repolarizante.
Con la expresión confinada al músculo esquelético, el CLC-1 podría ser un objetivo atractivo para los medicamentos que controlan la contracción muscular al aumentar o disminuir la función del CLC-1 y, por lo tanto, reducir o aumentar la excitabilidad muscular, respectivamente. Los compuestos que aumentan la función del CLC-1 podrían tratar la miotonía, particularmente en los casos en que podrían compensar la pérdida parcial de la actividad del canal de cloruro. La inhibición de CLC-1 podría reducir el umbral de contracción muscular y puede ser útil en casos de debilidad muscular o enfermedades degenerativas como la distrofia muscular.
CLC-2
El canal de cloruro de rectificación interna, CLC-2, tiene una distribución tisular algo generalizada. Se puede encontrar en las neuronas centrales, donde regula la actividad neuronal11-13. En los astrocitos, su orientación subcelular a las uniones celulares está regulada por una interacción con GlialCAM (MLC1), mutaciones en las que interrumpen esta orientación y causan leucoencefalopatía14 megalencefálica. Los intereses terapéuticos recientes involucran la expresión de CLC – 2 en la mucosa intestinal y los bronquiolos pulmonares, donde desempeña un papel en las secreciones intestinales y pulmonares, respectivamente. Se propuso que la lubiprostona, un medicamento utilizado clínicamente para aliviar el estreñimiento, ejerciera su efecto activando CLC-2, pero este efecto es controvertido. Mientras que este compuesto activa los canales CLC-2 en algunos estudios, en otros regula el tráfico de CLC-2 y aumenta la función CFTR a través de la activación del receptor de prostaglandinas15,16. Sin embargo, sigue habiendo pruebas suficientes de que el aumento de la función del CLC-2 en las vías respiratorias podría proporcionar una vía alternativa de cloruro en la fibrosis quística17.
CLC-KA / KB
Estos canales de cloruro se expresan notablemente en epitelios renales y contribuyen a la permeabilidad de las membranas celulares al flujo de cloruro pasivo. Tienen un papel clave en la extremidad ascendente y los túbulos distales de la nefrona, proporcionando una ruta basolateral para la reabsorción de cloruro, después del transporte desde la orina primaria a través de la membrana apical. El gen CLCKB, que codifica CLC-KB, es uno de los cinco genes que subyacen al síndrome de Bartter. Las mutaciones de pérdida de función en CLC-KB dan lugar a una reabsorción defectuosa de cloruro y, por lo tanto, conducen a un trastorno de pérdida de sal, que se asocia con poliuria. Una de las principales características de los individuos afectados por mutaciones de CLC-KB (tipo III de Bartter) es la presión arterial baja. Una forma más grave de la enfermedad es causada por mutaciones en el gen BSND (tipo IV de Bartter), que codifica a Barttin, una proteína accesoria importante para el tráfico de CLC-KA y KB a la membrana plasmática18. Esta forma de trastorno también incluye sordera sensorial, que se cree que es causada por la pérdida del tráfico de CLC-KA y KB a las membranas epiteliales en el oído interno. Presumiblemente, la pérdida de actividad de CLC-KA o KB, pero no de ambas, puede ser tolerada por el sistema auditivo. Esto sugiere que los inhibidores selectivos de CLC-KA o CLC-KB, o la inhibición parcial de ambos, pueden actuar como un nuevo diurético de asa con el potencial de disminuir la presión arterial y con pocos efectos secundarios. Esto ha llevado al estudio de su farmacología y al desarrollo de nuevos derivados inhibidores con baja afinidad micromolar 19, que tenían efectos diuréticos cuando se administraban a ratas20. Por otro lado, los fármacos que activan los canales CLC-KB pueden mejorar la actividad residual de los canales defectuosos en pacientes tipo III de Bartter.
CLC-7
De la subclase de transportadores de intercambio 2Cl–/H+, CLC-7 es un objetivo prometedor para la acción farmacológica y su inhibición puede ser beneficiosa en la osteoporosis. Una vez más, esta indicación tiene su origen en observaciones de enfermedades humanas causadas por mutaciones de pérdida de función en CLC-7, que causan osteropetrosis21. En este trastorno, el remodelado óseo por los osteoclastos es deficiente, lo que se cree que es causado por una secreción defectuosa de ácidos y enzimas. Esto conduce a un hueso denso, que si se reproduce por un inhibidor de CLC-7 podría reducir la disolución del hueso y,por lo tanto, fortalecer el esqueleto de los pacientes con osteoporosis 22, 23. En estudios de prueba de concepto, la inhibición farmacológica de la acidificación24 o la interrupción de la función CLC-7 por los antibodios25 redujeron la reabsorción ósea. Sin embargo, es posible que la inhibición de CLC-7 no esté exenta de complicaciones porque los estudios en humanos y ratones sugieren que la falta de función de CLC-7 también puede estar asociada con trastornos de almacenamiento neuronal y degeneración debido a la función lisosomal reducida 26.
Mutaciones humanas con pérdida de función-lecciones de CFTR
Vale la pena una breve pausa en este punto para considerar que algunas de las indicaciones terapéuticas de los nuevos medicamentos dirigidos a la CLC tienen como objetivo tratar trastornos distintos y en el extremo opuesto del espectro a aquellos que son causados por una función defectuosa de la CLC. Además de las descritas anteriormente, la enfermedad de Dent I es una enfermedad renal ligada al cromosoma X que es causada por la pérdida de la función CLC-5 (véase 27 para una revisión reciente). Todos son trastornos hereditarios raros y un defecto importante de la proteína implica una actividad reducida de la proteína o el tráfico a la membrana objetivo. De hecho, muchas mutaciones individuales causan retención de RE y falta de maduración de proteínas. Se podría hacer un paralelo con la fibrosis quística, con la mayoría de los individuos afectados que poseen la mutación ΔF508 retenida en RE. Los enfoques recientes y estratificados para tratar la fibrosis quística han sido el resultado de un ataque de doble punta para corregir el plegamiento de proteínas mutantes (correctores de FQ) y/o aumentar la actividad de los canales de cloruro de CFTR de membrana plasmática (potenciadores de FQ). El éxito está surgiendo con la clase potenciador28, que es efectiva en pacientes con mutaciones que reducen la actividad de CFTR sin pérdida de biosíntesis o tráfico de proteínas (por ejemplo, G551D), sin embargo, la efectividad de los correctores de plegado (que se requiere en la mayoría de los casos) está por establecerse 29. Aunque las enfermedades asociadas con la pérdida de la función del CLC son trastornos genéticos raros, es posible que algún día podamos tratar a personas con miotonía, síndrome de Bartter, enfermedad de abolladuras y osteopetrosis, así como fibrosis quística, con medicamentos que corrijan la causa real de su trastorno.
Canales de cloruro activado por calcio
Finalmente, se mencionarán los canales de cloruro activado por calcio (ClCa), que tienen funciones fisiológicas claramente definidas en varios tipos celulares, pero su identificación molecular sufrió algunos inicios falsos y tartamudos. La historia involucra cuatro tipos de proteínas: miembros de las familias de genes CLCA, Bestrofina, Piolín y TMEM16. En todos los casos, su sobreexpresión recombinante dio lugar a la generación de corrientes de cloruro de membrana que son estimuladas por el aumento de la concentración de calcio intracelular y, en diversos grados, la despolarización de la membrana. El viaje para CLCA llegó a su fin cuando se descubrió que se trataba de una proteína que se secretaba, pero que probablemente también aumentaba la expresión de membrana de los canales de ClCa endógenos al sistema de expressión30. Las proteínas de piolín y bestrofina no presentan todas las propiedades de los canales de ClCa estudiados en los tejidos principales, aunque Best1 parece ser responsable de un componente de ClCa en las neuronas sensoriales31 y también puede ser un importante regulador de la liberación de calcio del retículo endoplasmático32,33. Tres estudios independientes propusieron TMEM16A (también llamado Ano1) como candidato para un componente principal, si no en su totalidad, para un canal de cloruro activado por calcio 34-36. Muchos estudios posteriores, facilitados por la generación de herramientas moleculares, han apoyado esto. TMEM16A es importante para regular la excitabilidad de la membrana en el músculo liso vascular, se regula al alza en un modelo animal de hipertensión pulmonar y el tono puede reducirse mediante inhibición de los canales37,38. En las neuronas sensoriales, TMEM16A acopla la presencia de mediadores inflamatorios a la hiperexcitabilidad de la membrana y la inhibición de TMEM16A tiene efectos antinociceptivos39. En modelos animales de asma, la expresión de este canal de cloruro en particular aumenta, y su inhibición puede tener efectos beneficiales40. También se encuentra en las células intersticiales de Cajal del intestino y se requiere la función del canal para la contracción rítmica del músculo liso en la pared intestinal41. Además, la activación de TMEM16A puede proporcionar una vía alternativa para la secreción de cloruro epitelial en la fibrosis quística 42. Si bien todavía hay un debate en torno a la función precisa del resto de la familia TMEM16, la función ClCa también se ha atribuido a TMEM16B (Ano2), que se cree que es la base del canal ClCa en las células ciliadas olfativas43,44. También puede haber funciones para esta clase de canal iónico en la biología de las células cancerosas y su inhibición puede prevenir la proliferación de cellas45-48.
Observaciones finales
Esta revisión ha destacado las diversas funciones de las proteínas conductoras o transportadoras de cloruro y cómo su disfunción se combina con trastornos humanos o síntomas similares a enfermedades en modelos animales. Existe una grave falta de reactivos farmacológicos que inhiban, activen o mejoren el tráfico de membrana de canales y transportadores de cloruro. Se está progresando con medicamentos que revierten la función defectuosa de la CFTR en la fibrosis quística, lo que se espera que resulte en medicamentos específicos para los diferentes tipos de mutación hereditaria. Los inhibidores y activadores de los canales de cloruro activado por calcio TMEM16A42, 49 están demostrando ser herramientas de laboratorio útiles y los nuevos compuestos podrían hacer fármacos eficaces, especialmente si pueden producir efectos específicos en los tejidos. Las moléculas específicas para los CLCS en particular son probablemente las más esquivas. Comprender la base estructural de la activación del CLC dependiente de volta50 podría identificar dominios proteicos a los que se puede apuntar mediante un diseño racional de fármacos basado en la estructura. Estas herramientas nos permitirán poner a prueba algunas de las ideas terapéuticas novedosas que se han revisado y presentado aquí.
Biografía del autor

El Dr. Jon Lippiat completó su doctorado en la estructura, función y farmacología de los canales de potasio en la Universidad de Leicester. Estudió función de células beta pancreáticas y diabetes en la Universidad de Oxford antes de su nombramiento como profesor de Farmacología en la Universidad de Leeds. Su investigación consiste en dilucidar las propiedades estructurales y fisiológicas de varios tipos diferentes de canales y transportadores iónicos y su potencial objetivo con reactivos farmacológicos novedosos.
Problema
el Tema 4 2013
temas Relacionados
canales de Cloruro, Las Metas, los Canales Iónicos