Dr. Chittaranjan Das
El objetivo principal de nuestro laboratorio es comprender el papel funcional de las enzimas desubiquitinantes (deubiquitinasas o DUBs) en las vías celulares, particularmente las implicadas en la neurodegeneración (pérdida gradual de neuronas), como la enfermedad de Alzheimer (EA) y la enfermedad de Parkinson (EP). Una amplia variedad de procesos biológicos son controlados por la modificación reversible y postraduccional de proteínas mediante la unión covalente de ubiquitina, un polipéptido eucariótico de 76 residuos altamente conservado. La ubiquitinación se puede considerar como el evento inicial de una cascada de señalización (señalización de ubiquitina) que finalmente termina por la eliminación hidrolítica de la etiqueta de ubiquitina por un DUB. Un estudio del genoma humano revela la presencia de alrededor de 90 DUBs, lo que sugiere su participación en una amplia variedad de vías bioquímicas. Nuestro enfoque para estudiar DUBs se basa en la aplicación combinada de una serie de herramientas que incluyen la síntesis química de sondas de moléculas pequeñas, cristalografía de rayos X y proteómica basada en espectrometría de masas.
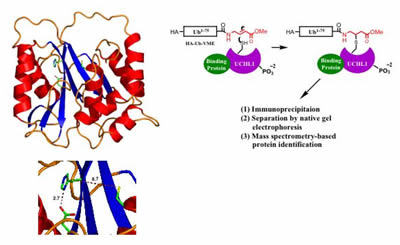
La estructura de UCHL1 determinada por cristalografía de rayos X sugiere que la enzima puede adoptar dos estados, un estado inactivo (en el que los residuos catalíticos están desalineados, se muestra a la izquierda) y un estado activo putativo, en el que los residuos se alinean por interacción de la proteína con cofactores desconocidos. Un método propuesto para la identificación de cofactores de UCHL1 a través de la purificación basada en la actividad a partir de extractos de células enteras (derecha).
Actualmente, estamos investigando la función normal de la ubiquitina C-terminal hidrolasa L1 neuronal DUB (UCHL1), una proteína neuronal específica asociada a la PD de función fisiológica desconocida. Nuestros esfuerzos en esta dirección están dirigidos a desarrollar inhibidores de moléculas pequeñas permeables a las células de UCHL1 que se puedan usar para investigar su función (tanto normal como asociada a la enfermedad), determinar sus socios de unión mediante purificación basada en afinidad a partir de extractos de células enteras, y definir la base molecular de cómo una variante natural de esta enzima, en la que el Ser en la posición 18 es sustituido por Tyr (llamado polimorfo S18Y), proporciona protección contra la enfermedad de Parkinson (EP). Además de UCHL1, también estamos llevando a cabo investigaciones estructurales y mecanicistas de otras enzimas relacionadas que se cree que participan en procesos bioquímicos fundamentales como la reparación del ADN, la modificación de histonas y la endocitosis de proteínas de membrana plasmática.
Educación
- Doctorado, Instituto Indio de Ciencias, 2001
- Becario Postdoctoral, Facultad de Medicina de Harvard y Universidad Brandeis, 2006
Reconocimientos
- Beca de Investigación Superior, Comisión de Becas Universitarias, India , 1996
Publicaciones
Lista de publicaciones