El compromiso del antígeno cognado en las células del parénquima estimula la proliferación de células T CD8 + in situ
- Las células T CD8 + cognadas se encuentran en LN y tejido inflamado
- Las células T CD8 + se expanden en el lugar de la inflamación
- La interacción de cognados con islotes promueve la expansión
- No se requiere interacción con leucocitos residentes
- La interacción de los cognados con las células del parénquima es importante
- Las células T proliferan en el sitio de la inflamación
- La interacción de cognados con células del parénquima impulsa la proliferación
- La IL-2 es más importante en el sitio de la inflamación
Las células T CD8 + cognadas se encuentran en LN y tejido inflamado
En experimentos iniciales (Fig. 1) se estableció un modelo en el que se podían analizar las respuestas de las células T CD8 a un antígeno parenquimatoso, la ovoalbúmina (óvulos). Los ratones OT-I expresan un TCR transgénico que media el reconocimiento de células T CD8 + del péptido OVA257-264 presentado en la molécula MHC clase I H-2Kb. Las células T CD8 se enriquecieron a partir de ratones OT-I / CD45.1, marcados con tinte CFSE y transferidos adoptivamente por vía intravenosa a ratones huésped B6 (CD45. 2+). Las células T transferidas adoptivamente se podían distinguir de las células huésped por tinción CD45. 1 (así como CD8 y la cadena Va2 del TCR OT-I), mientras que la dilución de colorante CFSE se utilizó para identificar las células que habían proliferado (por ejemplo, Fig. 1a, Suplemento Fig. 1). El antígeno parenquimatoso se introdujo mediante injerto B6.Islotes ßOVA (estos islotes expresan óvulos en células β del parénquima bajo el promotor de insulina de rata, Tabla suplementaria 1) debajo de la cápsula renal de ratones huéspedes que ya habían recibido células T OT-I/CD45.1. Las tres fuentes (huésped, donante de células T y donante de islotes) tienen un fondo B6 y, por lo tanto, expresan H-2Kb. Por lo tanto, aunque la expresión del antígeno de los óvulos se limitó a las células β injertadas,asumimos que la presentación de óvulos derivados de células β por APC no parenquimatoso, como DC, a través de presentación cruzada, sería necesaria para el cebado de LN y quizás para las respuestas de células T locales17, 18.

Células OT-I divididas (CD45, 1+CD8+Va2+ puerta viable) en LN renal drenante e injerto 3 o 6 días después de recibir un único injerto de 400 B6.Islotes ßOVA. a) Diagramas representativos de citometría de flujo. La posición del pico OT-I indiviso se determinó utilizando el control “sin antígeno” de un injerto de islotes B6. b) Número total de TO-I divididos en LN renal e injerto, donde cada punto representa un ratón individual. Datos agrupados de siete experimentos independientes: n = 8 receptores de injertos en el día 3 y n = 14 receptores de injertos en el día 6. Un día 6 se perdió el injerto debido a un mal funcionamiento del citómetro de flujo. Las barras horizontales son medias, los valores de P se calcularon mediante el test t de dos colas no emparejado con corrección de Welch.
Las células T CD8 + se expanden en el lugar de la inflamación
Como era de esperar, se detectó una respuesta OT-I potente primero en el LN renal que drena el lugar del injerto y esto dependía de la presencia de antígeno ovárico (Fig. 1a, b). A los 3 días después del injerto, se pudo detectar OT-I dividido en LN que drenaba el B6.Injertos de islotes ßOVA (Fig. 1a) y eran abundantes (Fig. 1b, media = 9,2 × 104). Por el contrario, se pudieron detectar 100 células OT-I divididas menos dentro de B6.Injertos ßOVA (Fig. 1a, b, media = 6,6 × 102). El número de células OT-I divididas aumentó 300 veces en el sitio del injerto del día 3 al día 6 (Fig. 1b, media = 6,6 × 102 en el día 3 a 2,1 × 105 en el día 6, P<0,0001, prueba t de dos colas no emparejada con corrección de Welch), mientras que no hubo aumento en el LN (Fig. 1b). La respuesta OT-I en B6.Los injertos de ßOVA podrían explicarse por la infiltración de células OT-I que habían proliferado en el LN. Sin embargo, los perfiles de CFSE fueron diferentes entre los sitios del injerto y del LN, ya que las células OT-I en los injertos estaban más divididas que las del LN en el día 6 (Fig. 1a). Hay al menos dos posibles explicaciones para esta diferencia. Solo células que se habían dividido muchas veces infiltraron el injerto. Alternativamente, las células que llegan al injerto se dividen más rápidamente, posiblemente debido a la abundancia de antígeno disponible. El aumento del número absoluto de células en el injerto en comparación con LN en el día 6 nos llevó a investigar esta última explicación.
La interacción de cognados con islotes promueve la expansión
Para determinar la posible contribución del CMH cognado en el injerto a la expansión local se utilizaron islotes derivados de bm1.Ratones ßOVA (Tabla Suplementaria 1). En bm1.Ratones ßOVA, la molécula H-2Kbm1 es incapaz de presentar el péptido OVA257–264 debido a tres mutaciones a H-2Kb (ref. 19). Una comparación de las respuestas a B6.ßOVA y bm1.Los injertos de islotes ßOVA mostraron que, a pesar de respuestas OT-I similares en el LN renal drenante, la expansión de OT-I se redujo seis veces en la bm1.ßOVA comparado con B6.Injertos ßOVA (media = 4.7 × 104 comparado con 2,6 × 105 OT-I dividido; P=0,0153 prueba en t de dos colas sin emparejar con corrección de Welch; Fig. 2a). Esta expansión menos eficiente de células OT-I infiltrando bm1.Los injertos ßOVA sugirieron que las interacciones afines con las células de los islotes injertados contribuyeron a la expansión local de las células T.

Análisis de citometría de flujo de células OT-I (CD45.1+CD8+Va2+ gate viable) 6 días después del injerto. a) OT-I total dividido en el LN renal drenante y el injerto tras recibir un único injerto de 400 B6.ßOVA o bm1.Islotes ßOVA. Datos para B6.Los ratones ßOVA injertados son un subconjunto de los que se muestran en la Fig. 1b. Cada punto representa un ratón individual. Los datos agrupados de dos experimentos independientes se muestran en cada panel: n = 5 destinatarios de B6.Injertos ßOVA, y n = 6 receptores de bm1.Injertos ßOVA. Las barras horizontales son medias, los valores de P se calcularon mediante el test t de dos colas no emparejado con corrección de Welch. b) Esquema del modelo de injerto bipolar en el que injertos de 200 islotes se colocan en polos opuestos del mismo riñón y comparten un LN renal de drenaje común. Total dividido OT-I en (c) B6.ßOVA y KbKO.Injertos bipolares ßOVA y (d) B6.Injertos bipolares ßOVA y B6 (n = 5 ratones receptores agrupados a partir de dos experimentos independientes en cada uno de los ratones c y d) Los datos para el mismo ratón están conectados por líneas discontinuas: los valores de P se calcularon mediante la prueba t de relación emparejada.
Para eliminar cualquier contribución por H-2Kbm1 aloantígenos hemos generado KbKO.Ratones ßOVA que expresan antígeno óvulo en células beta de islotes pero carecen de aloantígeno o H-2Kb (Tabla suplementaria 1). Luego utilizamos un “modelo de injerto bipolar” para comparar las respuestas a B6.ßOVA y KbKO.Injertos de islotes ßOVA colocados en polos opuestos del mismo riñón en un ratón huésped B6, de modo que las células T infiltrantes del injerto se derivaron de células T cebadas en el mismo LN (Fig. 2b). Había entre 10 y 100 veces más células T presentes en B6.ßOVA than KbKO.Injertos ßOVA (Fig. 2c). Utilizando la relación de OT-I dividido en polos opuestos del riñón calculada para ratones individuales, derivamos una Relación de Respuesta Relativa (RRR). El RRR indicó que la expansión local de las células T era 26 veces mayor cuando se producía el compromiso de los cognados con las células del injerto (RRR=26,4±14,1 en B6.ßOVA: KbKO.Injertos ßOVA, P = 0,0025, test t de relación pareada, Fig. 2c).
También comparamos las respuestas al bipolar B6.Injertos ßOVA y B6 (sin antígeno) (Fig. 2d). Muy pocos OT-I pudieron detectarse dentro de injertos B6 (Fig. 2d) y consideramos probable que muchos de ellos estuvieran circulando OT-I derivados de la contaminación de la sangre. Por lo tanto, la inflamación inespecífica asociada con el trasplante de injertos que carecen de antígeno no conduce a una expansión eficiente de las células T dentro del tejido inflamado. Por el contrario, la respuesta a B6.Los injertos ßOVA volvieron a ser muy potentes y más de 900 veces mayores que los injertos B6 (RRR=950±252 para B6.ßOVA: injertos B6, P< 0,0001, test t de relación pareada, Fig. 2d).
En conjunto, estos experimentos indicaron que la expansión de células T CD8 dentro del tejido diana inflamado se promovió significativamente por la presentación de antígenos locales. Esto no excluye necesariamente otras contribuciones a la expansión de células T, por ejemplo, mediante la presentación cruzada de DC del huésped en el injerto. Solo afirmamos que la interacción entre las células T y las células de los islotes da como resultado una expansión sustancial de las células T.
No se requiere interacción con leucocitos residentes
Los islotes son grupos complejos de células que incluyen células β, células endoteliales y leucocitos residentes de islotes (IRL). Por lo tanto, a continuación tratamos de aclarar qué células de los islotes presentaban antígeno a las células T infiltrantes para impulsar la expansión de las células T. El candidato más obvio sería IRL. Estas células CD45+ se han definido de diversas maneras como DC o macrófagos, coexpresan CD11c y F4/80, y se ha demostrado que procesan y presentan antígenos20,21,22,23. Por lo tanto, examinamos el papel de la IRL del donante en la expansión local de las células T CD8. B6.Ratones ßOVA fueron cruzados a CD11c. DTR.Ratones GFP para obtener CD11c.DTR.GFP.Ratones ßOVA cuyas células β expresan ÓVULOS y cuyas células CD11c + podrían ser abladas por inyección de toxina diftérica (DT) 8. Primero probamos por FACS que islotes aislados de CD11c. DTR.Los ratones GFP tratados con DT se agotaron de células CD11c+ (Fig. 3a, b). La IRL CD11c + en ratones control no tratados se identificó mediante tinción para CD45 y CD11c, así como su expresión del reportero GFP, y se agotaron claramente con el tratamiento DT (Fig. 3a, b, P=0,0002, prueba t de dos colas no emparejada con corrección de Welch). También confirmamos que el CD11c + IRL coexpresa F4 / 80 y H-2 Kb MHC clase I (Suplemento Fig. 2a) y, en consecuencia, las células F4/80+ también se agotaron de los islotes de ratones tratados con DT (Fig. 2b). CD11c.DTR.GFP.Los islotes ßOVA aislados de ratones no tratados y tratados con DT se injertaron en polos opuestos del mismo riñón. El número dividido de OT-I fue similar entre los injertos, lo que indica que la depleción de IRL no tuvo efecto en la expansión de las células T CD8+ en el sitio del injerto (Fig. 3c). Para confirmar que la IRL no era importante para la expansión local de células T CD8, realizamos un segundo conjunto de experimentos. KbKO.Los ratones ßOVA fueron irradiados y reconstituidos con médula ósea (BM) KbKO o B6 para generar una fuente de islotes ßOVA en los que la expresión de H-2Kb estaba ausente de todas las células o se restauró selectivamente a IRL (Fig. 3d). La comparación de estos islotes en el modelo de injerto bipolar mostró niveles similares de expansión de células OT-I en ambos injertos (Fig. 3e). Por lo tanto, las IRL no son los principales impulsores de la expansión local de células T CD8.

Análisis de citometría de flujo que muestra depleción de CD11c + IRL en CD11c. DTR.Ratones GFP tratados con DT: a) Parcelas representativas que muestren la apertura de la puerta de CD11c+IRL en islotes de ratones control no tratados y su agotamiento al día siguiente de un único tratamiento de DT, y b) el recuento de CD11c+IRL en ratones no tratados y tratados con DT. Cada punto representa una preparación individual de islotes que contiene islotes agrupados de 1 a 8 ratones, n = 5 preparaciones de islotes no tratadas y 6 preparaciones de islotes tratados con DT agrupadas a partir de cuatro experimentos independientes. Valor de P calculado mediante prueba t de dos colas sin emparejar con corrección de Welch. c) OT-I dividido total a los 6 días del injerto bipolar de islotes obtenidos de CD11c. DTR.GFP.Ratones ßOVA que no fueron tratados o tratados con DT (n = 6 ratones receptores agrupados de dos experimentos independientes). Los datos para el mismo ratón están conectados por líneas discontinuas; los valores de P se calculan mediante la prueba t de relación emparejada. d) Gráficos representativos que muestren ausencia o presencia de expresión de H-2Kb en CD11c+IRL de ratones KbKO reconstituidos con KbKO o B6 BM, respectivamente. Pregonada en células viables. e) OT-I total dividido a los 6 días del injerto bipolar de islotes obtenidos de ratones quiméricos (n=3 ratones receptores de un solo experimento). Los datos del mismo ratón están conectados por líneas discontinuas; Valores de P calculados por la prueba t de relación emparejada.
La interacción de los cognados con las células del parénquima es importante
B6.Ratones RIP-Kb expresan de forma transgenérica H-2Kb en células β bajo el control del promotor de insulina de rata24. Cruzando estos ratones a KbKO.Ratones ßOVA que generamos KbKO.ßOVA.Ratones ßKb en los que la expresión de H-2Kb se limitó a las células β (Tabla suplementaria 1). La expresión de H-2Kb en las células β se confirmó mediante el análisis FACS de islotes (Fig. 4a). Controlamos las células hematopoyéticas de los islotes (CD45+) y las células endoteliales (CD31+) y mostramos que H-2Kb no se expresaba en estas células ni en KbKO.ßOVA o KbKO.ßOVA.Ratones ßKb comparados con una expresión fuerte en ratones B6 (Fig. 4a). Las células CD45−CD31 restantes son autofluorescentes positivas y enriquecidas en células endocrinas. Análisis FACS de islotes de KbKO.ßOVA.Los ratones ßKb mostraron una expresión de H-2Kb dentro de la población autofluorescente enriquecida con células β en niveles similares a los observados en los islotes B6 (Fig. 4a). La comparación en el modelo de injerto bipolar indicó que la expansión de OT-I era 14 veces mayor cuando se expresaba antígeno cognado en células β (RRR=14,0±4,1 para KbKO.ßOVA.ßKb: KbKO.Injertos ßOVA, P = 0,0008, test t de relación pareada, Fig. 4b).

(a) Diagramas de citometría de flujo (células viables cerradas) que muestran la restauración selectiva de la expresión de H-2Kb en las células del parénquima. Los histogramas representan islotes de KbKO (sombreado), B6 (discontinuado) o KbKO.Ratones ßKb (negrita). b) OT-I dividido total a los 6 días después del injerto bipolar de KbKO.ßOVA y KbKO. ßOVA.ßKb. islotes (n = 6 ratones receptores agrupados de tres experimentos independientes). Los datos para el mismo ratón están conectados por líneas discontinuas; los valores de P se calculan mediante la prueba t de relación emparejada.
Las células T proliferan en el sitio de la inflamación
Nuestros hallazgos anteriores indican que hubo proliferación local en el sitio objetivo. Para detectar células en proliferación activa, cruzamos ratones OT-I / CD45.1 a ratones FucciRG para generar FucciRG/OT-I/CD45.1 ratones (abreviado Fuciot-I). En estos ratones, las células fluorescen rojas (FucciR) durante las fases del ciclo celular G0/G1 y verdes (FucciG) durante las fases del ciclo celular S/G2/M25,26. La degradación y acumulación gradual de FucciR y reporteros FucciG durante la transición entre las fases del ciclo permite hacer distinciones adicionales: expresión más intensa de FucciR en células G1 quiescentes versus células G1 cíclicas, células FucciR−G− doble negativas en G1 muy temprano y células FucciR+G+ débilmente positivas en G1/S (refs 26, 27). Las células Fuciot-I quiescentes de ratones no injertados eran FUCIG – (Fig. 5a, panel superior, sin injerto). Para evitar interferencias con los tintes Fucci sustituimos CFSE por CTV. En ratones que habían recibido B6.Injertos de ßOVA, el análisis de la dilución de la TVC indicó que el fuciot-I dividido estaba presente en el LN renal drenante y algunos de estos eran FUCIG + sugestivos de división celular activa (Fig. 5a, panel superior, drenaje LN). En el sitio del injerto, detectamos Fuciot-I que había sufrido muchas divisiones (CTV ya no detectable) y muchas de ellas eran FUCIG+ que apoyaban la proliferación en curso (Fig. 5a, panel superior, injerto fresco). Comparación de la proporción de células FUCIG + dentro de la población dividida de OT-I (Fig. 5c) indicó que la proliferación en curso dentro de injertos frescos (26,8±8,8% FUCIG+) excedía la de la LN renal drenante (7,3±1,6%, P=0,008, prueba t de dos colas no apareada con corrección de Welch) o la LN renal no drenante (2,1±2,1%, P=0,003, prueba t de dos colas no apareada con corrección de Welch). De hecho, el examen de la expresión tanto del FucciG como del FucciR indicó que la mayoría de los OT-I infiltrantes del injerto se dividían activamente, es decir, muy pocas células exhibían una alta expresión de FucciR que era una característica de las células quiescentes en el LN de ratones no injertados (Fig. 5a, paneles inferiores). Aunque supusimos que esta proliferación en el sitio de la inflamación se generó in situ, no podíamos descartar por completo la posibilidad de que esto simplemente reflejara la llegada reciente de células en proliferación. Para aclarar esto, recolectamos los injertos bipolares de B6.Islotes ßOVA para analizar un injerto inmediatamente después de la escisión y cultivar el otro injerto durante 1 día (Fig. 5a). Mientras que el número de OT-I no aumentó durante el período de cultivo (Fig. 5b), presumiblemente reflejando la muerte celular en condiciones ex vivo subóptimas, muchas células FUCIG+ OT-I continuaron detectándose (14,2±4,2% FUCIG+, Fig. 5c). El perfil del injerto cultivado, sin posible reclutamiento durante un día, indicaría que había una alta proliferación de novo en el injerto.

(a) Diagramas esquemáticos y representativos de citometría de flujo (linfocitos CD45, 1+CD8+Va2+ activados en forma controlada) que muestran la respuesta de las células Fuciot-I en LNs renales o bipolares B6.Injertos ßOVA. El LNs y el injerto de un polo se examinaron inmediatamente (fresco a los 6 días después del injerto), mientras que el injerto del polo opuesto se cultivó durante 1 día antes del análisis. Se incluyó LN de un ratón no injertado para mostrar ausencia de división y expresión de FucciG (panel superior) y predominio de células altas de FucciR (panel inferior) en FucciOT-I quiescente. (b) FucciOT-I dividido total en injertos frescos y cultivados. Media+d. s., n = 5, valores de P calculados mediante la prueba t emparejada de relación de dos colas. c) % FUCIG + OT-I dividido en LN renal fresco no drenante e injerto drenante, así como injertos frescos y cultivados. Media+s. d., n = 5 con excepción de LN no drenante para el cual n=4 debido a la pérdida de un LN durante el procesamiento. Los valores de P se calcularon mediante el test t no pareado de dos colas con corrección de Welch. Los datos se agrupan a partir de dos experimentos independientes.
La interacción de cognados con células del parénquima impulsa la proliferación
A continuación, aprovechamos el modelo Fuciot-I para evaluar el papel de otro posible impulsor local de la proliferación de células T en el injerto, el APC derivado del huésped, como la DC inflamatoria. Para eliminar cualquier contribución de APC anfitrión, primero derivamos un fondo KbKO. Como los ratones KbKO rechazaban las células OT-I, creamos Kbko BM en quimeras B6 para usarlas como huéspedes; por lo tanto, las células hematopoyéticas carecían de H-2Kb, pero eran permisivas de las células OT-I. A estas quimeras se les administraron células T Fuciot-I e injertos bipolares de KbKO.Islotes ßOVA (que carecen de expresión de H-2Kb y, por lo tanto, de la capacidad de presentar antígeno ovárico) y KbKO.ßOVA.Islotes ßKb (tanto el antígeno H-2Kb como el antígeno ovárico se limitaron a las células β). Como la quimera carecía de APC positivo a H-2Kb, fue necesario administrar células de bazo recubiertas de péptidos OVA257-264 para iniciar la respuesta OT-I. El éxito de este cebado se demostró por la dilución de CTV en células FUCIOT-I en el LN renal, aunque en el momento de la cosecha eran FUCIG-y no parecían dividirse activamente (0,1±0,0% FUCIG+, Fig. 6 bis, d). Muy pocos OT-I se infiltraron en el KbKO.Injertos de ßOVA, pero se expandieron claramente dentro de KbKO.ßOVA.Injertos ßKb (RRR de 61,4±26,6 para KbKO.ßOVA.ßKb: KbKO.ßOVA, Fig. 6b, P=0,0008, prueba t emparejada de relación de dos colas). Por lo tanto, incluso en ausencia de antígeno cognado en el APC del huésped, el antígeno cognado en las células β del parénquima fue suficiente para impulsar la expansión de las células T CD8 en el sitio del injerto. Las pocas células T Fuciot-I presentes en KbKO.Los injertos ßOVA se parecían a los del LN en términos de su progresión ineficiente a la fracción altamente dividida (Fig. 6a, c, 7,5±0,9% altamente dividido en LN y 19,3±3,3% altamente dividido en KbKO.Injertos ßOVA) y falta de expresión FucciG (Fig. 6a, d, 0,1±0,0% en LN y 0,1±0,1% en KbKO.Injertos ßOVA) sugiriendo que se produjo poca proliferación de OT-I en el sitio del injerto en ausencia de antígeno afín. Por el contrario, el OT-I dentro de KbKO.ßOVA.Los injertos de ßKb fueron predominantemente altamente divididos (92,3±1,0%, Fig. 6a, c) y algunos de ellos eran FucciG+ y, por lo tanto, proliferaban activamente (Fig. 6a, d, 5,0±1,2% de FUCIG+). Por lo tanto, la presentación de antígenos afines por las células β del parénquima de los islotes fue capaz de impulsar la proliferación de novo de Fuciot-I in situ.

Respuesta de Fuciot-I a injertos en KbKO BM en ratones huésped B6 en los que las células hematopoyéticas del huésped carecen de expresión de H-2Kb. Los ratones injertados recibieron células de bazo recubiertas de péptidos el día del injerto para iniciar el cebado OT-I. a) Parcelas representativas de citometría de flujo (linfocitos CD45, 1+CD8+Va2+ activados en linfocitos viables). El panel superior muestra falta de división y expresión FucciG en OT-I inactivo en LN de un ratón que no fue injertado ni cebado. Los tres paneles inferiores muestran respuestas en un ratón bipolar injerto y cebado: drenaje renal LN, KbKO.ßOVA y KbKO.ßOVA.Injertos ßKb. Las células divididas en ratones injertados se dividieron en dos sectores, con las células altamente divididas cayendo en el sector en el que la CTV se diluyó más allá del límite de detección. b) Fuciot-I total dividido en KbKO.ßOVA y KbKO.ßOVA.Injertos bipolares ßKb, valores de P calculados por prueba t emparejada de relación de dos colas. (c) % altamente dividido y (d) % FUCIG+ OT-I en LN renal drenante e injertos de ratones bipolares injertados. Los valores de P se calcularon mediante la prueba t pareada de dos colas. Los resultados para ratones individuales están conectados por líneas discontinuas, n = 6 ratones receptores agrupados de dos experimentos independientes.
La IL-2 es más importante en el sitio de la inflamación
Mostramos que la expresión de IL-2Ra fue más importante para la proliferación y acumulación de células T CD8+ dentro del parénquima periférico (injertos de islotes) en comparación con el sitio de cebado en LN drenante (Fig. 7a). Además, analizamos la respuesta en un segundo sitio distante del sitio de cebado, es decir, LN no drenante. Las células T CD8 + marcadas con CTV de ratones OT-I. IL-2RaKO (IL-2ra−CD45.2+) y OT-I/Ly5.1 (IL-2ra+, CD45.1+CD45.2+) se transfirieron conjuntamente a ratones huésped B6.CD45.1 (CD45.1+) antes de recibir un solo injerto de B6.Islotes ßOVA. Las distintas firmas alélicas CD45 de cada una de las poblaciones de células T transferidas (en combinación con tinción para CD8 y Va2) nos permitieron cuantificar y comparar la proporción de PESO dividido:IL-2RaKO OT-I (Fig. 7a, Suplemento Fig. 3). IL-2ra WT superó claramente a IL-2ra KO OT-I en el sitio del injerto en comparación con el LN drenante (P=0,025, prueba t emparejada de dos colas) o no drenante (P=0,044, prueba t emparejada de dos colas). Esto es consistente con una mayor dependencia de las células T CD8+ de la IL-2 en el momento del encuentro secundario con el antígeno en el sitio de la inflamación en comparación con durante el cebado inicial en el LN drenante.
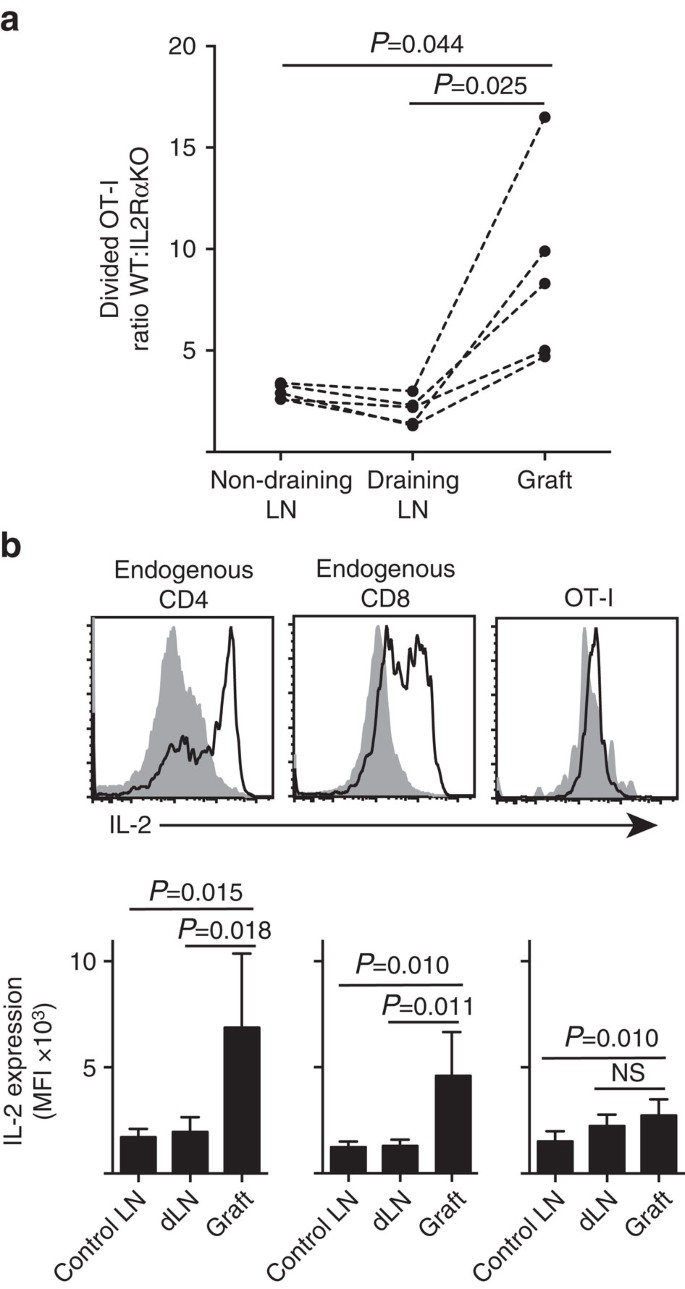
(a) Relación de células de IL-2Ra WT divididas:IL-2ra KO OT-I recuperadas de B6.Injerto de islote ßOVA, LN renal drenante y LN inguinal no drenante después de la transferencia conjunta (106 de cada uno) a ratones huéspedes B6.CD45.1. Las proporciones se calcularon para órganos individuales con resultados para ratones individuales conectados por líneas discontinuas y se compararon mediante la prueba t emparejada de dos colas. Se muestran resultados para n = 5 ratones receptores y representativos de tres experimentos independientes. b) Expresión de IL-2 en células CD4+ y CD8+ endógenas y células OT-I transferidas en receptores B6 de B6.Injertos de islotes ßOVA. Los paneles superiores muestran gráficos representativos de citometría de flujo para el drenaje del injerto LN renal (gris sólido) y el injerto (línea negra). Los paneles inferiores resumen la intensidad fluorescente media (IMF) de la expresión de IL-2 para LN renales tomadas de ratones no injertados (LN de control), así como LN renal de injerto y drenaje (dLN) de ratones injertados. Los resultados se muestran como media+d. s., n = 6 agrupados a partir de dos experimentos independientes y comparados por la prueba t no apareada de dos colas con la corrección de Welch.
La mayor dependencia de IL-2 para la proliferación de células T CD8+ en el sitio de la inflamación inferió un requisito para la producción local de IL-2. Por lo tanto, examinamos el potencial de varias células T (CD4+ y CD8+ derivados del huésped endógeno, así como células T CD8+ OT-I transferidas) para la capacidad de producir IL-2 (Fig. 7b). Las suspensiones celulares preparadas a partir de injertos o LN se reestimularon brevemente (4 h) con PMA e ionomicina antes de la tinción para la expresión de IL-2 intracelular. El examen de las células T CD4+ y CD8+ derivadas del huésped endógeno proporcionó pruebas convincentes de la producción de IL-2 en el lugar de la inflamación del injerto, con un claro aumento de la IMF de la tinción de IL-2 en comparación con la LN drenante o no drenante. Los niveles de IL-2 en las células T CD8+ de OT-I en el sitio de la inflamación aumentaron moderadamente con respecto a los del LN no drenante, pero no difirieron significativamente de los del LN drenante. Una interpretación de estos datos es que la interacción cognada de OT-I con células parenquimatosas induce una proliferación rápida pero una producción pobre de IL-2, de modo que los OT-I dependen de la IL-2 paracrina derivada de células T CD4+ y CD8+ endógenas en el entorno local del injerto. Sin embargo, un experimento adicional indicó que la IL-2 exógena en ausencia de antígeno parenquimatoso no podía impulsar la expansión de las células CD8+ de OT-I. Se administró IL-2 (HIL-2 recombinante, 25.000 UI) por vía intraperitoneal a ratones B6 que recibieron injertos bipolares de B6.Islotes ßOVA y B6. La comparación de la recuperación de OT-I en órganos recuperados de ratones tratados con IL-2 o vehículo en el día 6 después del injerto no mostró un aumento significativo en la acumulación de células OT-I divididas en dos sitios que carecen de antígeno parenquimatoso, a saber, injertos de islotes B6 (3±3 en los tratados con vehículo en comparación con 49±64 en los ratones tratados con IL-2, P=0.342) y LN inguinal no drenante (1.648+633 en el vehículo tratado en comparación con 1.660+1.023 en ratones tratados con IL-2, P=0,987, media±d. s., n=3, prueba t no apareada de dos colas con corrección de Welch).