Fronteras en Neurología
- Introducción
- Métodos
- Sujetos
- Estudios de Conducción nerviosa
- Ultrasonido
- Estadística
- Resultados
- Características clínicas
- Área de Sección Transversal (ASC)
- Correlación de maxCSA y el Puntaje de Suma del Consejo de Investigación Médica (MRC)
- Correlación de CSA y CB
- Discusión
- Limitaciones
- Declaración de disponibilidad de datos
- Declaración de ética
- Contribuciones de los autores
- Conflicto de intereses
- Agradecimientos
- Material suplementario
- Abreviaturas
Introducción
La neuropatía motora multifocal (MMN) se describió por primera vez en 1988 (1) como una neuropatía puramente motora que afecta a múltiples nervios motores con bloqueo de conducción (CB). El CB motor es el sello electrofisiológico central para el diagnóstico de MMN. La ecografía nerviosa puede suministrar las características morfológicas de los nervios periféricos. El agrandamiento multifocal de nervios periféricos o raíces cervicales en áreas nerviosas de sección transversal (ASC) se ha reportado en MMN (2-4). Kerasnoudis et al. (5) reportaron una correlación entre los potenciales de acción motora compuestos (CMAP) y los ASC del nervio mediano en la parte superior del brazo (r = 0,851, p < 0,001). Beekman et al. (6) encontraron que los estudios ecográficos mostraron un aumento de la CSA nerviosa compatible con anomalías de conducción más de lo esperado por motivos puramente clínicos. Además, algunos sitios exhibieron agrandamiento de los nervios sin CB. Los CBS multifocales se distribuyeron a lo largo del nervio en MMN; sin embargo, esos estudios solo midieron unos pocos sitios predeterminados, lo que proporcionó información morfológica limitada. En este estudio, el uso de la exploración consecutiva a lo largo del nervio y la medición de la ASC en múltiples sitios con base en ultrasonido permitió una correlación más precisa entre el bloqueo de conducción y el aumento de la ASC en la NMM.
Métodos
Sujetos
Entre diciembre de 2014 y mayo de 2018, se reclutaron consecutivamente 12 pacientes de MMN del Hospital de la Universidad Médica de la Unión de Pekín de acuerdo con los criterios propuestos por la AANEM (7). Se inscribieron como controles el mismo número de controles sanos (HC), emparejados por edad (±1 año). Todos los pacientes y controles sanos se sometieron a un examen clínico estandarizado que incluyó pruebas de fuerza muscular de muñeca, flexión de pulgar y dedo, opponens pollicis, abductor pollicis brevis, extensión de dedo y aductor pollicis, junto con pruebas sensoriales. Los exámenes clínicos, el electromiograma y los estudios de ultrasonido de nervios se realizaron el mismo día. El comité de ética del Peking Union Medical College Hospital aprobó nuestro protocolo de estudio, y todos los pacientes firmaron un formulario de consentimiento informado de acuerdo con la Declaración de Helsinki.
Estudios de Conducción nerviosa
Se realizaron estudios de conducción nerviosa motora (NCSs) en todos los sujetos de los nervios cubital y mediano bilaterales con estimulación nerviosa supramáxima percutánea mientras se registraban los CMAP con electrodos de disco de 10 mm. Los segmentos estándar se definieron como muñeca a codo y codo a axila para el nervio mediano, y muñeca a debajo del codo y codo superior a axila para el nervio cubital. Se realizó una técnica de avance lento (estimulación a lo largo del curso del nervio en incrementos de 2 cm) en algunos segmentos estándar con un bloqueo de conducción parcial, detectando el sitio exacto de CB, junto con una prueba de ultrasonido consecutiva en el mismo segmento. El diagnóstico de CB de segmentos estándar y la técnica de avance lento se realizaron de acuerdo con los criterios sugeridos por la AANEM (7). Para incluir solo el bloqueo de conducción verdadero, la CMAP distal tenía que ser de 1 mV. Se mantuvo la temperatura ambiente para garantizar que la temperatura de la piel se mantuviera en > 31°C. Los técnicos no pudieron ver la información del paciente.
Ultrasonido
Las pruebas de ultrasonografía se realizaron mediante trazado de nervios desde la muñeca hasta la axila en los nervios mediano y cubital bilaterales con un transductor de matriz lineal de 10 MHz (GE LOGIQ e, EE.UU.). Con el fin de eliminar el aumento artificial del tamaño de los nervios, no se permitió el uso de aumentos de zoom para estas mediciones. Los ajustes iniciales se mantuvieron constantes durante todos los exámenes, incluidas las profundidades. El transductor se mantuvo perpendicular al nervio en un ángulo seleccionado para obtener la imagen más pequeña y brillante. Los ASC en los sitios predeterminados de cada nervio se midieron trazando justo dentro del borde hiperecoico del nervio. Se midieron diez sitios predeterminados en cada nervio de acuerdo con un informe previo de nuestro laboratorio (8). Para el nervio mediano, los 10 sitios incluyeron la salida del túnel carpiano (M1), el punto medio del pliegue de la muñeca (M2), la entrada del túnel carpiano (M3), 4 cm proximales al pliegue de la muñeca (M4), el centro entre el pliegue de la muñeca y el codo (M5), la entrada en el pronador teres (M6), el codo (M7), 4 cm por encima del codo (M8), 8 cm por encima del codo (M9) y la axila (M10). Para el nervio cubital, los 10 sitios incluyeron la muñeca (U1), 4 cm proximal a la muñeca (U2), el punto de partida de la arteria cubital (U3), junto al vientre muscular del flexor carpi ulnaris (U4), la salida del túnel cubital (U5), dentro del túnel cubital (U6), la entrada del túnel cubital (U7), 4 cm proximal a la entrada del túnel cubital (U8), 8 cm proximal a la entrada del túnel cubital (U8), U9), y la axila (U10). A excepción de los lugares antes mencionados, también se realizaron mediciones en cualquier otro lugar de ampliación. El agrandamiento de la ASC se hizo referencia a los valores normativos de nuestro laboratorio (en el nervio mediano, los segmentos antebrazo-codo fueron ≤ 10 mm2 y los segmentos codo-axila ≤ 9 mm2; en el nervio cubital, los segmentos antebrazo y brazo fueron ≤ 6 mm2). Después de la medición de la ASC, el nervio se rastreó de nuevo de forma continua y se registró a fondo. Se excluyeron del estudio las neuropatías compresivas comunes que producían agrandamiento de los nervios. Los ultrasonógrafos no tenían acceso a la información del paciente.
Estadística
Los ASC de MMN mostraron una distribución no normal. Se utilizó la prueba U de Mann-Whitney para comparar MMN y controles sanos, y la diferencia de CSA máximos entre segmentos con CB y aquellos sin CB. La ASC máxima se definió como la ASC máxima en todo el segmento estándar. Para todas las pruebas, se consideró estadísticamente significativo un valor de P bilateral < 0,05.
Resultados
Características clínicas
En este estudio se incluyeron ocho hombres y 4 mujeres con una edad media de 43,7 años (rango 21-62, DE 13,2), 12 controles sanos (edad media 43,6, rango 28-57, DE 13,3, 8 hombres). La duración media de la enfermedad fue de 65 años.3 (24 a 108) meses. La altura media fue de 168 (155-186) cm y el peso medio de 65,4 (56,5–88) kg. Todos los pacientes no habían recibido tratamiento previo.
Área de Sección Transversal (ASC)
Los valores de ASC para los nervios mediano y cubital en MMN y HC en los 10 sitios se muestran en la Tabla 1 y en la Figura 1. Las ampliaciones de la CSA fueron multifocales en comparación con los controles sanos. En los nervios medianos, los valores más altos de ASC se distribuyeron principalmente en el segmento del antebrazo y el segmento superior del brazo. Los sitios debajo del codo y el segmento superior del brazo de los nervios cubitales mostraron un agrandamiento de la CSA más obvio. Curiosamente, los sitios comunes de compresión nerviosa, como el canal carpiano y el túnel cubital, no revelaron un aumento prevalente de la ASC en los pacientes con NMM en comparación con los controles sanos.

Cuadro 1 CSA en diferentes sitios de los nervios mediano y cubital en MMN y HC.

Figura 1. Distribución de 10 sitios de ASC en los nervios mediano y cubital. Se estableció la línea de 10 mm2 para distinguir las anomalías significativas de los sitios de la ASC de los otros segmentos. A) Para el nervio mediano: M1-la salida del canal carpiano, M2-el punto medio del pliegue de la muñeca, M3-la entrada del canal carpiano, M4-4 cm proximal al pliegue de la muñeca, M5-el punto medio entre el pliegue de la muñeca y el codo, M6-la entrada en el pronador redondo, M7-el codo, M8-4 cm por encima del codo, M9-8 cm por encima del codo, M10-la axila. B) Para el nervio cubital: U1-la muñeca, U2-4 cm por encima de la muñeca, U3-punto de salida de la arteria cubital, U4-junto al vientre muscular del flexor carpi ulnaris, U5-la salida del túnel cubital, U6-dentro del túnel cubital, U7-la entrada del túnel cubital, U8-4 cm proximal a la entrada del túnel cubital, U9-8 cm proximal a la entrada del túnel cubital, U10-axila. ASC: área de la sección transversal; MMN: neuropatía motora multifocal.
Correlación de maxCSA y el Puntaje de Suma del Consejo de Investigación Médica (MRC)
En los 12 pacientes con MMN, en total se incluyeron 23 nervios medianos y 23 nervios cubitales porque uno de los pacientes con MMN fue amputado por lesión laboral. La tendencia entre el CSA máximo del nervio de un nervio y la fuerza muscular correspondiente se divide en los dos tipos siguientes (Figura 2): (1) CSA aumentada y MRC disminuida. (2) El CSA aumentó y el MRC no mostró ningún cambio evidente.FIGURA
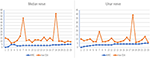
Gráfico 2 La correlación entre maxCSA nerviosa y MRC. Tendencia entre el área de la sección transversal máxima del nervio (ASC) de un nervio y la fuerza muscular correspondiente. La abscisa indica 23 nervios bilaterales en 12 pacientes, uno de los cuales no pudo registrar el nervio lateral debido a una amputación; la ordenada representa el área de la sección transversal del nervio (mm2) o la fuerza muscular. MRC: Puntuación de la Suma del Consejo de Investigación Médica; maxCSA: área transversal máxima de un nervio determinado.
Correlación de CSA y CB
Con NCSs motor, se detectaron 12 áreas CB definidas y 12 áreas CB probables en segmentos estándar de nervios cubital y mediana. Con estudios de ultrasonido, se detectó un aumento de la CSA en 36 sitios, eliminando segmentos susceptibles a la presión. En el nervio mediano, la mediana (P25, P75) de la máxima de CSA de un segmento estándar fue de 10,3 (8-12) mm2 para aquellos sin CB y 21.22 (8.5,38) mm2 para aquellos con CB (Z = 1.409, P = 0.159). En el nervio cubital, la mediana (P25, P75) de la ASC máxima de un segmento nervioso estándar fue de 7,7 (5.8,7) mm2 para aquellos sin CB y 6,25 (5,8, 25) mm2 para aquellos con CB (Z = 0,744, P = 0,457).
Hubo 9 segmentos estándar con CB y CSA aumentada (Figura 3, Video 1), 15 segmentos con CB pero CSA normal (Figura 4, Video 2) y 27 segmentos con CSA aumentada pero sin CB (Figura 5, Video 3). La técnica de avance lento y la exploración consecutiva con ultrasonido se realizaron en cinco segmentos, de los cuales los bloqueos de conducción apenas se confirmaron mediante la detección de segmentos estándar con un bloqueo de conducción parcial. Al combinar técnicas de avance lento y ultrasonido, otros dos segmentos más mostraron CBs y CSA aumentada en los mismos sitios, y 3 segmentos mostraron CBs pero CSA normal en los mismos sitios.FIGURA
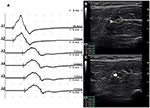
Gráfico 3 Modo 1. Hombre de 28 años con 4 años de debilidad asimétrica progresiva de las manos bilaterales. El examen reveló músculos inervados del nervio cubital de la mano (grado MRC derecho 3, izquierdo 4). Una técnica de avance lento utilizada en el segmento del antebrazo izquierdo del nervio cubital mostró bloqueo de la conducción y agrandamiento de la CSA en el mismo sitio en un paciente con NMM. A) Se detectó bloqueo de conducción entre A1 (latencia 4,9 ms, duración 8,2 ms, amplitud 14,8 mv, área 38,2 mvms, velocidad de conducción 66,6 m/s) y A2 (latencia 5,2 ms, duración 8,2 ms, amplitud 9,5 mv, área 26,1 mvms, velocidad de conducción 11,6 m/s). B) La punta de flecha blanca mostraba que el CSA de A1 era de 8 mm2. C) La flecha muestra que el CSA de A2 era de 19 mm2 (A1, codo-6 cm; A2, codo-4 cm; A3, codo-2 cm) (Vídeo 1). CSA: área de la sección transversal; CB: bloqueo de conducción; l, izquierda; r, derecha.FIGURA
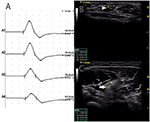
Gráfico 4 Modo 2. Mujer de 46 años con 11 años de debilidad asimétrica progresiva de los miembros superiores bilaterales, con grado 3 de CRM del miembro superior derecho y 4 izquierdo, presentó bloqueo de conducción y ASC normal en el mismo sitio. A) Se detectaron bloqueos de conducción entre A1 y A2. B) La punta de flecha blanca mostraba 6 mm2 en A1 (Latencia 2,8 ms, duración 3,8 ms, amplitud 12,4 mv, área 13,3 mvms, velocidad de conducción 50,9 m/s) y C) La flecha mostraba 8 mm2 en A2 (Latencia 6,8 ms, duración 3,9 ms, amplitud 8,2 mv, área 7,7 mvms, velocidad de conducción 63 m/s) (A1, muñeca; A2, codo) (Vídeo 2). ASC, área de la sección transversal; CB, bloqueo de conducción; l, izquierda; r, derecha.FIGURA
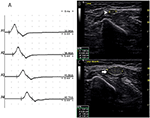
Gráfico 5 Modo 3. Una mujer de 51 años con 4 años de debilidad en el miembro superior izquierdo y grado 4 de CRM mostró aumento de la CSA sin bloqueo de conducción correspondiente. A) Estudio estándar de la conducción del nervio motor del segmento del nervio cubital izquierdo. No se detectó CB. El estudio de ecografía nerviosa a través del brazo superior izquierdo del nervio cubital mostró: (B) CSA (punta de flecha blanca) que fue de 8 mm2 en el sitio de A3 (latencia 8,7 ms, duración 8,0 ms, amplitud 8,2 mv, área 19,2 mvms, velocidad de conducción 48.6 m/s) y (C) ASC (flecha) del sitio 6 cm proximal al codo del cubital izquierdo que era de 39 mm2 (latencia 12,0 ms, duración 7,9 ms, amplitud 8,4 mv, área 19,5 mvms, velocidad de conducción 18,2 m / s), pero no se detectó CB en el mismo segmento (A1, muñeca; A2, por debajo del codo; A3, por encima del codo; A4, axila) (Vídeo 3). CSA: área de la sección transversal; CB: bloqueo de conducción; l, izquierda; r, derecha.
Discusión
Los estudios electrofisiológicos reflejan las características fisiológicas de un nervio, y los estudios de ultrasonido revelan las características morfológicas de un nervio. MMN es uno de los modelos ideales para explorar la correlación entre CB motor y CSA, para la que solo está involucrado el nervio motor, y CB es la principal característica electrofisiológica. Aunque en estudios previos se ha informado de una correlación entre la CB y la ASC (5, 6, 9), se observaron sitios limitados sin exploración continua de nervios bajo ecografía, y las lesiones en MMN se distribuyeron estocásticamente y no siempre en sitios predeterminados.
En este estudio, realizamos una exploración consecutiva a lo largo de todo el nervio para registrar la ASC en sitios anormales. Además, se midieron ASC en 10 sitios predeterminados. La técnica de avance lento se realizó si era necesario. Aunque la duración de la enfermedad en este grupo de pacientes con MMN eran largas y variadas, que pueden haber afectado a la ecografía y características electrofisiológicas, que todavía se encuentran tres modos de relaciones entre CSA y CB: CB, con la correspondiente nervio CSA ampliación (Modo 1), CB sin el correspondiente nervio CSA ampliación (Modo 2), y el nervio CSA ampliación sin el correspondiente CB (Modo 3). En consecuencia, la CB no siempre se correlaciona con el aumento de la CSA.
El mecanismo potencial de estos diferentes patrones de correlación entre CB y CSA aún no está claro. Además, las verdaderas manifestaciones patológicas correspondientes detrás del agrandamiento de los nervios no se han revelado claramente. El agrandamiento hipoecoico del nervio puede reflejar inflamación activa y bulbos de cebolla, mientras que el agrandamiento del nervio con fascículos hiperecogénicos adicionales / tejido perifascicular puede reflejar degeneración axonal (10). Es decir, tanto las lesiones axonales como las de la vaina de mielina podrían provocar un agrandamiento de la CSA nerviosa (11). Con respecto al modo 2, el CB sin la ampliación del CSA correspondiente puede entenderse fácilmente. En la actualidad, la MMN se considera una neuropatía motora inmunomediada, que está relacionada con el daño de anticuerpos anti-GM1 a los canales Na+activados por voltaje en el nodo de Ranvier (12, 13). Teóricamente, los anticuerpos anti-GM1 desencadenan daños directos y dependientes del complemento en los axones, lo que conduce al bloqueo de la conducción, mientras que puede que no haya cambios obvios de mielina. Taylor et al. se planteó la hipótesis de que el ataque de anticuerpos podría estar dirigido a los componentes de la mielina paranodal y se encontró que la alteración patológica axonal MMN predominaba sobre la patología de la mielina (14). Además, nuestros hallazgos relacionados con la ASC y el CB normales en la NMM podrían ser consecuencia del hecho de que solo los fascículos individuales están agrandados, mientras que la ASC del nervio principal no se ve afectada (15).
Con respecto al modo 1 (CB con aumento de la ASC), se ha notificado un aumento de la ASC en MMN en estudios de resonancia magnética (RM) (16) y otros estudios de ecografía (3). Nuestro hallazgo de que los pacientes con NMM tenían un agrandamiento del CSA del nervio multifocal y un bloqueo de conducción en el mismo sitio a lo largo del nervio puede implicar que en el sitio del CB, no solo había canales Na+dañados por voltaje, sino también algunas lesiones, como desmielinización, edema y formación de bulbo de cebolla (6, 17). Este modo indicó que la CB podría ser causada por diferentes mecanismos, y la NMM podría ser un síndrome. No todos los casos de MMN son causados por anticuerpos IgM anti-GM1, y otros procesos de inmunización también pueden estar involucrados, lo que resulta en procesos de desmielinización/remielinización y degeneración axonal/regeneración.
Es necesario seguir explorando el mecanismo del Modo 3. El agrandamiento de la ASC nerviosa sin CB en MMN, o incluso extremidades sin disfunción neurofisiológica, también se encontró en otros informes (6, 9, 18). Planteamos la hipótesis de que cuando se producen infiltrados inflamatorios, edema y disfunción de canales en los ganglios de Ranvier en una etapa temprana, el umbral de despolarización de los canales iónicos podría permanecer en un rango normal, de modo que la disfunción de la transmisión del estímulo salitatorio aún no se ha alcanzado y no se puede detectar CB. En los pacientes con NMM, si se detecta un aumento de la ASC sin CB, los cambios morfológicos del nervio también deben tener significación clínica. La exploración consecutiva a lo largo del nervio y las mediciones en un mayor número de sitios para detectar cambios morfológicos podrían aumentar la sensibilidad diagnóstica para MMN.
En conclusión, existían tres patrones de correlaciones entre CB y CSA, y los cambios electrofisiológicos y morfológicos no siempre fueron consistentes en MMN. Los estudios ecográficos podrían detectar más lesiones a lo largo del nervio en MMN, incluso sin CB. La combinación de estudios de ecografía y ecografía motora podría proporcionar más información para el diagnóstico clínico de la NMM.
Limitaciones
Este fue un estudio de comparación de un solo parámetro, transversal. Las diferentes duraciones de la enfermedad de los pacientes con NMM en este estudio, además de sus diferentes alturas y pesos, podrían afectar la CSA nerviosa y la detección de la velocidad de conducción nerviosa. Además, solo observamos si se presentó CB del nervio motor y si hubo cambios relacionados en los ASC en una ecografía; los mecanismos potenciales de los diferentes patrones de correlación entre CB y CSA requieren un estudio adicional. Solo la CSA nerviosa, el parámetro más importante, se había incluido en este estudio, por lo que para realizar una investigación más precisa, se debería involucrar más índice como la intensidad del eco.
Declaración de disponibilidad de datos
Todos los datos no publicados en el artículo están disponibles y se compartirán a solicitud de cualquier investigador cualificado.
Declaración de ética
El comité de ética del Peking Union Medical College Hospital aprobó nuestro protocolo de estudio y todos los pacientes firmaron un formulario de consentimiento informado de acuerdo con la Declaración de Helsinki.
Contribuciones de los autores
YL: estudios electrofisiológicos y ecográficos, adquisición de datos, análisis estadístico y redacción de manuscritos. JN: estudios electrofisiológicos y ecográficos y análisis estadístico. LC: concepto y diseño del estudio y edición de manuscritos. TL: recopilación de datos y edición de manuscritos. QD: estudios electrofisiológicos y ecográficos. SW e YG: estudios electrofisiológicos. ML: concepto y diseño del estudio, revisión de datos, edición de manuscritos y revisión crítica.
Conflicto de intereses
ML recibió apoyo del Fondo Especial de Capital de Beijing (Z171100001017220).
Los demás autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Agradecimientos
Agradecemos la financiación del Fondo Especial de Capital de Beijing (Z171100001017220).
Material suplementario
El Material Suplementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fneur.2019.01055/full#supplementary-material
Vídeo 1. Modo 1: Bloqueo de conducción y ampliación de CSA en el mismo sitio en MMN.
Vídeo 2. Modo 2: Bloqueo de conducción y CSA normal en el mismo sitio en MMN.
Vídeo 3. Modo 3: Ampliación de CSA sin bloqueo de conducción correspondiente.
Abreviaturas
MMN: neuropatía motora multifocal; CB: bloqueo de la conducción nerviosa motora; CSA: área de sección transversal; NCS: estudios de conducción nerviosa motora.
1. Parry GJ, Clarke S. Neuropatía desmielinizante adquirida multifocal disfrazada de enfermedad de la neurona motora. Nervio Muscular. (1988) 11:103–7. doi: 10.1002 / mus.880110203
Resumen de PubMed / Texto Completo de CrossRef / Google Scholar
2. Grimm A, Rattay TW, Winter N, Axer H. Sistemas de puntuación por ultrasonido de nervios periféricos: evaluación comparativa y análisis comparativo. J Neurol. (2017) 264:243–53. doi: 10.1007 / s00415-016-8305-y
Resumen de PubMed / Texto Completo de CrossRef | Google Scholar
3. Rattay TW, Winter N, Decard BF, Dammeier NM, Hartig F, Ceanga M, et al. Ecografía nerviosa como herramienta de seguimiento en neuropatía motora multifocal tratada. Eur J Neurol. (2017) 24:1125–34. doi: 10.1111 / ene.13344
Resumen de PubMed / Texto Completo de CrossRef / Google Scholar
4. Loewenbruck KF, Liesenberg J, Dittrich M, Schafer J, Patzner B, Trausch B, et al. Ecografía nerviosa en la diferenciación de la neuropatía motora multifocal (MMN) y la esclerosis lateral amiotrófica con enfermedad predominante de la neurona motora inferior (ELA/LMND). J Neurol. (2016) 263:35–44. doi: 10.1007 / s00415-015-7927-9
Resumen de PubMed / Texto Completo de CrossRef | Google Scholar
5. Kerasnoudis A, Pitarokoili K, Behrendt V, Gold R, Yoon SRA. Neuropatía motora multifocal: correlación de ecografía nerviosa, hallazgos electrofisiológicos y clínicos. Sistema de Nerv de Periféricos J. (2014) 19:165–74. doi: 10.1111 | jns5.12067
Resumen de PubMed / Texto completo de CrossRef | Google Scholar
6. Beekman R, van den Berg LH, Franssen H, Visser LH, van Asseldonk JT, Wokke JH. La ecografía muestra ampliaciones nerviosas extensas en neuropatía motora multifocal. Neurología. (2005) 65:305–7. doi: 10.1212 / 01.wnl.0000169179.67764.30
Resumen de PubMed / Texto Completo de CrossRef / Google Scholar
7. Olney RK, Lewis RA, Putnam TD, Campellone JV Jr. Criterios de consenso para el diagnóstico de neuropatía motora multifocal. Nervio Muscular. (2003) 27:117–21. doi: 10.1002 / mus.10317
Resumen de PubMed / Texto Completo de CrossRef / Google Scholar
8. Niu J, Cui L, Liu M. Ecografía de múltiples sitios de nervios periféricos en la diferenciación de charcot-marie-tooth tipo 1A de polirradiculoneuropatía desmielinizante inflamatoria crónica. Neurol Delantero. (2017) 8:181. doi: 10.3389 / fneur.2017.00181
Resumen de PubMed / Texto Completo de CrossRef / Google Scholar
9. Pitarokoili K, Gold R, Yoon MS. Ultrasonido de nervios en un caso de neuropatía motora multifocal sin bloqueo de conducción. Nervio Muscular. (2015) 52:294–9. doi: 10.1002 / mus.24583
Resumen de PubMed / Texto Completo de CrossRef / Google Scholar
10. Hartig F, Ross M, Dammeier NM, Fedtke N, Heiling B, Axer H, et al. La ecografía nerviosa predice la respuesta al tratamiento en la polirradiculoneuropatía desmielinizante inflamatoria crónica, un seguimiento prospectivo. Neurotherapeutics. (2018) 15:439–51. doi: 10.1007 / s13311-018-0609-4
Resumen de PubMed / Texto Completo de CrossRef | Google Scholar
11. Tsukamoto H, Granata G, Coraci D, Paolasso I, Padua L. Ecografía y correlación neurofisiológica en el bloqueo común de la conducción del nervio peroneo en la cabeza peronea. Clin Neurofisiol. (2014) 125:1491–5. doi: 10.1016 / j.clinph.2013.11.041
Resumen de PubMed / Texto Completo de CrossRef / Google Scholar
12. Harschnitz O, Jongbloed BA, Franssen H, Straver DC, van der Pol WL, van den Berg LH. MMN: from immunological cross-talk to conduction block. J Clin Immunol. (2014) 34(Suppl 1):S112–9. doi: 10.1007/s10875-014-0026-3
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Franssen H. The node of Ranvier in multifocal motor neuropathy. J Clin Immunol. (2014) 34(Suppl 1):S105–11. doi: 10.1007/s10875-014-0023-6
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Taylor BV, Dyck PJ, Engelstad J, Gruener G, Grant I, Dyck PJ. Multifocal motor neuropathy: alteraciones patológicas en el sitio del bloqueo de conducción. J Neuropatol Exp Neurológico. (2004) 63:129–37. doi: 10.1093/jnen / 63.2.129
Resumen de PubMed / Texto completo de CrossRef / Google Scholar
15. Grimm A, Winter N, Rattay TW, Hartig F, Dammeier NM, Auffenberg E, et al. Una mirada al interior de la morfología nerviosa de los fascículos nerviosos en controles sanos y pacientes con polineuropatía. Clin Neurofisiol. (2017) 128:2521–6. doi: 10.1016 / j.clinph.2017.08.022
Resumen de PubMed / Texto Completo de CrossRef / Google Scholar
16. Haakma W, Jongbloed BA, Froeling M, Goedee HS, Bos C, Leemans A, et al. La resonancia magnética muestra engrosamiento y difusión alterada en los nervios mediano y cubital en la neuropatía motora multifocal. Eur Radiol. (2017) 27:2216–24. doi: 10.1007 / s00330-016-4575-0
Resumen de PubMed / Texto Completo de CrossRef | Google Scholar
17. Kaji R, Oka N, Tsuji T, Mezaki T, Nishio T, Akiguchi I, et al. Hallazgos patológicos en el sitio del bloqueo de la conducción en neuropatía motora multifocal. Ann Neurol. (1993) 33:152–8. doi: 10.1002 / ana.410330204
Resumen de PubMed / Texto Completo de CrossRef / Google Scholar
18. Gallardo E, Noto Y, Simon NG. Ultrasonido en el diagnóstico de neuropatía periférica: la estructura se encuentra con la función en la clínica neuromuscular. J Neurol Neurosurg Psychiatry. (2015) 86:1066–74. doi: 10.1136 / jnnp-2014-309599
Resumen de PubMed / Texto completo de CrossRef / Google Scholar