Frontiers in Medicine
- Introducción
- Pacientes y métodos
- Selección de pacientes en la Base de Datos de Vigilancia, Epidemiología y Resultados finales
- Análisis estadístico
- Resultados
- Características de los pacientes
- Mejor Riesgo de Estadio T1 En Comparación con Otros Estadios T en el Contexto de Elevación sérica del ACE
- Efecto de la Elevación del ACE Sérico Preoperatorio en el estadio T
- Discusión
- Declaración de disponibilidad de datos
- Declaración de Ética
- Contribuciones de los autores
- Conflicto de intereses
- Agradecimientos
Introducción
El cáncer de recto es una de las neoplasias malignas más comunes en todo el mundo (1). Según el sistema de estadificación del American Joint Committee on Cancer (AJCC), la extensión anatómica del tumor primario (estadio T) es uno de los factores pronósticos más importantes. Sin embargo, los pacientes con el mismo estadio T de cáncer de recto pueden mostrar resultados clínicos considerablemente diferentes.
Se notificó por primera vez en 1965 que el antígeno carcinoembrionario (ACE) es una glicoproteína de 180-200 kDa y un miembro de la superfamilia de inmunoglobulinas (2). El ACE es secretado por una variedad de tumores sólidos, incluido el 90% de los cánceres colorrectales (3). Como el biomarcador pronóstico sérico más importante y confiable para el cáncer colorrectal, se encontró que los niveles elevados de ACE preoperatorio se relacionan con un peor pronóstico del cáncer colorrectal (4-9).
En estudios anteriores se demostró que el ACE se relacionaba con la adhesión de células cancerosas y la inmunidad innata en el cáncer colorrectal. Además, también se notificó que el ACE facilita la unión de las células cancerosas colorrectales a los sitios de metástasis y apoya la progresión tumoral (10-12).
Tradicionalmente, la diseminación a distancia de las células tumorales se ha considerado un evento tardío, sin embargo, los hallazgos de varios estudios previos indicaron que la adquisición de potencial metastásico podría ocurrir en el estadio muy temprano de la progresión tumoral (13-16). Wo et al. (17) informaron que un tamaño tumoral muy pequeño involucrado en la positividad de los ganglios linfáticos puede ser un sustituto de la biología agresiva. Luego, sospechamos que el cáncer de recto en estadio muy temprano con elevación del ACE sérico podría sugerir la adquisición temprana de potencial metastásico y predecir una supervivencia muy precaria del cáncer de recto.
Sin embargo, hasta donde sabemos, se notificaron pocos estudios para investigar la asociación del estadio T y los niveles séricos de ACE (C0 y C1) para determinar el pronóstico del cáncer de recto. Por lo tanto, llevamos a cabo este gran estudio poblacional para examinar si el estadio T muy temprano en el contexto de la elevación del ACE sérico puede ser un sustituto de la enfermedad biológicamente agresiva y predecir una supervivencia pobre por causa específica (CSS) del cáncer de recto. Para eliminar el efecto de la positividad de los ganglios linfáticos en nuestra investigación, excluimos a los pacientes con ganglios positivos y centramos el análisis en los pacientes en estadio I-II.
Pacientes y métodos
Selección de pacientes en la Base de Datos de Vigilancia, Epidemiología y Resultados finales
Como fuente autorizada de información sobre la incidencia y supervivencia del cáncer en los Estados Unidos y una fuente integral de información basada en la población, que incluye todos los casos de cáncer recién diagnosticados que ocurren en las áreas que participan en la Vigilancia, Epidemiología y Resultados Finales (SEER), la base de datos SEER abarca aproximadamente 28% de la población estadounidense. La base de datos SEER no contenía ningún identificador y estaba a disposición del público para los investigadores. SEER * Stat es un software proporcionado por el programa SEER para obtener información del paciente mediante el acceso en línea. Al principio, se utilizó la sesión de listado de casos del software SEER*Stat (SEER*Stat 8.3.5) para enumerar toda la información relacionada con el paciente, y los pacientes diagnosticados con cáncer de recto en estadios I-II (sin ganglios linfáticos) entre el 1 de enero de 2004 y el 31 de diciembre de 2015 se identificaron a partir de la base de datos SEER (Figura 1). Los pacientes de cáncer de recto se identificaron mediante los códigos de sitio CIE-O-3 C199 y C209 y el código de conducta 3 (Artículos 522 y 523 de la NAACCR) (9). Elegimos incluir estos años porque la información del ACE sérico preoperatorio se registró a partir de 2004 y el seguimiento del SEER finalizó en 2015.FIGURA

Gráfico 1 Diagrama de flujo de definiciones de cohortes de pacientes.
Se excluyeron de nuestro estudio los que recibieron radioterapia neoadyuvante, falta de confirmación histológica positiva, raza desconocida, histologías no adenocarcinoma o seguimiento no activo. Los pacientes con nivel sérico de ACE disponible en el preoperatorio fueron incluidos en nuestro estudio, y agrupamos “positivo / elevado” y ” negativo / normal; dentro de los límites normales ” como C1 y C0 (información de la etapa C). Los valores de corte del ACE fueron de 2,5 ng/ml para los no fumadores y de 5 ng/ml para los fumadores, respectivamente. Además, también se obtuvieron de la base de datos SEER las siguientes variables clinicopatológicas de los pacientes: estadio T, raza, sexo, ubicación del tumor, edad en el momento del diagnóstico, año de diagnóstico, grado e histología.
Análisis estadístico
En el presente estudio, se utilizó la prueba chi-cuadrado de Pearson para comparar todas las variables clinicopatológicas de los pacientes recuperadas de la base de datos SEER entre los niveles séricos de ACE normales y elevados en el preoperatorio. Se construyeron algunos modelos multivariables de riesgo proporcional de Cox para identificar variables pronósticas independientes de cáncer de recto en nuestros análisis. Las curvas de supervivencia se generaron mediante el método de Kaplan–Meier, y las diferencias entre las curvas se analizaron mediante la prueba de rango logarítmico. Los desenlaces principales de interés en el presente estudio fueron la CSS y la supervivencia general (SG). El SCS se calculó desde la fecha del diagnóstico hasta la fecha de la muerte específica por cáncer. Las muertes atribuidas al cáncer de recto se trataron como eventos, y las muertes por otras causas se trataron como observaciones censuradas en la fecha de la muerte. Para determinar si hubo una interacción significativa entre el nivel de ACE sérico preoperatorio y el estadio T en la predicción de CSS, también definimos una variable de interacción (estadio T y nivel de ACE sérico). P bilateral < 0,05 fue considerado estadísticamente significativo. Los análisis estadísticos se realizaron principalmente con el programa SPSS versión 22 (IBM Corporation, Armonk, NY, EE. UU.).
Resultados
Características de los pacientes
En general, se identificaron 19.184 pacientes diagnosticados con cáncer de recto en estadios I–II a partir de la base de datos SEER entre el 1 de enero de 2004 y el 31 de diciembre de 2015 (Figura 1). De estos pacientes, 13.007 (67,8%) pacientes fueron asignados al estadio C0 y 6.177 (32,2%) pacientes fueron asignados al estadio C1. El sistema de estadificación del AJCC indicó que 6.077 pacientes se encontraban en el estadio T1, 4.783 pacientes en el estadio T2, 7.021 en el estadio T3 y 1.303 en el estadio T4. Un total de 2.560 (13,3%) pacientes murieron de cáncer de recto al final del tiempo de seguimiento. La mediana del tiempo de seguimiento de toda la cohorte fue de 44 meses (0-143 meses). Las características basales de los pacientes se resumen en la Tabla 1.
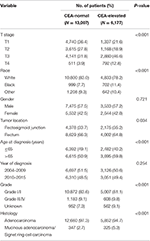
Cuadro 1 Comparación de las características basales del cáncer de recto en estadio I–II por el nivel sérico de antígeno carcinoembrionario (ACE).
Mejor Riesgo de Estadio T1 En Comparación con Otros Estadios T en el Contexto de Elevación sérica del ACE
Se encontró que el estadio C1 tenía más probabilidades de correlacionarse con estadio T más alto, unión rectosigmoide negra, edad más avanzada, grado más alto y adenocarcinoma mucinoso/carcinoma de células en anillo de sello (Tabla 1, P < 0,05). Como se muestra en la Tabla 2, la raza, el sexo, la ubicación del tumor, la edad en el momento del diagnóstico, el año de diagnóstico, el grado, las características histológicas, el estadio T y la concentración sérica de ACE se incluyeron en el análisis multivariado de Cox. Cuando se realizó un análisis multivariado de Cox, se convenció de que las siguientes características clinicopatológicas eran factores pronósticos independientes en el cáncer de recto en estadios I–II: raza, sexo, ubicación tumoral, edad en el momento del diagnóstico, grado tumoral, estadio T y nivel sérico de ACE, mientras que el riesgo entre T2, C0 y T1,C0 no fue una diferencia estadística (P = 0,925). Se observó que, en el contexto de la elevación sérica del ACE, el estadio T1 presentaba un riesgo inesperado más alto de mortalidad específica por cáncer de recto en comparación con los estadios T2 y T3. En el estadio T1 de la enfermedad, un nivel elevado de ACE sérico se asoció con un aumento del 227,6% del riesgo de mortalidad en comparación con el nivel normal de ACE sérico.

Cuadro 2 Análisis multivariantes de regresión de Cox de supervivencia por causa específica (CSS) en cáncer de recto en estadio I–II.
Las curvas de supervivencia de Kaplan–Meier se representan en las Figuras 2, 3. La tasa de CSS a 5 años fue de 92,2% en T1C0, 75,2% en T1C1, 93,1% en T2C0, 86,7% en T2C1, 84,6% en T3C0, 76,3% en T3C1, 62,9% en T4C0 y 43,6% en T4C1 (Figura 2, P < 0,001). Por lo tanto, T1C1 presentó una tasa de CSS similar a 5 años en comparación con T3C1 (75,2 vs.76,3%, P = 0,238). Además, el hallazgo fue aún más pronunciado en la SG. La tasa de SG a 5 años fue de 78,6% en T1C0, 48,3% en T1C1, 77,1% en T2C0, 62,3% en T2C1, 68,5% en T3C0, 54,5% en T3C1, 45,3% en T4C0 y 30,0% en T4C1 (Figura 3, P < 0,001). T1C1 presentó una tasa de CSS a 5 años significativamente menor en comparación con T3C1 (48,3 vs. 54,5%, P < 0,001).FIGURA
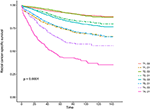
Gráfico 2 Curvas de supervivencia por causa específica (CSS) de Kaplan–Meier del estadio T combinadas con el nivel sérico de antígeno carcinoembrionario (ACE).
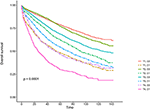
Figura 3. Curvas de supervivencia global (SG) de Kaplan–Meier del estadio T combinadas con el nivel sérico del antígeno carcinoembrionario (ACE).
Efecto de la Elevación del ACE Sérico Preoperatorio en el estadio T
Se dibujó la gráfica de bosque para mostrar los cocientes de riesgo (HR) para comparar la CSS entre los grupos de ACE normal y elevado en los estadios T respectivos (Figura 4). En comparación con el nivel normal de ACE sérico, en el estadio T2, el nivel elevado de ACE sérico se relacionó con un aumento del 69,0% del riesgo de mortalidad específica por cáncer de recto ; en el estadio T3, el nivel elevado de ACE sérico se relacionó con un aumento del 67,2% del riesgo de mortalidad específica por cáncer de recto (CRI = 1,672, IC del 95% = 1,486-1,882, P < 0,001); en el estadio T4, el nivel elevado de ACE sérico se relacionó con 81,3 Porcentaje de aumento del riesgo de mortalidad específica por cáncer de recto (CRI = 1,813, IC 95% = 1,485-2,213, P < 0,001); sin embargo, en contraste, en el estadio T1, el nivel elevado de ACE sérico se presentó hasta 211.6% de aumento del riesgo de mortalidad específica por cáncer de recto (CRI = 3,116, IC 95% = 2,639-3,679, P < 0,001).FIGURA
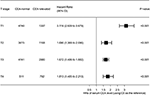
Gráfico 4 Cocientes de riesgo (HR) de supervivencia por causa específica (CSS) entre niveles normales y elevados de antígeno carcinoembrionario (ACE) sérico de acuerdo con el estadio T.
Discusión
Nuestro objetivo fue investigar la asociación del estadio T y los niveles séricos de ACE en la determinación de la CSS del cáncer de recto. Planteamos la hipótesis de que el cáncer de recto con estadio T muy temprano (estadio T1) y elevación del ACE sérico puede ser un sustituto biológico de la enfermedad agresiva, lo que predice un desenlace oncológico precario. Con aproximadamente 20,000 pacientes diagnosticados con cáncer de recto en estadios I–II incluidos en nuestro estudio.
En este estudio, se encontró que la elevación del ACE sérico tenía más probabilidades de correlacionarse con estadio T más alto, unión rectosigmoide negra, edad más avanzada y adenocarcinoma mucinoso/carcinoma de células en anillo de sello de grado más alto. Los análisis de supervivencia de Kaplan–Meier mostraron que, en el contexto de la elevación del ACE sérico, la tasa de CSS a 5 años del estadio T1 fue del 75,2%, lo que no logró una diferencia estadística con respecto al estadio T3 (76,3%). En lo que respecta a la supervivencia general, la tasa de SG a 5 años del estadio T1 con elevación del ACE sérico preoperatorio (48,3%) fue incluso menor que la del estadio T3 involucrado en la elevación del ACE (54,5%) y no alcanzó una diferencia estadística con respecto al estadio T4 (45.3%), lo que significa que una concentración sérica preoperatoria elevada de ACE podría identificar un subgrupo de cánceres de recto en estadio T1 con CSS similar en comparación con algunas enfermedades en estadio T3 y con SG similar en comparación con algunas enfermedades en estadio T4.
Después de ajustar los factores pronósticos conocidos del cáncer de recto (raza, sexo, ubicación del tumor, edad en el momento del diagnóstico, año de diagnóstico, grado e histología), se demostró que la variable de interacción (estadio T y nivel sérico de ACE) que definimos era un factor pronóstico independiente del cáncer de recto. En el análisis multivariante de Cox, se observó que, en el contexto de la elevación del ACE sérico, el estadio T1 presentaba un riesgo más alto inesperado de mortalidad específica por cáncer de recto en comparación con los estadios T2 y T3. En el estadio T1 de la enfermedad, un nivel elevado de ACE sérico se asoció con un aumento del 227,6% del riesgo de mortalidad en comparación con el nivel normal de ACE sérico. Además, la raza, el sexo, la ubicación del tumor, la edad en el momento del diagnóstico y el grado del tumor también se identificaron como factores pronósticos independientes del cáncer de recto en estadios I–II. Aparte de T1, se encontró que la elevación del ACE sérico preoperatorio presentaba un riesgo ~ 75% mayor de mortalidad específica por cáncer de recto en el estadio T respectivo, sin embargo, el número aumentó en gran medida a 211,6% en el estadio T1.
En 2000, el Grupo de Trabajo Colorrectal del AJCC propuso la inclusión de la concentración sérica de ACE (estadio C) en el sistema convencional de estadificación TNM del AJCC para el cáncer colorrectal (18). Además, la Sociedad Americana de Oncología Clínica y el Grupo Europeo de Marcadores Tumorales han apoyado la inclusión del nivel sérico preoperatorio de ACE como herramienta de pronóstico en el cáncer colorrectal (19-21).
Varias investigaciones previas informaron que el nivel sérico de ACE tenía un fuerte papel pronóstico en el cáncer de colon (4-7, 22-26). En 2011, Thirunavukarasu et al. (25) informaron que el nivel sérico preoperatorio de ACE era un biomarcador pronóstico independiente del cáncer de colon, y que el pronóstico era peor en los pacientes con ACE alto en estadio más bajo en comparación con los pacientes con ACE bajo en estadio más alto. En ese estudio, se consideró que el ACE alto era tan fuerte como la positividad ganglionar para predecir resultados oncológicos precarios del cáncer de colon.
Sin embargo, pocos estudios se centran en dilucidar la función pronóstica de la concentración sérica de ACE en el cáncer de recto. En 2016, utilizando también la base de datos SEER, Tarantino et al. (9, 27) llevaron a cabo dos investigaciones amplias con base en la población, que proporcionaron pruebas convincentes de que una concentración elevada de ACE sérico preoperatorio era un fuerte factor de predicción de una supervivencia general y específica del cáncer peor en el cáncer de recto. En 2018, Liu et al. (8) demostraron que el ACE sérico preoperatorio era un factor pronóstico independiente del cáncer de recto, y que el nivel sérico elevado de ACE presentaba una supervivencia evidentemente más precaria en comparación con el nivel sérico normal de ACE en estadios I a IV. Sin embargo, los dos únicos estudios previos se centraron en investigar el papel pronóstico del nivel sérico de ACE preoperatorio y no examinaron la relación entre el nivel de ACE y el estadio T en la predicción de los desenlaces tumorales del cáncer de recto.
Aunque el convencional muestra que el cáncer adquiere el potencial metastásico paso a paso a medida que crece a un tamaño grande (28), sin embargo, algunos estudios previos indicaron que la adquisición del potencial metastásico podría ocurrir muy temprano en la progresión del tumor. Una investigación previa demostró la supervivencia extremadamente precaria de un tumor de tamaño muy pequeño cuando está involucrado en la positividad de los ganglios linfáticos (17). Además, los hallazgos de nuestra investigación muestran que la elevación del nivel sérico preoperatorio de ACE en el cáncer de recto en estadio muy temprano (estadio T1) se asocia con una SG y CSS muy deficientes y puede ser un sustituto de la biología agresiva. Creemos que tanto el compromiso de los ganglios linfáticos como la elevación del ACE sérico se consideran adquisición de capacidad metastásica. Nuestro estudio, combinado con el de Wo et al. apoyan sistemáticamente la idea mencionada de que la adquisición de potencial metastásico podría ocurrir muy temprano en la progresión del tumor, por lo tanto relacionada con desenlaces oncológicos precarios, y es más probable que la característica biológica inicial determine el potencial de metástasis a distancia durante la progresión del cáncer, en lugar de la capacidad metastásica acumulada (29).
Además, los hallazgos de nuestro estudio son de importancia clínica. En la actualidad, el cáncer de recto en estadio I se trata con resección quirúrgica radical sola debido a los resultados oncológicos relativamente favorables. Sin embargo, aproximadamente 10-15% de los pacientes presentarán recidiva tumoral después de la resección radical (30, 31). En el presente estudio, identificamos un subgrupo de cáncer de recto en estadio T1 con pronóstico muy precario en comparación con el resto del cáncer de recto en estadio I, lo que significa que el cáncer de recto en estadio T1 con compromiso de elevación del ACE sérico preoperatorio debería llamar más la atención de los oncólogos.
sin Embargo, hay dos limitaciones en nuestro estudio. Por un lado, este estudio no incluyó en nuestros análisis algunos factores pronósticos conocidos de cáncer de recto, como el estado de inestabilidad de microsatélites y las complicaciones posoperatorias, que no estaban disponibles en la base de datos SEER y podrían introducir sesgos en cierta medida. No podemos proporcionar rangos y valores medios de ACE en ambos grupos. Por otro lado, el presente estudio fue retrospectivo en lugar de basarse en datos prospectivos. Por lo tanto, nuestros hallazgos aún necesitan ser validados en otras cohortes, especialmente en estudios clínicos prospectivos de gran tamaño.
En conclusión, nuestro estudio demuestra que el cáncer de recto en estadio T1, cuando está involucrado en la elevación del ACE sérico preoperatorio, puede ser un sustituto de la enfermedad biológicamente agresiva y correlacionarse con SG y CSS desfavorables. Además, este subgrupo de cáncer de recto merece más atención clínica de los oncólogos. Nuestros hallazgos, si se validan en futuros estudios de bases de datos, proporcionarían una nueva idea de terapia para el cáncer de recto en estadio temprano.
Declaración de disponibilidad de datos
Los conjuntos de datos generados para este estudio están disponibles a petición del autor correspondiente.
Declaración de Ética
Los pacientes de este estudio fueron identificados a partir de la base de datos SEER, y la aprobación para el uso de los datos se obtuvo a través de una solicitud presentada al programa SEER. La aprobación de la junta de revisión institucional no fue necesaria porque la base de datos SEER está a disposición del público.
Contribuciones de los autores
SW y WG han hecho una contribución sustancial y directa a este estudio, y lo aprobaron para su envío.
Conflicto de intereses
Los autores declaran que la investigación se realizó en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un conflicto de intereses potencial.
Agradecimientos
Este trabajo fue apoyado en parte por el Proyecto de Plan de Desarrollo de Ciencia y Tecnología Médica de Yancheng (YK2015075).
1. Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Estadísticas globales de cáncer 2018: estimaciones de GLOBOCAN de incidencia y mortalidad en todo el mundo de 36 cánceres en 185 países. CA Cancer J Clin. (2018) 68:394–424. doi: 10.3322 / caac.21492
Resumen de PubMed / Texto Completo de CrossRef / Google Scholar
2. Gold P, Freedman SO. Demostración de antígenos tumorales específicos en carcinomas colónicos humanos mediante técnicas inmunológicas de tolerancia y absorción. J Exp Med. (1965) 121:439–62. doi: 10.1084 / jem.121.3.439
Resumen de PubMed / Texto Completo de CrossRef / Google Scholar
3. Goldstein MJ, Mitchell EP. Antígeno carcinoembrionario en la estadificación y el seguimiento de pacientes de cáncer colorrectal. Cancer Invest. (2005) 23:338–51. doi: 10.1081 / CNV-58878
Resumen de PubMed / Texto completo de CrossRef / Google Scholar
4. Becerra AZ, Probst CP, Tejani MA, Aquina CT, González MG, Hensley BJ, et al. Evaluación de la función pronóstica de niveles elevados de antígeno carcinoembrionario preoperatorio en pacientes con cáncer de colon: resultados de la base de datos nacional de cáncer. Ann Surg Oncol. (2016) 23:1554–61. doi: 10.1245 / s10434-015-5014-1
Resumen de PubMed / Texto Completo de CrossRef | Google Scholar
5. Ogata Y, Murakami H, Sasatomi T, Ishibashi N, Mori S, Ushijima M, et al. La concentración elevada de antígeno carcinoembrionario sérico preoperatorio puede ser un indicador eficaz de la necesidad de quimioterapia adyuvante después de una resección potencialmente curativa del cáncer de colon en estadio II. J Surg Oncol. (2010) 99:65–70. doi: 10.1002 / jso.21161
Resumen de PubMed / Texto Completo de CrossRef / Google Scholar
6. Quah HM, Chou JF, Gonen M, Shia J, Schrag D, Landmann RG, et al. Identificación de pacientes de cáncer de colon en estadio II de riesgo alto para terapia adyuvante. Dis Colon Recto. (2008) 51:503–7. doi: 10.1007 / s10350-008-9246-z
Resumen de PubMed / Texto Completo de CrossRef | Google Scholar
7. Spindler BA, Bergquist JR, Thiels CA, Habermann EB, Kelley SR, Larson DW, et al. La incorporación de ACE mejora la estratificación del riesgo en el cáncer de colon en estadio II. J Gastrointest Surg. (2017) 21:770-7. doi: 10.1007 / s11605-017-3391-4
Resumen de PubMed / Texto Completo de CrossRef | Google Scholar
8. Liu Q, Lian P, Luo D, Cai S, Li Q, Li X. Combinación de antígeno carcinoembrionario con el sistema de estadificación TNM del American Joint Committee on Cancer en cáncer de recto: un estudio de base poblacional grande y del mundo real. Onco Apunta Allí. (2018) 11:5827–34. doi: 10.2147 / OTT.S171433
Resumen de PubMed / Texto Completo de CrossRef / Google Scholar
9. Tarantino I, Warschkow R, Schmied BM, Güller U, Mieth M, Cerny T, et al. Valor predictivo del ACE para la supervivencia en cáncer de recto en estadio I: un análisis de puntuación de propensión coincidente basado en la población. J Gastrointest Surg. (2016) 20:1213-22. doi: 10.1007/s11605-016-3137-8
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Beauchemin N, Arabzadeh A. Carcinoembryonic antigen-related cell adhesion molecules (CEACAMs) in cancer progression and metastasis. Cancer Metastasis Rev. (2013) 32:643–71. doi: 10.1007/s10555-013-9444-6
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Arabzadeh A, Chan C, Nouvion AL, Breton V, Benlolo S, DeMarte L, et al. Host-related carcinoembryonic antigen cell adhesion molecule 1 promotes metastasis of colorectal cancer. Oncogén. (2013) 32:849–60. doi: 10.1038 / onc.2012.112
Resumen de PubMed / Texto Completo de CrossRef / Google Scholar
12. Cai Z, Xiao J, He X, Ke J, Zou Y, Chen Y, et al. Acceso a la nueva importancia pronóstica del antígeno carcinoembrionario preoperatorio en cáncer colorrectal que recibe resección tumoral: más que positivo y negativo. Biomarca del Cáncer. (2017) 19:161–8. doi: 10.3233 / CBM-160287
Resumen de PubMed / Texto completo de CrossRef / Google Scholar
13. Engel J, Eckel R, Kerr J, Schmidt M, Fürstenberger G, Richter R, et al. El proceso de metástasis para el cáncer de mama. Eur J Cáncer. (2003) 39:1794–806. doi: 10.1016 / S0959-8049(03)00422-2
Resumen de PubMed / Texto Completo de CrossRef | Google Scholar
14. Hüsemann Y, Geigl JB, Schubert F, Musiani P, Meyer M, Burghart E, et al. La diseminación sistémica es un paso temprano en el cáncer de mama. Célula Cancerosa. (2008) 13:58–68. doi: 10.1016 / j. ccr.2007.12.003
Resumen de PubMed / Texto Completo de CrossRef / Google Scholar
15. Podsypanina K, Du YC, Jechlinger M, Beverly LJ, Hambardzumyan D, Varmus H. Siembra y propagación de células mamarias de ratón no transformadas en el pulmón. Ciencia. (2008) 321:1841–4. doi: 10.1126 / ciencia.1161621
Resumen de PubMed / Texto Completo de CrossRef / Google Scholar
16. Schmidt-Kittler O, Ragg T, Daskalakis A, Granzow M, Ahr A, Blankenstein TJ, et al. From latent disseminated cells to overt metastasis: genetic analysis of systemic breast cancer progression (en inglés). Proc Natl Acad Sci USA. (2003) 100:7737–42. doi: 10.1073 / pnas.1331931100
Resumen de PubMed / Texto Completo de CrossRef / Google Scholar
17. Wo JY, Chen K, Neville BA, Lin NU, Punglia RS. Efecto del tamaño tumoral muy pequeño en la mortalidad específica por cáncer en el cáncer de mama con ganglios positivos. J Clin Oncol. (2012) 23:32–3. doi: 10.1016 / j.breastdis.2012.01.026
Texto completo de CrossRef / Google Scholar
18. Compton C, Fenoglio-Preiser CM, Pettigrew N, Fielding LP. Conferencia de consenso del comité conjunto estadounidense sobre factores pronósticos del cáncer: grupo de trabajo colorrectal. Cancer. (2015) 88:1739–57. doi: 10.1002 / (SICI)1097-0142(20000401)88:7<1739::AYUDA-CNCR30>3.0.CO;2-T
Resumen de PubMed / Texto completo de CrossRef / Google Scholar
19. Duffy MJ, van Dalen A, Haglund C, Hansson L, Holinski-Feder E, Klapdor R, et al. Marcadores tumorales en cáncer colorrectal: Guía de uso clínico del Grupo Europeo de Marcadores Tumorales (EGTM). Eur J Cáncer. (2007) 43:1348–60. doi: 10.1016 / j. ejca.2007.03.021
Resumen de PubMed / Texto Completo de CrossRef / Google Scholar
20. Locker GY, Hamilton S, Harris J, Jessup JM, Kemeny N, Macdonald JS, et al. Actualización de ASCO 2006 de recomendaciones para el uso de marcadores tumorales en cáncer gastrointestinal. J Clin Oncol. (2006) 24:5313–27. doi: 10.1200 / JCO.2006.08.2644
Resumen de PubMed / Texto Completo de CrossRef / Google Scholar
21. Duffy MJ, Lamerz R, Haglund C, Nicolini A, Kalousová M, Holubec L, et al. Marcadores tumorales en cáncer colorrectal, cáncer gástrico y cánceres de estroma gastrointestinal: Actualización de las directrices del grupo europeo de marcadores tumorales de 2014. Cáncer Int J. (2014) 134:2513–22. doi: 10.1002 / ijc.28384
Resumen de PubMed / Texto Completo de CrossRef / Google Scholar
22. Harrison LE, Guillem JG, Paty P, Cohen AM. El antígeno carcinoembrionario preoperatorio predice los desenlaces en pacientes con cáncer de colon sin ganglios linfáticos: un análisis multivariado de 572 pacientes. J Am Coll Surg. (1997) 185:55-9. doi: 10.1016 / S1072-7515(97)00012-4
Resumen de PubMed / Texto Completo de CrossRef | Google Scholar
23. Huh JW, Oh BR, Kim HR, Kim YJ. Nivel de antígeno carcinoembrionario preoperatorio como factor pronóstico independiente en el cáncer de colon potencialmente curativo. J Surg Oncol. (2010) 101:396–400. doi: 10.1002 / jso.21495
Resumen de PubMed / Texto Completo de CrossRef / Google Scholar
24. Ozawa H, Kotake K, Hosaka M, Hirata A, Nakagawa Y, Fujita S, et al. Incorporación de los niveles séricos de antígeno carcinoembrionario en el sistema de agrupación pronóstica del cáncer de colon. Int J Colorect Dis. (2017) 32:1–9. doi: 10.1007 / s00384-017-2772-1
Resumen de PubMed / Texto Completo de CrossRef | Google Scholar
25. Thirunavukarasu P, Sukumar S, Sathaiah M, Mahan M, Pragatheeshwar KD, Pingpank JF, et al. Estadio C del cáncer de colon: implicaciones del biomarcador del antígeno carcinoembrionario en la estadificación, el pronóstico y el manejo. J Natl Cáncer Inst. (2011) 103:689–97. doi: 10.1093/jnci / djr078
Resumen de PubMed / Texto completo de CrossRef | Google Scholar
26. Margalit O, Mamtani R, Yang YX, Reiss KA, Golan T, Halpern N, et al. Evaluación del valor pronóstico de las concentraciones de antígenos carcinoembrionarios en cáncer de colon en estadios I y II. Eur J Cáncer. (2018) 94:1–5. doi: 10.1016 / j. ejca.2018.01.112
Resumen de PubMed / Texto Completo de CrossRef / Google Scholar
27. Tarantino I, Warschkow R, Worni M, Merati-Kashani K, Köberle D, Schmied BM, et al. El ACE preoperatorio elevado se relaciona con una supervivencia más precaria en pacientes con cáncer de recto en estadios I a III. Br J Cáncer. (2012) 107:266. doi: 10.1038 / bjc.2012.267
Resumen de PubMed / Texto Completo de CrossRef / Google Scholar
28. Norton L, Massague J. ¿Es el cáncer una enfermedad de auto-siembra? Nat Med. (2006) 12:875–8. doi: 10.1038 / nm0806-875
Resumen de PubMed / Texto completo de CrossRef / Google Scholar
29. Yu KD, Jiang YZ, Chen S, Cao ZG, Wu J, Shen ZZ, et al. Efecto del tamaño tumoral grande en la mortalidad específica por cáncer en el cáncer de mama sin ganglios linfáticos. Proceso de Mayo Clin. (2012) 87:1171–80. doi: 10.1016 / j.mayocp.2012.07.023
Resumen de PubMed / Texto Completo de CrossRef / Google Scholar
30. Blumberg D, Paty PB, Picon AI, Guillem JG, Klimstra DS, Minsky BD, et al. Cáncer de recto en estadio I: identificación de pacientes de riesgo alto. J Am Coll Surg. (1998) 186: 574-9; discusión:579-80. doi: 10.1016 / S1072-7515(98)00018-0
Resumen de PubMed / Texto Completo de CrossRef | Google Scholar
31. Gunderson LL, Sargent DJ, Tepper JE, Wolmark N, O’Connell MJ, Begovic M, et al. Impacto de los estadios T y N y el tratamiento en la supervivencia y la recaída en el cáncer de recto adyuvante: un análisis agrupado. J Clin Oncol. (2004) 22:1785-96. doi: 10.1200 / JCO.2004.08.173
Resumen de PubMed / Texto completo Cruzado / Google Scholar