Infección por Citomegalovirus (CMV) en pacientes con VIH/SIDA y valores diagnósticos de detección de ADN por CMV en diferentes tipos de muestras
- Introducción
- Métodos
- Sujetos
- Inclusión y exclusión
- Reactivos y equipos
- Cuantificación de VIH-ARN
- Recuento de linfocitos T CD4 +
- Cuantificación de ADN-CMV
- Prueba de anticuerpos contra CMV
- Métodos de estudio
- Detección de ácido nucleico
- Detección de subconjuntos de linfocitos T
- Detección de anticuerpos inmunes
- Análisis estadístico
- Resultados
- Datos generales
- Tasas positivas de ADN-CMV, IGG-CMV e IgM-CMV
- Correlación entre la infección por CMV y el recuento de linfocitos T CD4+
- Detección de ADN-CMV en diferentes muestras
- Discusión
- Conclusiones
- Agradecimientos
- Nota al pie
Introducción
El citomegalovirus (CMV) es un herpesvirus común que está muy extendido en poblaciones humanas. La infección por CMV por lo general no causa síntomas y afecta principalmente a las glándulas salivales, los riñones y otros órganos. Sin embargo, la replicación viral puede ocurrir en pacientes inmunodeprimidos y puede contribuir al daño a los órganos y sus funciones. Las infecciones oportunistas son más frecuentes y graves en los pacientes con VIH/SIDA. La infección por el virus CMV es común en estos pacientes y puede afectar a múltiples órganos y sistemas, incluidos los ojos, los pulmones, el sistema nervioso y el sistema digestivo. Muchos estudios han explorado las características virológicas e inmunológicas de la infección simple por CMV (1), especialmente las que se encuentran en mujeres y niños. Sin embargo, las características inmunológicas de la infección por CMV son bastante únicas en pacientes con VIH/SIDA que ya están inmunodeprimidos. Existen diferencias en las características clínicas, las medidas de tratamiento y los factores pronósticos entre los pacientes VIH con infección por CMV y aquellos con infección por CMV sola (2). Las directrices de China recomendaban que se necesitara de inmediato un tratamiento antiviral del CMV y la terapia antirretroviral en los pacientes con VIH/SIDA con complicaciones (retinitis, neumonía, encefalitis por CMV, enteritis, etc.).) cuando se identifica una infección por CMV. Debido a la no especificidad de los síntomas clínicos causados por la infección por CMV, el examen de laboratorio es la base principal para el diagnóstico de la infección por CMV. Los dos métodos clínicos más ampliamente utilizados son la replicación del virus del CMV y los métodos inmunológicos séricos, incluida la detección de IgG del CMV, IgM del CMV y antígeno del CMV PP65 (2) En pacientes con función inmune deteriorada, la producción de anticuerpos contra el CMV se debilita o retrasa, lo que puede dar lugar a falsos negativos y aumentar la tasa de diagnóstico omitido, por lo que la detección por PCR del ADN del CMV se ha convertido en gran medida en el método estándar para el diagnóstico de la infección por CMV y el seguimiento del tratamiento (3). Daisuke Mizushima et al. informó que la PCR de ADN-CMV en plasma tiene un valor importante en el diagnóstico de retinitis por CMV y de todos los EOD por CMV en pacientes con infección avanzada por VIH-1 (4). La PCR de ADN CMV se puede detectar en una variedad de tipos de muestras, como plasma, orina, líquido cefalorraquídeo, humor acuoso, heces, etc. (5). Sin embargo, pocos artículos han analizado y discutido la importancia y el valor de la detección de PCR de ADN-CMV en muestras distintas del plasma. En el presente estudio analizamos retrospectivamente las pruebas de laboratorio (incluyendo ADN del CMV, anticuerpos del CMV, recuento de linfocitos T CD4+, carga viral del VIH, etc.).) en 808 pacientes de VIH/SIDA que fueron tratados en nuestro centro de 2017 a 2019 para comprender la coinfección por CMV y las fortalezas y debilidades de varios métodos de detección. Presentamos el siguiente artículo / caso de acuerdo con la lista de verificación de informes MDAR (disponible en http://dx.doi.org/10.21037/apm-20-1352).
Métodos
Sujetos
Se inscribieron un total de 808 pacientes hospitalizados por VIH/SIDA ingresados en nuestro centro entre enero de 2017 y octubre de 2019. Se midieron el ARN del VIH, el recuento de linfocitos T CD4+, el ADN del CMV y los anticuerpos relacionados en cada paciente. El diagnóstico de la infección por el VIH se basó en las Directrices para el Diagnóstico y el Tratamiento del VIH/SIDA (tercera edición) (6), y todos los pacientes fueron confirmados como infectados por el VIH por los Centros Municipales de Control de Enfermedades (CDC) de Fuzhou o los CDC locales que trataron al paciente. El diagnóstico de infección por CMV se basó en los siguientes criterios: (I) ADN-CMV positivo en plasma, líquido de lavado alveolar, orina, líquido cefalorraquídeo (LCR) y / u otros fluidos corporales; (II) inmunoglobulina M (IgM) sérica para CMV positivo; (III) un diagnóstico oftalmológico de retinitis por CMV; (IV) Neumonía por CMV que se manifiesta principalmente como fiebre, tos, flema y opresión en el pecho; ADN de CMV positivo en líquido de lavado alveolar; (V) enteritis o esofagitis por CMV que se manifiesta principalmente como disfagia/dolor al tragar, diarrea o dolor abdominal, y tratamiento diagnóstico eficaz contra el CMV; (VI) encefalitis por CMV que se manifiesta como síntomas del sistema nervioso y ADN de CMV positivo en LCR o tejido cerebral; (VII) hepatitis por CMV que se manifiesta como fiebre, función hepática anormal e incomodidad en el área hepática, y-ADN positivo en biopsia hepática. Se hizo un diagnóstico de infección por CMV si se cumplía alguno de los criterios anteriores, excepto el ítem (II), o si se cumplía el ítem (II) más cualquier otro criterio (7).
Todos los procedimientos realizados en este estudio con participantes humanos se ajustaron a la Declaración de Helsinki (revisada en 2013). El estudio fue aprobado por el comité de ética médica de nuestro centro (aprobación No. KS2019-070-01). Los datos son anónimos, por lo que no se exige el consentimiento informado.
Inclusión y exclusión
Criterios de inclusión: pacientes con VIH / SIDA que visitaron por primera vez el Hospital Hepatobiliar Mengchao de la Universidad Médica de Fujian y completaron la detección de VIH-ARN, ADN-CMV, anticuerpos IgG-CMV, anticuerpos IGM-CMV y linfocitos T CD4+ en un plazo de 14 días. Excluir los casos de VIH / SIDA que no puedan completar los elementos de prueba anteriores debido a un tamaño de muestra insuficiente.
Reactivos y equipos
Cuantificación de VIH-ARN
La reacción en cadena de polimerasa cuantitativa fluorescente en tiempo real (PCR) (FQ-PCR) se realizó en el sistema QPCR Mx3000p (Agilent, EE.UU.) utilizando el kit de cuantificación de VIH-ARN producido por QiaGen (Shenzhen, China).
Recuento de linfocitos T CD4 +
El instrumento utilizado fue el citómetro de flujo FACSCalibur (BD Biosciences, EE. UU.), y el kit de reactivos utilizado fue BD Multitest CD3/CD4/CD8/CD45 (BD Biosciences, EE. UU.).
Cuantificación de ADN-CMV
Se realizó FQ-PCR en el sistema Mx3000p QPCR (Agilent, EE. UU.) para detectar los niveles de ADN-CMV en plasma, orina y LCR. El kit utilizado fue producido por Sansure Biotech (Hunan, China).
Prueba de anticuerpos contra CMV
Se realizó un inmunoanálisis de quimioluminiscencia para detectar anticuerpos anti-CMV-IgG e IgM en el analizador Cobas e601 (Roche Diagnostics, Alemania) con los kits de soporte (Roche Diagnostics, Alemania).
Métodos de estudio
Detección de ácido nucleico
Después de que los pacientes con VIH/SIDA ingresaron en nuestro hospital, se recolectaron 3 mL de muestra de sangre entera anticoagulada con ácido etilendiaminotetraacético (EDTA) en ayunas y luego se centrifugaron a 3,000 r/min durante 5 minutos para recolectar 200 µL de plasma para la detección de VIH-ARN y ADN CMV. En todos los pacientes, se recogieron 5 mL de muestra de orina por la mañana y se mezclaron a fondo, y luego se recogieron 200 µL para la detección de ADN-CMV. Para los pacientes con síntomas neurológicos, se obtuvo 1 ml de LCR para la detección del ADN del CMV. De acuerdo con el límite de detección y el estándar de juicio positivo del kit de ADN-CMV y el kit de ARN-VIH. Las muestras se consideraron positivas si el valor de ADN del CMV estaba por encima de 400 copias/ml, o si el nivel de ARN del VIH estaba por encima de 500 copias/ml.
Detección de subconjuntos de linfocitos T
En los pacientes con VIH/SIDA, se recogieron 3 ml de muestra de sangre entera en ayunas anticoagulada con EDTA al ingreso y luego se mezclaron a fondo para la detección de subconjuntos de linfocitos T en un citómetro de flujo FACSCalibur de BD utilizando los reactivos auxiliares.
Detección de anticuerpos inmunes
En los pacientes con VIH/SIDA, se recolectaron 3 ml de muestra de sangre en ayunas al ingreso, se centrifugaron a 3,000 r / min durante 5 minutos en un tubo sérico con separador de gel y luego se probaron en la máquina.
Todas las pruebas anteriores se llevaron a cabo estrictamente de acuerdo con las instrucciones del reactivo en el manual del fabricante y los procedimientos operativos estándar de los instrumentos.
Análisis estadístico
El análisis estadístico se realizó con el software SPSS 21.0. Los datos de medición distribuidos normalmente se presentan utilizando la media ± desviación estándar ( x ±DE ), y los datos no distribuidos normalmente se expresan como mediana (percentiles 25-75). Los datos de recuento se expresan en porcentajes y tasas. La comparación de los datos de medición no distribuidos normalmente entre dos grupos se realizó mediante una prueba de suma de rangos no paramétrica, mientras que los datos de recuento se compararon mediante la prueba de Chi cuadrado. Un valor de P <0,05 fue considerado estadísticamente significativo.
Resultados
Datos generales
Los datos generales de 808 pacientes con VIH/SIDA se resumen en la Tabla 1. El sexo y la edad no mostraron diferencia significativa entre el grupo de CMV y el grupo de no CMV. El recuento absoluto de CD4 en el grupo infectado por CMV fue significativamente menor que en el grupo no infectado por CMV (Z=-8,87, P<0,001), y el nivel de ARN del VIH fue significativamente mayor en el grupo infectado por CMV que en el grupo no infectado por CMV (Z=-3,207, P<0,05) (Tabla 1).
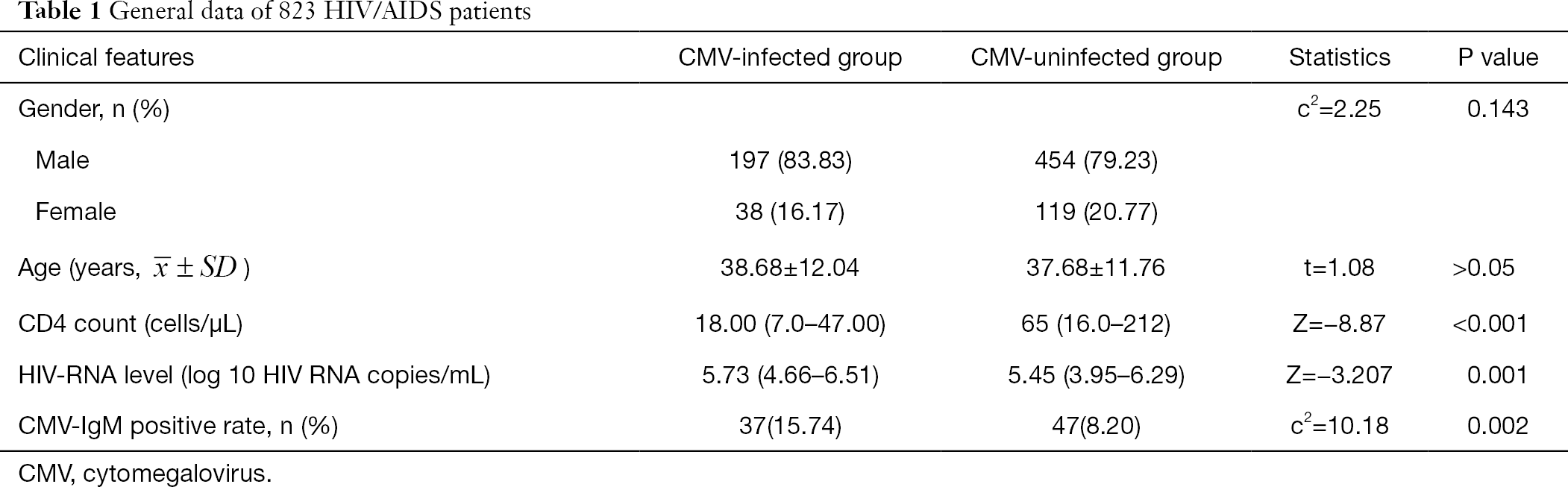
Tabla completa
Tasas positivas de ADN-CMV, IGG-CMV e IgM-CMV
La tasa global positiva de ADN-CMV fue del 29,08% (235/808); concretamente, fue del 5,70% (13/228) en LCR, del 26,01% (77/296) en plasma y del 25,75% (180/699) en orina. La tasa positiva de CMV-IgG fue del 99,8% (806/808), y la tasa positiva de CMV-IgM fue del 10,40% (84/808).
Correlación entre la infección por CMV y el recuento de linfocitos T CD4+
Después de agrupar el recuento de linfocitos T CD4+, encontramos que la proporción de pacientes infectados por citomegalovirus con baja frecuencia de linfocitos T CD4+ fue mayor que la de pacientes no infectados por CMV. La incidencia de infección por CMV aumentó con la disminución del recuento de CD4 (Tabla 2).
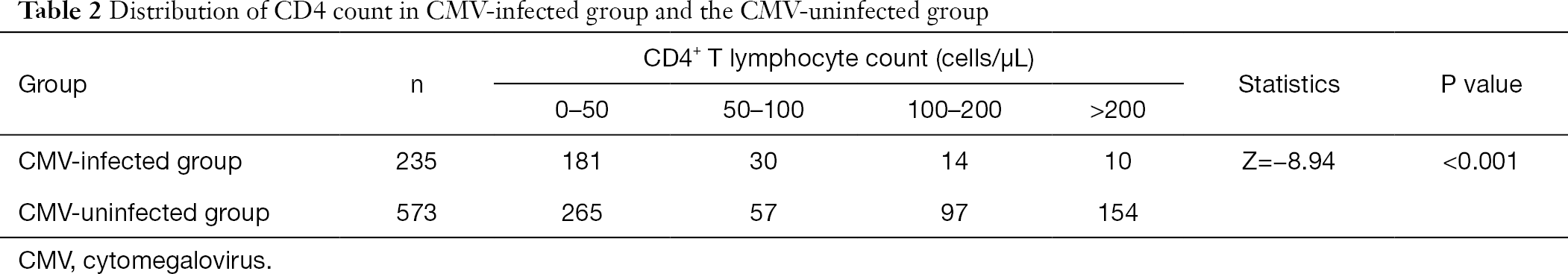
Tabla completa
Detección de ADN-CMV en diferentes muestras
De estos 808 pacientes, 198 pacientes también recibieron pruebas de ADN-CMV en plasma y orina y anti plasma-Anticuerpos CMV-IgG y CMV-IgM. Al utilizar el análisis de Chi-cuadrado para datos emparejados, realizamos comparaciones por pares de ADN de CMV en orina y ADN de CMV en plasma con anticuerpos IGM de CMV en plasma, respectivamente. Se encontró que los resultados de la detección de ADN-CMV en orina y plasma diferían significativamente de los del ensayo de anticuerpos IGG-CMV en plasma (P< 0,001), mientras que el resultado de la detección de ADN-CMV en plasma no fue significativamente diferente del de la detección de ADN-CMV en orina (P>0,05) (Tablas 3,4).

Tabla completa
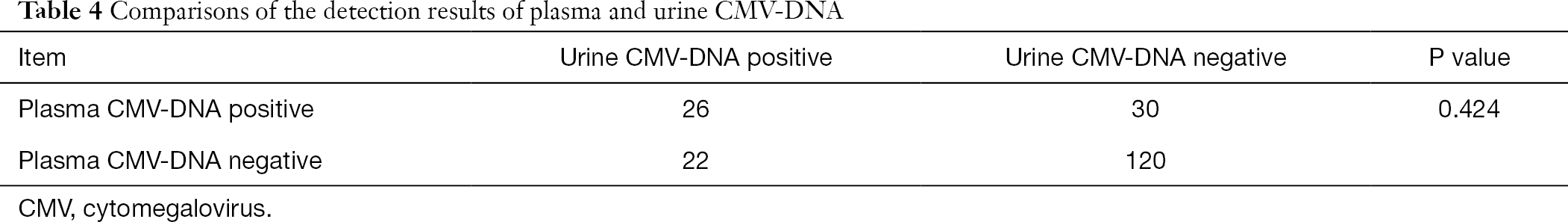
Tabla completa
Discusión
El CMV es un miembro del grupo del virus del herpes β y se caracteriza por su estricta especificidad de especie y su incidencia generalizada en poblaciones humanas. La seroprevalencia del CMV es de aproximadamente 85% en niños y hasta 95% en adultos. En nuestro estudio actual, la tasa positiva de CMV-IgG alcanzó el 99,8%. El CMV está latente en la mayoría de los casos, pero en individuos inmunocomprometidos, el virus se replica exponencialmente y se disemina por todo el cuerpo con la sangre, causando viremia por CMV e incluso enfermedad orgánica por CMV (8). La infección por CMV es una de las infecciones oportunistas más comunes en pacientes con VIH/SIDA. Los linfocitos T CD4 + son las células diana del virus del VIH, y sus recuentos a menudo pueden reflejar el curso del SIDA y también pueden usarse como indicador para evaluar el estado inmunitario de los pacientes con SIDA. Este estudio analizó la infección por CMV, el recuento de CD4 y el nivel de ARN-VIH en 808 pacientes con VIH/SIDA. Encontramos que la tasa positiva de CMV en pacientes con SIDA aumentó con la disminución del recuento de CD4 y con el aumento de la carga viral del VIH. También en nuestro estudio actual, hasta el 77,02% de los pacientes con CMV positivo tenían un recuento de CD4 de < 50 células / µL, lo que sugiere que CD4 <50 células/µL es un factor de riesgo para la coinfección VIH-CMV, lo que es consistente con el hallazgo de Deng et al. (9). El nivel cuantitativo de ARN-VIH en el grupo infectado por CMV fue más alto que en el grupo no infectado por CMV, lo que indirectamente sugirió que los altos niveles de carga viral de ARN-VIH eran otro factor de riesgo de infección por CMV en pacientes con VIH/SIDA .Por lo tanto, se recomienda que los pacientes con VIH/SIDA inicien el tratamiento antirretroviral lo antes posible para promover la reconstitución inmunitaria y prevenir infecciones oportunistas, y la detección del VHC es esencial para los pacientes con VIH/SIDA con un recuento de CD4 <50 células/µL (2).
También evaluamos los valores de los ensayos de ácido nucleico viral y los métodos inmunológicos en la detección clínica de la infección por CMV. Estudios realizados en China e internacionalmente han demostrado que el ADN del CMV aparece antes que los síntomas clínicos y las reacciones serológicas de las infecciones por CMV. La PCR FQ es actualmente el método de cuantificación microbiana más preciso y rápido y es capaz de superar algunos problemas de la PCR tradicional (por ejemplo, contaminación del producto de amplificación y no cuantificación) (10). En nuestro estudio actual, la tasa positiva de ADN-CMV fue de 5.70% (13/228) en las muestras de LCR de 228 pacientes con síntomas neurológicos, que fue muy inferior a la de las muestras de plasma y orina, lo que podría explicarse por la barrera hematoencefálica y la susceptibilidad a los órganos. El anticuerpo anti-CMV-IgM se usa a menudo como marcador de infección viral activa; sin embargo, la tasa positiva del anticuerpo anti-CMV-IgM fue solo del 10,40% (84/808) en nuestros pacientes con VIH/SIDA, que fue menor que la tasa positiva de infección por CMV reportada en las poblaciones sin VIH/SIDA (11). Además, su tasa positiva no coincidía con los resultados de la detección de ácido nucleico, lo que podría deberse al debilitamiento del sistema inmunitario o a la generación tardía de anticuerpos IgM en pacientes con VIH/SIDA. Por lo tanto, la detección de anticuerpos contra el CMV-IgM tiene una función limitada en los exámenes de detección del VHC en pacientes con VIH/SIDA. Además, la tasa positiva de infección por CMV en 808 pacientes fue del 29,05% (235/808) en nuestro estudio actual, que es ligeramente superior al 21,85% reportado por Li et al., y puede deberse a la mayor variedad de muestras (incluyendo plasma, orina y LCR) recogidas en este estudio (12). La tasa positiva de ADN-CMV fue de 25,57% en orina y de 26,01% en plasma, la diferencia no fue estadísticamente significativa. Por lo tanto, recomendamos que se realice un cribado de ADN-CMV en plasma y orina cuando el recuento de linfocitos T CD4+ sea inferior a 200 células/µL, especialmente cuando <50 células/µL; además, se requiere la detección de ADN-CMV en el LCR si se presentan síntomas neurológicos obvios.
Conclusiones
En conclusión, el bajo recuento de linfocitos T CD4+ y la alta carga viral del VIH-1 son factores de riesgo para la infección por CMV en pacientes con VIH/SIDA. La detección de ADN del CMV en orina o plasma mediante PCR FQ es muy valiosa para detectar la infección por CMV en pacientes con VIH/SIDA, mientras que la detección de los niveles de IgG y IgM del CMV en sangre tiene un valor clínico limitado. Se recomienda la detección de ADN por CMV en sangre u orina para los pacientes con SIDA a fin de prevenir y diagnosticar la infección por CMV en forma temprana y mejorar su calidad de vida.
Agradecimientos
Financiación: Patrocinado por el Programa de Construcción de Disciplinas de Especialidad Clínica Clave de Fujian, P. R. C.
Nota al pie
Lista de verificación de informes: Los autores completaron la lista de verificación de informes MDAR. Disponible en http://dx.doi.org/10.21037/apm-20-1352
Declaración de intercambio de datos: Disponible en http://dx.doi.org/10.21037/apm-20-1352
Conflictos de intereses: Todos los autores han completado el formulario de divulgación uniforme del ICMJE (disponible en http://dx.doi.org/10.21037/apm-20-1352). Los autores no tienen conflictos de intereses que declarar.
Declaración ética: Los autores son responsables de todos los aspectos del trabajo para garantizar que las preguntas relacionadas con la exactitud o integridad de cualquier parte del trabajo se investiguen y resuelvan adecuadamente. Todos los procedimientos realizados en este estudio con participantes humanos se ajustaron a la Declaración de Helsinki (revisada en 2013). El estudio fue aprobado por el comité de ética médica de nuestro centro (aprobación No. KS2019-070-01). Los datos son anónimos, por lo que no se exige el consentimiento informado.
Declaración de Acceso abierto: Este es un artículo de Acceso abierto distribuido de acuerdo con la Licencia Internacional Creative Commons Atribución-NoComercial-SinDerivadas 4.0 (CC BY-NC-ND 4.0), que permite la reproducción y distribución no comercial del artículo con la condición estricta de que no se realicen cambios o ediciones y que el trabajo original se cite correctamente (incluidos los enlaces a la publicación formal a través del DOI correspondiente y la licencia). Véase: https://creativecommons.org/licenses/by-nc-nd/4.0/.
- Yu X, Tong M, He G. Efectos de la infección por citomegalovirus en las células inmunitarias reguladoras en mujeres embarazadas chinas. Revista de Nosocomiología. 2017;27:2103-6.
- El Grupo de Investigación de infecciones oportunistas del SIDA del Gran Proyecto Nacional de Ciencia y Tecnología durante el 13º Plan Quinquenal. Consenso de expertos sobre el diagnóstico clínico y el tratamiento del SIDA complicado con enfermedad por citomegalovirus . Journal of Southwest University (Edición de Ciencias Naturales): 1-17 .
- Hodowanec AC, Pikis A, Komatsu TE, et al. Tratamiento y Prevención de la Enfermedad por CMV en Receptores de Trasplantes: Conocimientos Actuales y Perspectivas Futuras. J Clin Pharmacol 2019; 59: 784-98.
- Mizushima D, Nishijima T, Yashiro S, et al. Utilidad diagnóstica de la PCR cuantitativa de ADN de citomegalovirus plasmático para enfermedades de órganos terminales de citomegalovirus en pacientes con infección por VIH-1. J Acquir Immune Defic Syndr 2015; 68:140-6.
- Michaelides A, Liolios L, Glare EM, et al. El aumento de la carga de ADN por citomegalovirus humano (VHC) en leucocitos de sangre periférica después de un trasplante de pulmón se correlaciona con neumonitis por VHC. Transplantation 2001; 72: 141-7.
- La infección de neurología, grupo de SIDA de la asociación médica china. Directrices para el diagnóstico y el tratamiento del VIH/SIDA (tercera edición). Chinese Journal of Infectious Diseases 2015; (10): 577-93.
- Corrales I, Giménez E, Solano C, et al. Incidencia y dinámica de la infección activa por citomegalovirus en pacientes con trasplante de células madre alogénicas de acuerdo con los polimorfismos de nucleótido único en los genes CCR5, MCP-1, IL-10 y TLR9 de donantes y receptores. J Med Virol 2015; 87: 248-55.
- Tagarro A, Del Valle R, Domínguez-Rodríguez S, et al. Patrones de Crecimiento en Niños Con Infección Congénita Por Citomegalovirus. Pediatr Infect Dis J 2019; 38: 1230-5.
- Deng X, Liu J, Zhang M, et al. Análisis de las características virológicas e inmunológicas del VIH/SIDA combinado con infección por citomegalovirus. Chinese Journal of Hospital Infection 2019;29: 2241-6.
- Kawano Y, Kawada J, Kamya Y, et al. Análisis de pacientes con sin de microRNA circulante humano y viral con infección congénita por citomegalovirus. J Perinatol 2016;36: 1101-5.
- Li L, Gao S, Zhang T, et al. Comparación de la detección de ADN y la detección de IgM de infección por citomegalovirus humano y discusión de su valor de aplicación combinado. Chinese Journal of Experimental Diagnostics 2015; (1): 78-80.
- Li X, Cao L, Yu C, et al. Estudio sobre la infección por citomegalovirus en pacientes con SIDA. Medicina Preventiva Moderna 2012;39:2278-9.
(Editor en inglés: J. Gray)