Reordenamiento de Claisen
El reordenamiento de Claisen (que no debe confundirse con la condensación de Claisen) es una poderosa reacción química que forma enlaces carbono–carbono descubierta por Rainer Ludwig Claisen en 1912. El calentamiento de un éter alilvinílico iniciará un reordenamiento sigmatrópico para dar un carbonilo no saturado γ,δ.
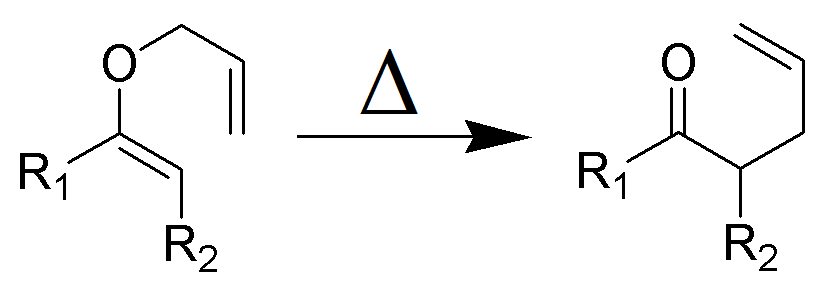
Figura 1: Wikimedia (Trabajo propio) – reordenamiento sigmatrópico.
El reordenamiento de Claisen es una reacción pericíclica exotérmica concertada (escisión de enlace y recombinación). Las reglas de Woodward-Hoffmann muestran una vía de reacción suprafacial estereoespecífica. La cinética es de primer orden y toda la transformación procede a través de un estado de transición cíclica altamente ordenado y es intramolecular. Los experimentos de cruce eliminan la posibilidad de que el reordenamiento ocurra a través de un mecanismo de reacción intermolecular y son consistentes con un proceso intramolecular.
Se observan efectos considerables de los disolventes en el reordenamiento de Claisen, donde los disolventes polares tienden a acelerar la reacción en mayor medida. Los disolventes de enlace de hidrógeno dieron las constantes de mayor velocidad. Por ejemplo, las mezclas de solventes etanol/agua dan constantes de velocidad 10 veces más altas que el sulfolano. Se ha demostrado que los reactivos trivalentes de organoaluminio, como el trimetilaluminio, aceleran esta reacción.
El primer reordenamiento de Claisen reportado es el reordenamiento sigmatrópico de un éter de alilfenilo a intermedio 1, que se tautomeriza rápidamente a un fenol orto-sustituido.
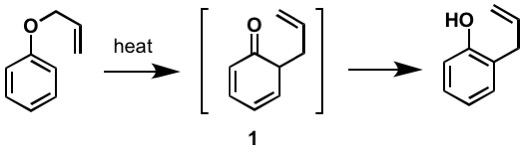
Figura 2: Por Kchemyoung (Obra propia) , a través de Wikimedia Commons
Reordenamiento Irlanda-Claisen
El reordenamiento Irlanda–Claisen es la reacción de un carboxilato alílico con una base fuerte (como diisopropilamida de litio)para dar un ácido carboxílico no saturado γ,δ. El reordenamiento procede a través del acetal de sililceteno, que se forma atrapando el enolato de litio con clorotrimetilsilano. Al igual que el Bellus-Claisen (arriba), el reordenamiento Irlanda-Claisen puede tener lugar a temperatura ambiente y superior. Los acetales de sililceteno configurados E y Z conducen a productos reordenados anti y syn, respectivamente. Hay numerosos ejemplos de reordenamientos enantioselectivos de Irlanda-Claisen encontrados en la literatura para incluir reactivos quirales de boro y el uso de auxiliares quirales.
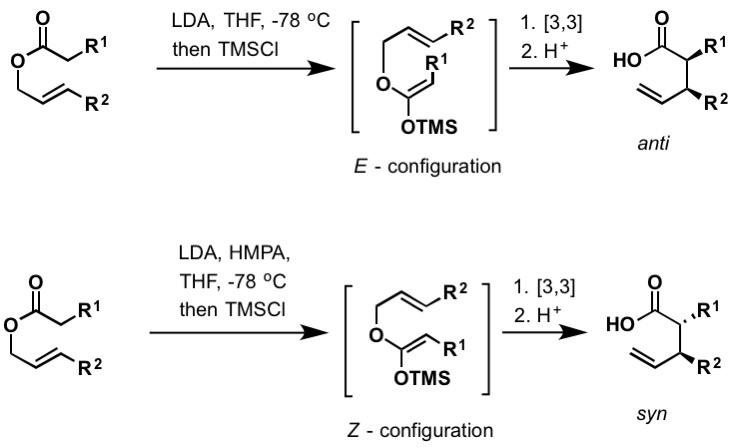
Figura 5: Imagen usada con permiso (CC BY-SA 4.0; Kchemyoung)
Reordenamiento de Johnson-Claisen
El reordenamiento de Johnson–Claisen es la reacción de un alcohol alílico con un ortoéster para producir un éster γ, δ insaturado. Los ácidos débiles, como el ácido propiónico, se han utilizado para catalizar esta reacción. Esta reorganización a menudo requiere altas temperaturas (100 a 200 °C) y puede tardar entre 10 y 120 horas en completarse. Sin embargo, el calentamiento asistido por microondas en presencia de arcilla KSF o ácido propiónico ha demostrado aumentos dramáticos en la velocidad de reacción y los rendimientos.
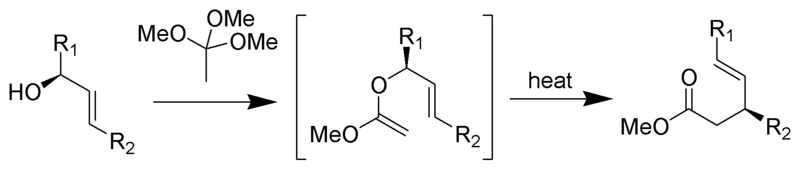
Mecanismo de:
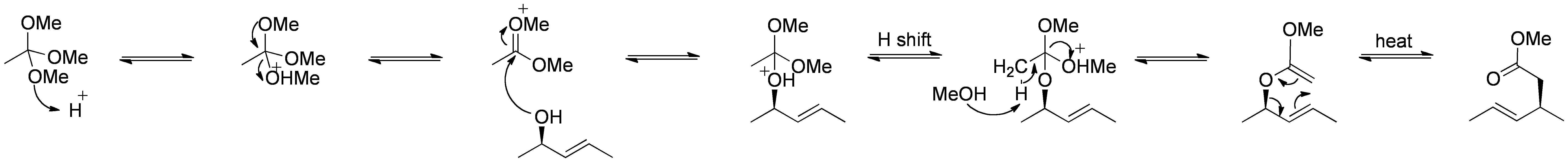
Creado por RAN 10 ( – ), a través de Wikimedia Commons
Reordenamiento de Foto-Claisen
El reordenamiento de foto-Claisen está estrechamente relacionado con el reordenamiento de foto-Fries, que procede a través de un mecanismo radical similar. Los éteres de arilo se someten al reordenamiento de foto-Claisen, mientras que el reordenamiento de foto-Fries utiliza ésteres de arilo.
Hetero-Claisens
Aza-Claisen
Un iminio puede servir como una de las mitades unidas por pi en el reordenamiento.
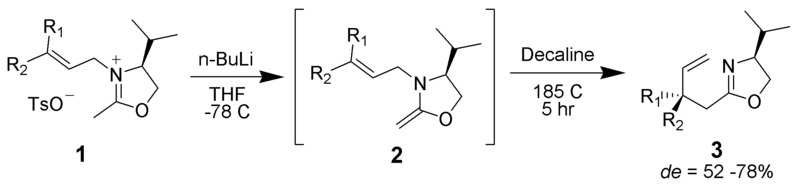
Por ningún autor legible por máquina proporcionado. ~K asumido (basado en reclamos de derechos de autor). , a través de Wikimedia Commons
Oxidación de cromo
El cromo puede oxidar alcoholes alílicos a cetonas insaturadas alfa-beta en el lado opuesto del enlace insaturado del alcohol. Esto es a través de una reacción hetero-Claisen concertada, aunque hay diferencias mecanicistas ya que el átomo de cromo tiene acceso a orbitales d – shell que permiten la reacción bajo un conjunto menos restringido de geometrías.
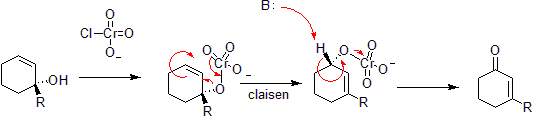
Por el cargador original fue Takometer en Wikipedia en inglés – Reordenamiento de fosforimidato o Reacción de Staudinger-Claisen instala un fosfito en lugar de un alcohol y aprovecha la reducción de Staudinger para convertir esto en una imina. El Claisen posterior es impulsado por el hecho de que un doble enlace P=O es más energéticamente favorable que un doble enlace P=N.
.png?revision=1&size=bestfit&width=660&height=112)
Por Howcheng en el baño.wikipedia, a través de Wikimedia Commons
Reordenamiento de Overman
El reordenamiento de Overman (llamado así por Larry Overman) es un reordenamiento Claisen de tricloroacetimidos alílicos a tricloroacetamidas alílicas.
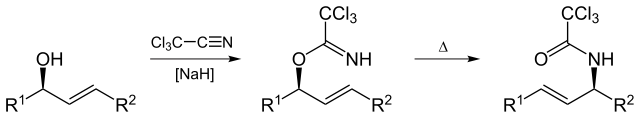
Por Yikrazuul (Trabajo propio) , a través de Wikimedia Commons
El reordenamiento de Overman es aplicable a la síntesis de vicinol diamino comp a partir de 1,2 diol alílico vecinal.
Reordenamiento de Claisen Zwitterionic
A diferencia de los reordenamientos típicos de Claisen que requieren calentamiento, los reordenamientos de Claisen zwitterionic tienen lugar a o por debajo de la temperatura ambiente. Los iones de acil amonio son altamente selectivos para Z-enolatos en condiciones suaves
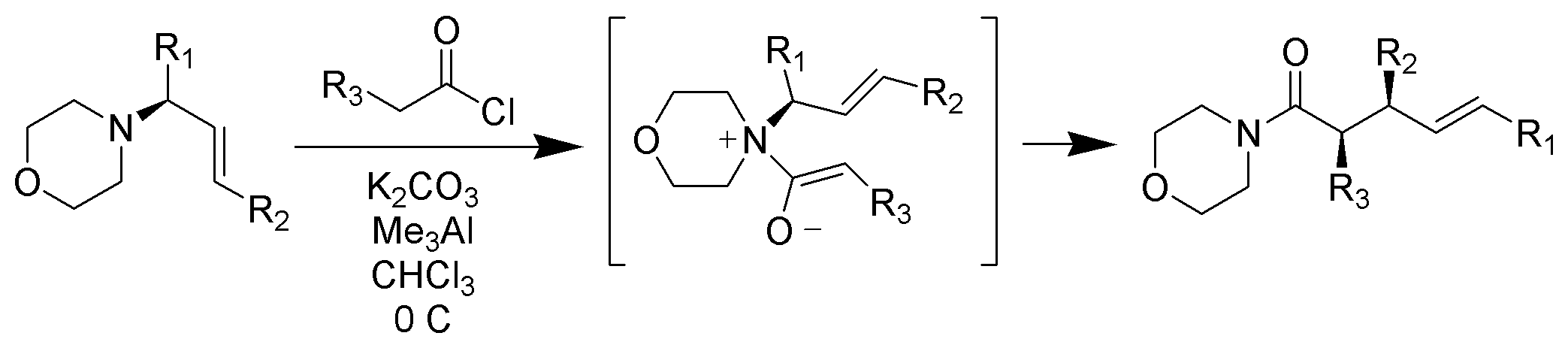
https://upload.wikimedia.org/wikiped…ent_Scheme.png
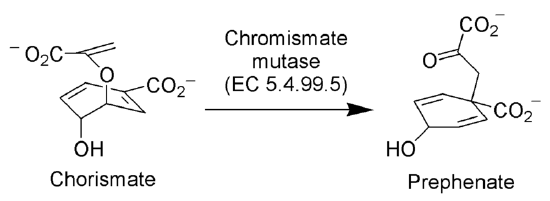
Reorganización de Claisen en la naturaleza
La enzima Corismato mutasa (EC 5.4.99.5) cataliza el reordenamiento Claisen del ion corismato al ion prefenato, un intermediario clave en la vía del ácido shikímico (la vía biosintética hacia la síntesis de fenilalanina y tirosina).
Por ningún autor legible por máquina proporcionado. ~K asumido (basado en reclamos de derechos de autor). , a través de Wikimedia Commons