12.4: haihtuminen ja tiivistyminen
haihtuminen
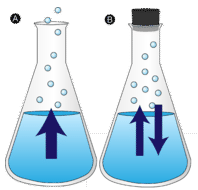
lopulta katoaa lätäkkö vettä, joka on jätetty koskemattomaksi. Nestemolekyylit karkaavat kaasufaasiin muuttuen vesihöyryksi. Höyrystyminen on prosessi, jossa neste muutetaan kaasuksi. Haihtuminen on nesteen muuttumista höyryksi alle nesteen kiehumislämpötilan. Jos vettä sen sijaan säilytetään suljetussa astiassa, vesihöyrymolekyyleillä ei ole mahdollisuutta karata ympäristöön, eikä vedenkorkeus siten muutu. Kun osa vesimolekyyleistä muuttuu höyryksi, yhtä monta vesihöyrymolekyyliä tiivistyy takaisin nestemäiseen tilaan. Tiivistyminen on olomuodon muutosta kaasusta nesteeksi.
jotta nestemäinen molekyyli pääsisi kaasutilaan, molekyylillä täytyy olla riittävästi liike-energiaa voittaakseen nesteessä olevat molekyylien väliset vetovoimat. Muista, että tietyssä nestemäisessä näytteessä on molekyylejä, joilla on laaja valikoima kineettisiä energioita. Nestemolekyylit, joilla on tämä tietty raja-kineettinen energia, karkaavat pinnalta ja muuttuvat höyryksi. Tämän seurauksena jäljellä olevilla nestemolekyyleillä on pienempi liike-energia. Haihtuessa jäljelle jäävän nesteen lämpötila laskee. Olette havainneet haihtumisjäähdytyksen vaikutukset. Kuumana päivänä hikoilusi vesimolekyylit imevät itseensä kehon lämpöä ja haihtuvat ihon pinnalta. Haihtuminen jättää jäljelle jäävän hikoilun jäähdytin, joka puolestaan imee enemmän lämpöä kehosta.
tietty neste haihtuu nopeammin kuumennettaessa. Tämä johtuu siitä, että kuumennusprosessi johtaa siihen, että suuremmalla osalla nesteen molekyyleistä on tarvittava liike-energia nesteen pinnalta poistumiseen. Alla olevassa kuvassa on esitetty nestemolekyylien liike-energian jakautuminen kahdessa lämpötilassa. Niiden molekyylien lukumäärä, joilla on haihtumiseen tarvittava liike-energia, esitetään oikealla käyrän alla olevalla varjostetulla alueella. Korkeamman lämpötilan nesteellä \(\left (t_2 \right)\) on enemmän molekyylejä, jotka kykenevät pakenemaan höyryfaasiin kuin alemman lämpötilan nesteellä \(\left( T_1 \right)\).
29 029 jalan korkeudessa \(\left( 8848 \: \text{m} \right)\) Mount Everest Himalajan vuoristossa Kiinan ja Nepalin rajalla on maapallon korkein kohta. Sen korkeus aiheuttaa kiipeilijöille monia käytännön ongelmia. Ilman happipitoisuus on paljon alhaisempi kuin merenpinnan tasolla, minkä vuoksi mukaan on tarpeen tuoda happisäiliöitä (tosin muutama kiipeilijä on saavuttanut huipun ilman happea). Toinen ongelma on ruoan keittämiseen tarkoitetun veden kiehuminen. Vaikka vesi kiehuu merenpinnan tasolla \(100^ \ text{o} \text{C}\), kiehumispiste Mount Everestin huipulla on vain noin \(70^\text{o} \text{C}\). Tämä ero tekee siitä erittäin vaikeaa saada kunnon kuppi teetä (mikä varmasti turhautti joitakin British kiipeilijät).