17.3: kompleksi-ionien muodostuminen
kompleksi-ionien muodostumisen vaikutus liukoisuuteen
mitä tapahtuu niukasti liukoisen suolan liukoisuudelle, jos liuokseen lisätään stabiilin kompleksi-ionin muodostava ligandi? Yksi tällainen esimerkki esiintyy tavanomaisessa mustavalkokuvauksessa. On muistettava, että mustavalkoinen valokuvausfilmi sisältää valoherkkiä agbr: n mikrokiteitä tai AgBr: n ja muiden hopeahalidien seoksia. AgBr on niukkaliukoinen suola, jonka Ksp on 25°C: n lämpötilassa 5,35 × 10-13. Kun kameran suljin aukeaa, kuvattavan kohteen valo osuu osaan filmin kiteistä ja käynnistää valokemiallisen reaktion, joka muuttaa AgBr: n mustaksi Ag-metalliksi. Hyvin muodostuneet, vakaat negatiiviset kuvat näkyvät harmaan sävyinä, jotka vastaavat agbr: n muunnettujen jyvien määrää siten, että kaikkein vaaleimmille altistuneet alueet ovat tummimpia. Jotta kuva saataisiin korjattua ja agbr-kiteitä ei muutettaisi AG-metalliksi filmin käsittelyn aikana, kalvon reagoimaton AgBr poistetaan kompleksointireaktiolla, jolloin niukasti liukeneva suola liukenee.
hopeabromidin liukenemisreaktio on seuraava:
\
kanssa
\
tasapaino on kaukana vasemmalla, ja AG+− ja Br-ionien tasapainopitoisuudet ovat hyvin pienet (7,31 × 10-7 M). Tämän seurauksena reagoimattoman AgBr: n poistaminen edes yhdeltä filmirullalta puhdasta vettä käyttäen vaatisi kymmeniä tuhansia litroja vettä ja paljon aikaa. Le Chatelierin periaate kuitenkin kertoo, että voimme ajaa reaktion oikealle poistamalla yhden tuotteista, jolloin agbr hajoaa enemmän. Bromidi-ionia on vaikea poistaa kemiallisesti, mutta hopeaioni muodostaa erilaisia stabiileja kaksikoordinaattikomplekseja neutraalien ligandien, kuten ammoniakin, tai anionisten ligandien, kuten syanidin tai tiosulfaatin (S2O32 -) kanssa. Valokuvauskäsittelyssä ylimääräinen AgBr liuotetaan väkevällä natriumtiosulfaattiliuoksella.
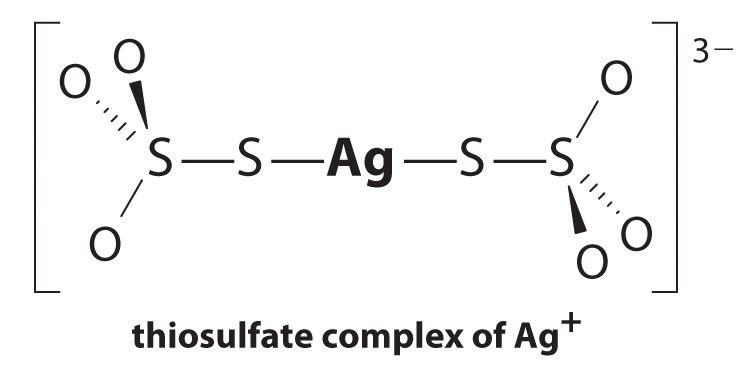
AG+: n reaktio tiosulfaatin kanssa on seuraava:
\^{3−}_{(aq)} \label{17.3.5a}\]
kanssa
\
tasapainovakion suuruus osoittaa, että lähes kaikki liuoksen Ag+−ionit kompleksoituvat välittömästi tiosulfaatin vaikutuksesta muodostaen 3 -. Voimme nähdä tiosulfaatin vaikutuksen AgBr: n liukoisuuteen kirjoittamalla sopivat reaktiot ja laskemalla ne yhteen:
\\ \mathrm{AG^ + (aq)} + \mathrm{2s_2o_3^{2-}(aq)}\rightleftharpoons\mathrm{^{3-}(aq)}\hspace{3mm}K_\textrm F&=2.9\aikaa10^{13}
\\ \mathrm{AgBr(s)}+\mathrm{2S_2O_3^{2-}(aq)}\rightleftharpoons\mathrm{^{3-}(aq)}+\mathrm{Br^-(aq)}\hspace{3mm}K&=K_{\textrm{sp}}K_{\textrm F} = 15\end{align} \label{17.3.6}\)
K: n vertaaminen Ksp: hen osoittaa, että kompleksi-ionin muodostuminen lisää AgBr: n liukoisuutta noin 3 × 1013: lla. Liukoisuuden dramaattinen kasvu yhdistettynä alhaisiin kustannuksiin ja alhaiseen myrkyllisyyteen selittää, miksi natriumtiosulfaattia käytetään lähes yleisesti mustavalkofilmin kehittämiseen. Haluttaessa hopea voidaan ottaa talteen tiosulfaattiliuoksesta millä tahansa eri menetelmällä ja kierrättää.
jos kompleksi-ionilla on suuri Kf, kompleksi-ionin muodostuminen voi lisätä dramaattisesti niukasti liukoisten suolojen liukoisuutta.
esimerkki \(\PageIndex{2}\)
yleisen ioniefektin vuoksi voisimme olettaa, että AgCl: n kaltainen suola liukenee paljon huonommin KCL: n väkevään liuokseen kuin veteen. Tällainen oletus olisi kuitenkin virheellinen, koska siinä ei oteta huomioon sitä, että hopeaionilla on taipumus muodostaa kloridi-ionien kanssa kaksikoordinaattikompleksi (AgCl2−). Lasketaan AgCl: n liukoisuus kussakin tilanteessa:
- puhtaassa vedessä
- 1,0 M KCl-liuoksessa jättäen huomiotta minkä tahansa kompleksi-ionin muodostuminen
- sama liuos kuin osassa b lukuun ottamatta kompleksi-ionien muodostumista olettaen, että AgCl2-on ainoa AG+ – kompleksi, joka muodostuu merkittävinä pitoisuuksina
25°C: ssa, Ksp = 1, 77 × 10-10 AgCl: lle ja Kf = 1.1 × 105 agcl2−.
annettu: AgCl: n Ksp, AgCl2−: n KF ja KCL: n pitoisuus
pyydetty: AgCl: n liukoisuus veteen ja KCL-liuokseen sekä kompleksiioneja muodostamatta että muodostamatta
strategia:
- merkitään AgCl: n liukoisuustuotteen lauseke ja lasketaan AG+: n ja CL− konsentraatiot vedessä.
- lasketaan Ag+: n pitoisuus KCL-liuoksessa.
- Kirjoita tasapainotetut kemialliset yhtälöt AgCl: n hajoamiseen ja AgCl2− kompleksin muodostumiseen. Lisätään kaksi yhtälöä ja lasketaan tasapainovakio kokonaistasapainolle.
- Kirjoita tasapainovakion lauseke kokonaisreaktiolle. Ratkaise kompleksi-ionin konsentraatiolle.
liuos
- A Jos annamme x: n olla yhtä suuri kuin AgCl: n liukoisuus, niin tasapainotilassa = = x M. korvaamalla tämä arvo liukoisuustuotteen lausekkeessa,
siten AgCl: n liukoisuus puhtaaseen veteen 25°C: n lämpötilassa on 1,33 × 10-5 M.
- B Jos x on yhtä suuri kuin AgCl: n liukoisuus KCL-liuoksessa, tasapainotilassa = x M ja = (1, 0 + x) M. korvaamalla nämä arvot liukoisuustuotteen lausekkeessa ja olettaen, että x << 1.0,
jos yhteinen ioniefekti olisi ainoa tärkeä tekijä, ennustaisimme, että AgCl on noin viisi suuruusluokkaa vähemmän liukoinen 1,0 M KCl-liuokseen kuin veteen.
- C selittääksemme kompleksi-ionien muodostumisen vaikutukset meidän on ensin kirjoitettava tasapainoyhtälöt sekä kompleksi-ionien liukenemiselle että muodostumiselle. Kun lisätään Ksp: tä ja Kf: ää vastaavat yhtälöt, saadaan yhtälö, joka kuvaa AgCl: n hajoamista KCL-ratkaisussa. Reaktion tasapainovakio on siis Ksp: n ja Kf: n tulo:
\\ \mathrm{AG^+(aq)} + \mathrm{2Cl^{-}}\rightleftharpoon\mathrm{^{-}}\hspace{3mm}K_\textrm F& = 1.1\times10^{5}
\\ \mathrm{AgCl(s)}+\mathrm{Cl^{-}}\rightleftharpoons\mathrm{^{-}}\hspace{3mm}K&=K_{\textrm{sp}}K_{\textrm f} = 1.9\times10^{-5}\end{align}\)
D Jos annamme x: n olla yhtä suuri kuin AgCl: n liukoisuus KCL-liuoksessa, niin tasapainotilassa = x ja = 1.0-x. korvaamalla nämä suureet nettoreaktion tasapainovakion lausekkeeseen ja olettaen, että x << 1.0,
eli AgCl liukenee 1,0 M KCl: ään muodostaen 1,9 × 10-5 M agcl2− kompleksi-ionin liuoksen. Täten ennustamme, että AgCl: n liukoisuus 1,0 M KCl-liuoksessa on suunnilleen sama kuin puhtaassa vedessä, mikä on 105 kertaa suurempi kuin yhteisen ioniefektin perusteella ennustettu. (Itse asiassa AgCl: n mitattu liukoisuus 1,0 M KCl: ssä on lähes kerroin 10 suurempi kuin puhtaassa vedessä, mikä johtuu suurelta osin muiden kloridia sisältävien kompleksien muodostumisesta.)
harjoitus \(\PageIndex{2}\)
lasketaan elohopea(II) jodidin (hgi2) liukoisuus kussakin tilanteessa:
- puhdas vesi
- NaI: n 3,0 M: n liuos, olettaen, että 2− on ainoa Hg: tä sisältävä laji, jossa esiintyy merkittäviä määriä
Ksp = 2,9 × 10-29 HgI2: lle ja Kf = 6,8 × 1029 2 -: lle.
Vastaus
- 1.9 × 10-10 M
- 1.4 M
kompleksinmuodostajat, molekyylit tai ionit, jotka lisäävät metallisuolojen liukoisuutta muodostamalla liukoisia metallikomplekseja, ovat yleisiä pyykinpesuaineiden komponentteja. Pitkäketjuiset karboksyylihapot, saippuoiden pääkomponentit, muodostavat liukenemattomia suoloja Ca2+: n ja Mg2+: n kanssa, joita esiintyy suurina pitoisuuksina “kovassa” vedessä. Näiden suolojen saostuminen tuottaa kylpyammeen renkaan ja antaa harmaan sävyn vaatteille. Kompleksinmuodostajan, kuten pyrofosfaatin (O3POPO34−, tai p2o74−) tai trifosfaatin (p3o105−), lisääminen pesuaineisiin estää magnesium-ja kalsiumsuolojen saostumista, koska kompleksi-ionien muodostumisen tasapainovakio on suuri:
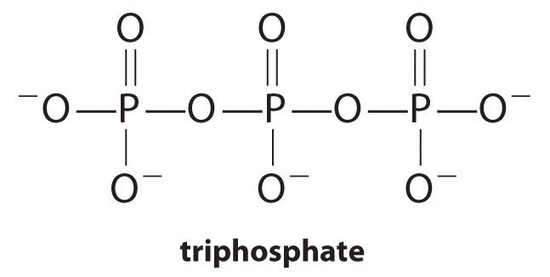
kanssa
fosfaatit voivat kuitenkin aiheuttaa ympäristöhaittoja edistämällä rehevöitymistä, ylenmääräisten levämäärien kasvua vesistössä, mikä voi lopulta johtaa suuriin liuenneen hapen pitoisuuksien laskuihin, jotka tappavat kaloja ja muita vesieliöitä. Tämän vuoksi monet Yhdysvaltain osavaltiot ovat kieltäneet fosfaattia sisältävien pesuaineiden käytön, ja Ranska on kieltänyt niiden käytön vuodesta 2007 alkaen. “Fosfaatittomat” pesuaineet sisältävät erilaisia kompleksinmuodostusaineita, kuten etikkahapon tai muiden karboksyylihappojen johdannaisia. Fosfaatin korvaavien aineiden kehittäminen on intensiivisen tutkimuksen alue.
kaupallisissa veden pehmentimissä käytetään myös kompleksinmuodostusainetta kovan veden käsittelyyn johtamalla vesi ioninvaihtohartsien päälle, jotka ovat monimutkaisia natriumsuoloja. Kun vesi virtaa hartsin päälle, natriumioni liukenee ja liukenemattomat suolat saostuvat hartsin pinnalle. Tällä tavoin käsitellyllä vedellä on suolaisempi maku Na+: n läsnäolon vuoksi, mutta se sisältää vähemmän liuenneita mineraaleja.
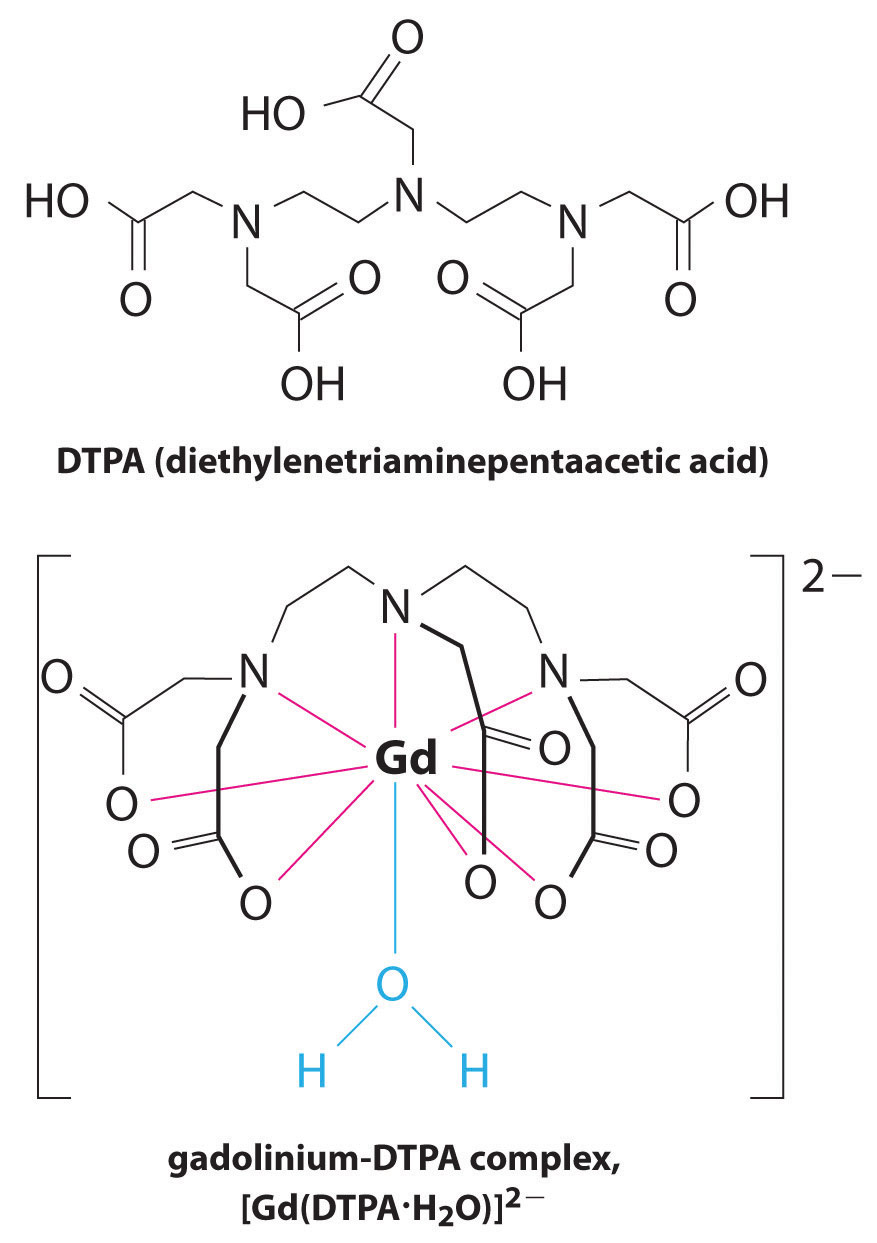
toinen kompleksinmuodostajien käyttökohde löytyy lääketieteestä. Toisin kuin röntgenkuvat, magneettikuvaus (MRI) voi antaa suhteellisen hyviä kuvia pehmytkudoksista, kuten sisäelimistä. Magneettikuvaus perustuu vetyatomien 1h-ytimen magneettisiin ominaisuuksiin vedessä, joka on tärkeä osa pehmytkudoksia. Koska veden ominaisuudet eivät riipu kovin paljon siitä, onko se solun sisällä vai veressä, on vaikea saada yksityiskohtaisia kuvia näistä kudoksista, joilla on hyvä kontrasti. Tämän ongelman ratkaisemiseksi tutkijat ovat kehittäneet luokan metallikomplekseja, joita kutsutaan ” MRI-varjoaineiksi.”MRI-varjoaineen ruiskuttaminen potilaaseen vaikuttaa selektiivisesti veden magneettisiin ominaisuuksiin normaalien kudosten soluissa, kasvaimissa tai verisuonissa ja antaa lääkäreille mahdollisuuden “nähdä” jokainen näistä erikseen (Kuva \(\PageIndex{2}\)). Yksi tärkeimmistä metalli-ioneista tässä sovelluksessa on Gd3+, joka seitsemällä parittomalla elektronilla on erittäin paramagneettinen. Koska Gd3+(aq) on melko myrkyllistä, se on annettava hyvin stabiilina kompleksina, joka ei dissosioidu elimistössä ja voi erittyä muuttumattomana munuaisten kautta. Gadoliniumin kompleksinmuodostajia ovat ligandit kuten DTPA5 – (dietyleenitriamiinipentaetikkahappo), joiden täysin protonoitunut muoto on esitetty tässä.
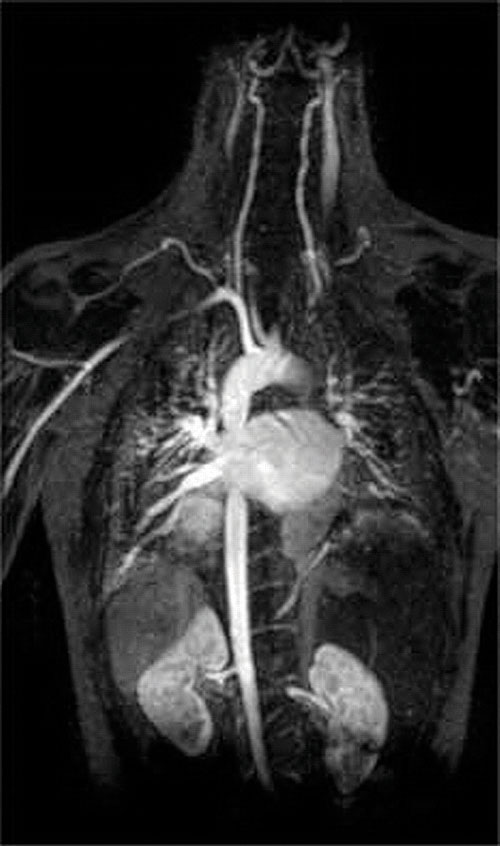
Kuva \(\PageIndex{2}\): MRI-kuva sydämestä, valtimoista ja laskimoista. Kun potilaalle ruiskutetaan paramagneettista metallikationia vakaana kompleksina, joka tunnetaan magneettikuvauksen varjoaineena, solujen veden magneettiset ominaisuudet muuttuvat. Koska erityyppisten solujen eri ympäristöt reagoivat eri tavoin, lääkäri voi saada yksityiskohtaisia kuvia pehmytkudoksista.