2.3: Hiilimonoksidi ja takaisinveto
yleiset ominaisuudet
CO on datiivinen, L-tyypin ligandi, joka ei vaikuta metallikeskuksen hapetustilaan sidottaessa, mutta kasvattaa kokonaiselektronimäärää kahdella yksiköllä. Olemme viime aikoina nähneet, että karbonyyliligandissa on todella kaksi sidosvuorovaikutusta: ligandista metalliin n → dσ-vuorovaikutus ja metallista ligandiin DN → π*-vuorovaikutus. Jälkimmäistä vuorovaikutusta kutsutaan backbondingiksi, koska metalli luovuttaa elektronitiheyden takaisin ligandille. Muistuttaakseni itseäni backbondingin olemassaolosta haluan käyttää oikeanpuoleista resonanssirakennetta aina kun se on mahdollista; on kuitenkin tärkeää muistaa käsitellä CO: ta L-tyypin ligandina riippumatta siitä, mitä resonanssimuotoa piirretään.

Orbitaalivuorovaikutukset M=C = O.
CO on vahva σ-luovuttaja (tai σ-emäs) ja hyvä π-hyväksyjä (tai π-happo). Ligoidun CO: n ominaisuudet riippuvat syvästi metallikeskuksen identiteetistä. Tarkemmin sanottuna metallikeskuksen elektroniset ominaisuudet sanelevat metallikarbonyylikompleksien backbondingin tärkeyden. Kaikkein suorasukaisimmin elektronirikkaammat metallikeskukset ovat parempia backbonding to CO. Miksi on tärkeää varmistautua selkäänpuukottamisen voimasta?
Infrapunaspektroskopiaa on tunnetusti käytetty empiirisesti tukemaan backbonding-ajatusta. Alla oleva taulukko järjestää joitakin metallisia karbonyylikomplekseja “jaksollisessa” järjestyksessä ja antaa c=O-venymätilaa vastaavan taajuuden. Huomaa, että poikkeuksetta jokainen complexed CO on venytys taajuus pienempi kuin vapaan CO. Paneminen on syypää! Kompleksoidussa hiilimonoksidissa c-O-sidoksen järjestys on (lähes aina) pienempi kuin vapaassa HIILIMONOKSIDISSA.

c=O venytystaajuudet metalli-karbonyylikomplekseissa. Onko jokin pielessä?
yllä oleva luku kuvaa selvää tiheyden lisääntymistä (C–O-sidoksen järjestyksen kasvua), kun siirrymme jaksollisen järjestelmän läpi vasemmalta oikealle. Tämä havainto voi tuntua oudolta, jos otamme huomioon, että D-elektronien määrä neutraalissa metallissa kasvaa, kun siirrymme vasemmalta oikealle. Eikö metallikeskusten, joissa on enemmän D-elektroneja, pitäisi olla parempia backbondingissa (ja enemmän “elektronirikkaita”)? Mitä täällä tapahtuu? Muista kiertoradan energian jaksollinen suuntaus. Kun liikumme vasemmalta oikealle, D-orbitaalien energiat pienenevät ja DN-ja π* – orbitaalien energiat erkanevat. Tämän seurauksena, backbonding orbital vuorovaikutus pahenee (muista, että vahva orbital vuorovaikutukset vaativat hyvin sovitettu orbital energiat) kun siirrymme kohti enemmän elektronegative myöhään siirtymämetalleja! Orgaanisesta kemiasta voidaan tehdä analogia enamiineille ja enolieettereille. Enolieetterien elektronegatiivisempi happiatomi on huonompi elektronien luovuttaja kuin enamiinin typpiatomi.

backbondingin merkitys riippuu metallin elektronegatiivisuudesta ja sen elektronitiheydestä.
metallikeskuksessa olevien muiden ligandien osuutta selkäuinnissa ei tietenkään voi unohtaa. Loogisesti elektroneja luovuttavilla ligandeilla on taipumus tehdä backbond vahvemmaksi (ne tekevät metallista paremman elektronien luovuttajan), kun taas elektroneja vetäytyvät ligandit pahentavat backbondingia. Elektronirikkaiden fosfiiniligandien lisääminen esimerkiksi metallikeskukseen pienentää CO-venymistaajuutta parantuneen selkäliitoksen vuoksi.
Karbonyyliligandit kykenevät tunnetusti siltaamaan useita metallikeskuksia. Sidokset silloitetuissa karbonyylikomplekseissa voivat olla joko” perinteisiä ” tai delokalisoituneita kompleksin rakenteesta ja silloitustavasta riippuen. Yhdistämistilojen moninaisuus johtuu ko-ligandissa esiintyvistä eri elektronien luovuttajista ja vastaanottajista (ja delokalisoituneen sidoksen mahdollisuudesta). Tunnetut yhdistämistavat on esitetty alla olevassa kuvassa.
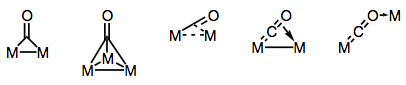
rakennamme siltoja karbonyyliligandeilla!