7.4: kompleksi III
kompleksi III ottaa vastaan elektroneja sekä kompleksista I että kompleksista II. elektronit saapuvat ubikinolina, UQH2: na, joka luovuttaa kaksi elektronia ja kaksi protonia ja muuntuu takaisin ubikinoniksi, UQ: ksi. Tämän jälkeen ubikinoni sukkuloi Takaisin kompleksiin I tai kompleksiin II kerätäkseen lisää elektroneja.
- kompleksi III on sekä kompleksista I että kompleksista II saapuvien elektronien määränpää.
- kompleksi III käyttää syöksylaskun elektroninsiirroissa vapautuvaa energiaa pumppaamaan lisää protoneja sisemmän mitokondriokalvon poikki.
- protonigradientti kalvon poikki ajaa ATP: n muodostumista kompleksissa V.
- kompleksi III lähettää sitten elektroninsa kompleksille IV.
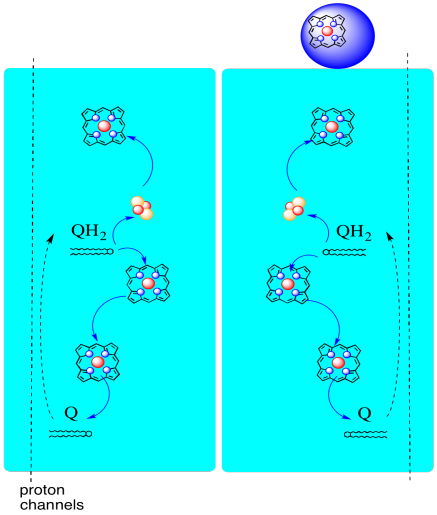
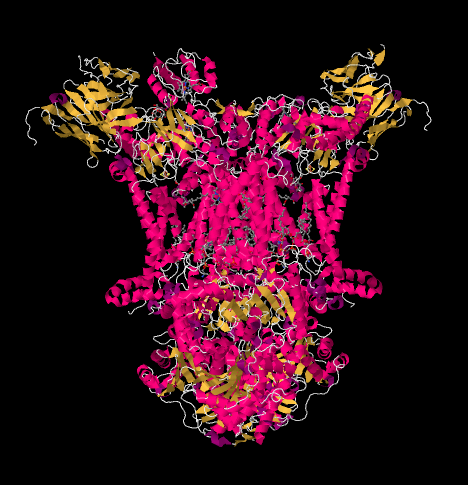
elektronien kulku kompleksin III läpi on esitetty alla. Huomaa, että kompleksi on dimeerinen rakenne, jossa on kaksi vastaavaa polkua: toinen vasemmalla ja toinen oikealla. Elektronit luovutetaan kuvan keskellä olevasta uqh2: sta, ubikinolista, joka kulkee ylöspäin yläosassa olevaan liikkuvaan sytokromi c: hen. Toinen elektronirata mahdollistaa kulkemisen kuvassa alaspäin kohti toista ubikinonimolekyyliä, joka kierrättää elektronit silmukassa.
- kompleksissa III on epätavallinen, toisistaan poikkeava elektronirata.
- yksi elektroni kulkee eteenpäin kohti sytokromi c: tä.
- toinen elektroni kierrätetään lopulta toiseksi ubikinoliksi.
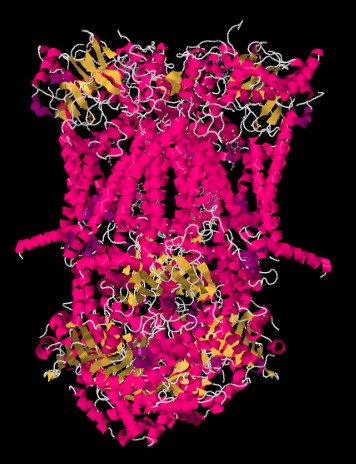
Complex III: n Röntgenrakenne on esitetty sarjakuvamuodossa alla. Sisempi mitokondriokalvo leikkaisi kompleksin ylemmän keskiosion. Suurin osa monimutkaisia hankkeita alla, osaksi matriisi (kuvan alareunassa, tässä suunnassa), vaikka merkittävä määrä myös työntyy intermembrane tilaa.
kompleksi III jatkaa elektroninsiirtoketjua, lähettäen elektroneja korkeampaan pelkistyspotentiaaliin (ja pienempään vapaaseen energiaan) ja kohti kohtaamista molekyylihapen kanssa kompleksissa IV. Protoneja pumpataan myös mitokondrioiden matriisista, sisemmän mitokondriokalvon poikki intermembraanitilaan. Samalla toinen elektronireitti johtaa siihen, että puolet kompleksiin tulevista elektroneista kierrätetään tehokkaasti, jolloin kompleksiin III saapuvaa elektronia kohti pumpattujen protonien määrä kasvaa..
- on ehdotettu, että elektroneja kierrättävä silmukka tarjoaa mekanismin, jolla saadaan lisää protoneja ylös matriisista.
voimme nähdä tämän epätavallisen järjestelyn, jos sivuutamme proteiinit paljastaaksemme alla olevat ligandit. Kompleksin voi selkeämmin nähdä dimeerinä; kuvan vasen puolisko on täsmälleen sama kuin oikea, vaikka heijastuukin päinvastaiseen suuntaan. Elektronit tulevat kompleksiin liikkuvan kantajan, ubikinolin, kautta, joka näkyy kuvan oikealla ja vasemmalla puolella noin puolivälissä alaspäin; voit nähdä renkaan ja siitä riippuvan ketjun.
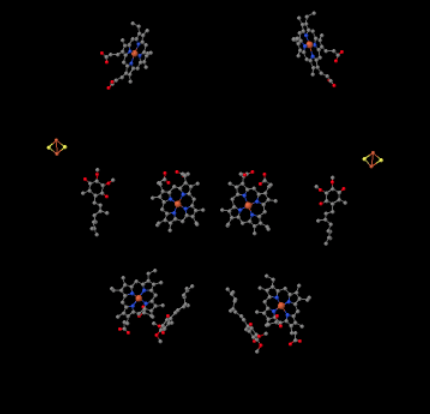
kun UQH2 sitoutuu kompleksiin III, yksi elektroni lähetetään edelleen Fes-klusteriin, kun taas toinen lähetetään rautahemekeskukseen, jota kutsutaan heme BL: ksi. FeS-klusiili näkyy aivan ubikinolin yläpuolella ja kuvan reunassa. Heme BL on kohti kuvan keskustaa.
vaikka se ei näy esitetyssä röntgenkuvassa, tämä Fes-klusteri on erilainen kuin aiemmin näkemäsi. Tätä pidetään paikoillaan erilaisten aminohappojen sivuketjujen avulla. Sitä ei näe kuvassa, koska koko proteiini on jätetty pois, samoin ne aminohapot, jotka sitoutuvat klusteriin. Siinä missä useimmat Fes-klusterit ovat paikoillaan yksinomaan kysteiinien avulla, tätä klusteria pitää paikallaan kaksi kysteiiniä toisella puolella, mutta kaksi histidiiniä toisella. Tätä erikoista FeS-klusteria kutsutaan rieske-klusteriksi.
Riesken klusterit ovat tärkeitä, koska ne ovat “korkean potentiaalin FeS-klustereita”. Tämä tarkoittaa, että niillä on poikkeuksellisen positiiviset vähennyspotentiaalit verrattuna muihin Fes-klustereihin. Minkä tahansa ligandin pelkistyspotentiaali proteiinissa on hyvin riippuvainen sen ympäristöstä, joten arvojen kirjo on useimmissa tapauksissa laaja. Tämä pätee rauta rikkiklustereihin; normaaleilla on pelkistyspotentiaaleja, jotka vaihtelevat -1,0 V: stä noin +0,05 V: hen.Riesken klustereilla on potentiaaleja, jotka vaihtelevat noin 0V: stä noin 0,4 V: hen.
FeS-klusterista elektroni lähetetään toiseen rautahemikeskukseen solukalvoon sidottuun yksikköön nimeltä sytokromi c1. Sytokromi c1 näkyy kuvan yläosassa. Koska tämä kuva on suunnattu samalla tavalla kuin muut Röntgenrakenteet hengityskompleksissa, voimme nähdä, että tämä elektroni kulkeutuu ylös kohti intermembraanitilaa. Lopuksi tämä elektroni siirretään toiseen hemiin, mutta tämä Hemi sitoutuu pieneen, liikkuvaan proteiiniin, jota kutsutaan sytokromi c: ksi. sytokromi c on toinen liikkuva elektroninkantaja. Se kuljettaa elektronin IV-kompleksiin, palaamme sytokromi c: hen hieman myöhemmin.
ennen kuin päästään siihen, mihin toinen elektroni menee? Heme BL: stä toinen elektroni siirtyy toiselle rautaporfyriinikompleksille, heme BH: lle. Se on kuvan alaosassa, joten tämä elektroni lähetetään takaisin kohti matriisia. Heme BL: n luona odottaa kuitenkin toinen ubikinoni, UQ. Se odottaa elektronia. Se itse asiassa odottaa kaksi, sitten jättää telakka ja mennä takaisin noin ubikinoli (UQH2) sitoutumispaikan toimittaa elektronit uudelleen.
miksi vaivautua? Miksi elektroneja ei vain lähetetä kunnolla matkaan ensimmäisellä kerralla? Näyttää siltä, että niitä kierrätetään jostain syystä. Tämän harhautuksen uskotaan mahdollistavan lisäprotonien pumppaamisen mitokondrion kalvon poikki. Kun toinen ubikinoni pelkistyy ubikinoliksi hyväksymällä kaksi elektronia, se poimii myös kaksi muuta protonia alla olevasta matriisista. Nämä protonit kulkeutuvat lopulta kohti intermembraaniavaruutta, kun ubikinoli hapettuu uudelleen. Tätä kierrättämistä ja parin ylimääräisen protonin puristamista protonigradientin lisäämiseksi kutsutaan Q-silmukaksi.
Q-silmukan etu selitetään seuraavassa kaaviossa. Kaaviossa kompleksin III tulot esitetään punaisella, tuotokset sinisellä ja Kierrätetyt elementit vihreällä. Jos yksi ubikinoli yksinkertaisesti luovuttaisi elektroninsa ja protoninsa ja tehtäisiin, jokaista ubikinolia kohti toimitettaisiin kaksi protonia. Se on yksi protonilähtö yhtä elektronia kohti.
toinen ubikinoli tekisi täsmälleen saman asian. Protoneita lähtisi neljä, kun neljä elektronia alun perin tulisivat. Se on yhä yksi protonilähtö jokaista sisään tuotettua elektronia kohti.
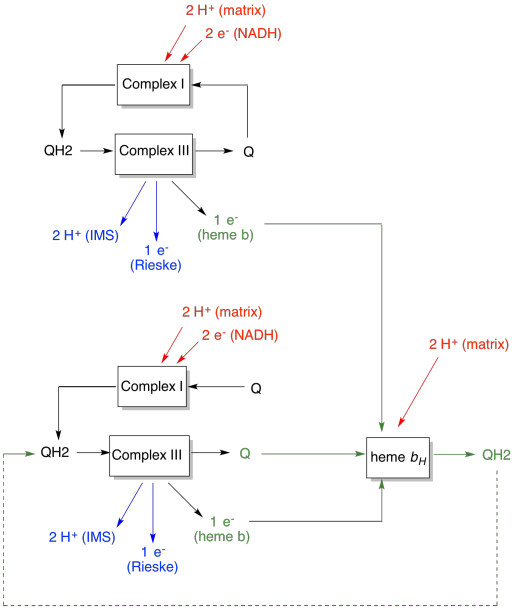
jos sen sijaan yksi elektroni kierrätetään joka kerta, joka toinen ubikinoli johtaa ylimääräisen protoniparin toimitukseen. Se johtuu siitä, että poimiessaan kierrätettyjä elektroneja ubikinonin on täytynyt matkustaa takaisin kalvon matriisipuolelle ja poimia kaksi protonia lisää. Kaiken kaikkiaan se tarkoittaa, että neljän elektronien syötölle toimitetaan kuusi protonia eli 1,5 protonin lähtö elektronien syötölle. Koska protonigradientti on se, mikä tuottaa ATP: n, niin lisäämällä pumpattujen protonien määrää jokaista sisään tulevaa elektronia kohti hyötysuhde kasvaa.
- Q-silmukka lisää systeemiin pumpattujen protonien määrää elektronituloa kohti.
nyt palataan lähtevään elektronikantajaan, sytokromi c: hen, joka kuljettaa elektronit kompleksiin IV. Alla olevassa kuvassa erilaisesta röntgensäteiden kiderakenteesta on löydetty kompleksi, jossa on sitoutumiskohdassa syktokromi c-telakointi. Sytokromi c on vaaleanpunainen pallomainen proteiini, joka on kiinnitetty kuvan yläosaan, dimeerin vasempaan puoliskoon, kun katsomme sitä täällä. Se on väliaineiden välisen tilan reunalla, joka on vesipitoista väliainetta. Toisin kuin ubikinoni, joka liukuu solukalvon lipidikerroksen läpi, sytokromi c rullaa tai liukuu tai ui huipun yli määränpäähänsä.
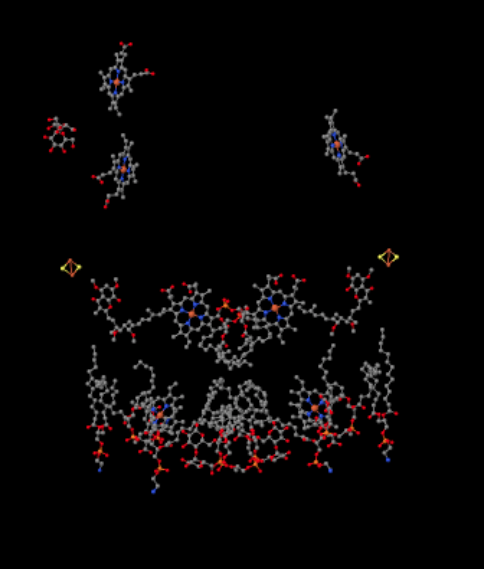
sama näkemys näkyy alla ilman proteiinia. Kuvan alaosa on melko täynnä lipidejä, ja vasemmassa yläkulmassa roikkuu sokeri, mutta aivan yläosassa näkyy rauta-porfyriini, joka on sytokromi c: n sisällä..
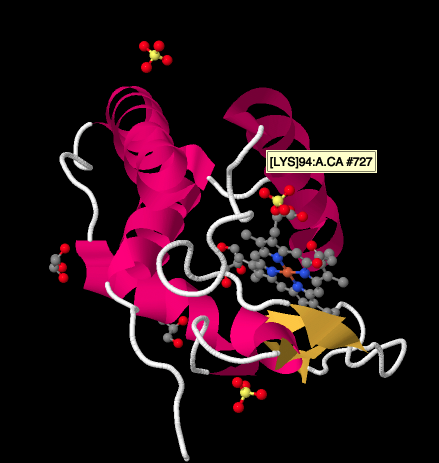
lähempi silmäys alla olevaan syktokromi c: n Röntgenrakennelmaan näyttää suhteellisen yksinkertaisen kuvan verrattuna tarkasteltuihin komplekseihin. Siinä on pari Helistä, pari lakanaa, muutama silmukka, ja että rauta porfyriini tai heme taas. Lähistöllä leijuu muutamia sulfaatti-ioneja sekä pari glyserolimolekyyliä, jotka ovat luultavasti tulleet proteiinin puhdistuksessa tai kiteytymisessä. Huomaa, että Hemi löytyy proteiinin reunalta. Tämä sijainti voi helpottaa elektroninsiirtoa kompleksista III tai kompleksista IV.
- sytokromi c on kompleksin III läpi kulkevien elektronien lopullinen määränpää.
- sytokromi c on liikkuva, yhden elektronin kantaja.
- sytokromi c on itse asiassa pieni, hydrofiilinen proteiini.
- sytokromi c löytyy mitokondrion kalvon yläpuolelta, intermembraanitilan reunalta.
mikä estää syktokromi c: tä vaeltamasta intermembraaniavaruuteen? Tällöin se keskeyttäisi elektronien tehokkaan virtauksen. On mahdollista, että sytokromi c liikkuu edestakaisin kompleksien III ja IV välillä “ohjaus” – nimisen mekanismin kautta. Ohjauksessa kuljettaja ohjataan kulkureittiä pitkin täydentävien maksujen avulla. Jos esimerkiksi kalvo on negatiivisesti varautunut kalvon pinnalla olevien polaaristen ryhmien vuoksi, sytokromi c: n pinnalla olevat positiiviset varaukset voivat rajoittaa sen liikettä kalvon pintaan. Jo pelkästään tämä vähentäisi sen liikkuvuutta kolmesta ulottuvuudesta (missä tahansa intermembraanitilassa) kahteen ulottuvuuteen (missä tahansa kalvon pinnalla). On mahdollista, että lisävuorovaikutukset vähentävät sen liikkuvuutta entisestään yksiulotteiseksi radaksi kahden kompleksin välillä.
- täydentäviin varauksiin perustuva ohjaus estää sytokromi c: n häviämisen intermembraanitilassa.
harjoitus \(\PageIndex{1}\)
ehdottaa mahdollisia aminohappojäämiä sytokromi c: n pinnalla, jotka voivat auttaa sitä pysymään negatiivisesti varautuneella kalvopinnalla.
vastaus
arginiini ja lysiini varautuvat positiivisesti neutraalissa pH: ssa.
harjoitus \(\PageIndex{2}\)
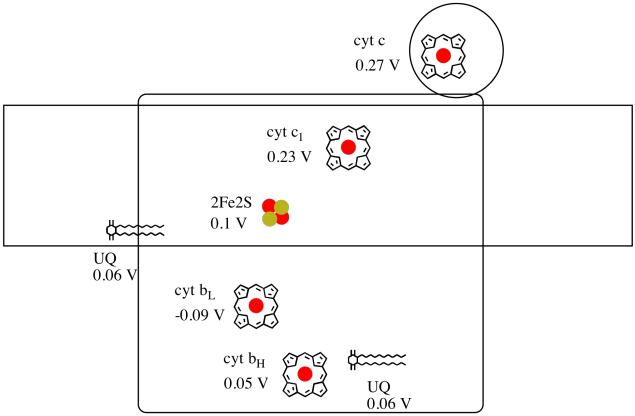
yksittäisen kohdan pelkistyspotentiaalia proteiinin sisällä on vaikea mitata. Tutkijat ovat kuitenkin pystyneet arvioimaan näitä arvoja mittaamalla EPR-spektrejä erilaisissa olosuhteissa. Olettaen alla olevat pelkistyspotentiaalit, piirretään reaktion etenemiskaavio elektronin siirtämiseksi alkuperäisestä ubikinonin luovuttajasta aina sytokromi c: hen saakka..
 vastaus
vastaus
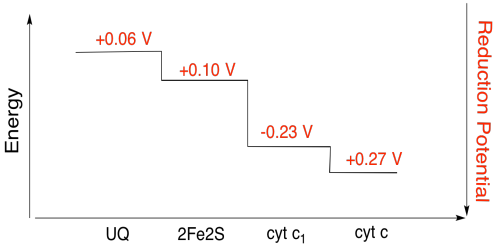
harjoitus \(\PageIndex{3}\)
laske yllä olevan kuvan arvojen avulla energiamuutos, kun 2fe2s-klusterista siirtyy elektroni C1: een.
vastaus
olettaen, että pelkistyspotentiaalit ovat:
2fe2s(ox) + e- → 2fe2s(punainen) eored = 0, 10 v
cyt c1(ox) + E- → cyt c1(punainen) Eored = 0, 230 V
niin reaktion potentiaaliero, ΔEo = 0, 23 – (0, 10) V = 0, 13 V.
Faradayn suhteen δg = – n f δeo antaa
δg = – 1 x 96,485 j v-1 mol-1 x 0, 13 V = 12,543 j mol-1 = 12.5 kJ mol-1
harjoitus \(\PageIndex{4}\)
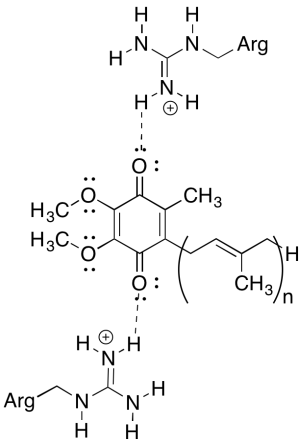
yksi tämän kompleksin hämmentävistä asioista on se, että elektronien kierrätyssilmukassa elektroninsiirto näyttää kulkevan alkuperäisestä ubikinonista lopulliseen ubikinoniin ilman yleistä käyttövoimaa. Vähennyspotentiaalit ovat kuitenkin hyvin herkkiä ympäristölle. Näytä, miten lähellä olevat arginiinijäämät voivat tehdä ubikinonin pelkistyspotentiaalista positiivisemman.
vastaus
positiiviset arginiinijäämät antaisivat osittaisen positiivisen varauksen ubikinonille vetysidoksen kautta; ubikinonilla olisi tämän seurauksena positiivisempi pelkistyspotentiaali.
Katso tarkennussivu rakenne monimutkainen III biokemia verkossa.
X-ray crystal structure of Complex III from: Gao, X., Wen, X., Esser, L., Quinn, B., Yu, L., Yu, C.-A., Xia, D. Structural basis for the quinone reduction in the BC1 complex: a comparative analysis of crystal structures of mitokondrial cytochrome bc1 with bound substrate and inhibitors at the Qi site. Biokemia 2003, 4, 9067-9080. (1NTZ)
kompleksin III X-ray kiderakenne sitoutuneella sytokromi c: llä alkaen: Solmaz, S. R., Hunte, C. kompleksin III rakenne sitoutuneella sytokromi c: llä pelkistetyssä tilassa ja minimaalisen ydinliitännän määrittely elektronitransferille. J. Biol. Kemiaa. 2008, 283, 17542-17549. (3CXH)
X-ray crystal structure of cytochrome C from: Enguita, F. J., Pohl, E., Turner, D. L., Santos, H., Carrondo, M. A. Structural evidence for a proton transfer Reach attached with haem reduction of cytochrome c” from Methylophilus methylotrophus. J. Biol. Inorg. Kemiaa. 2006 11, 189. (1OAE)
Attribution
Chris P Schaller, Ph. D., (College of Saint Benedict / Saint John ‘ s University)