7.5: Complex IV
Complex IV on elektroninsiirtoketjun loppukohde. Tässä hengitys superkompleksin muiden jäsenten läpi kulkeneet elektronit toimitetaan lopulta O2: een, jolloin se pelkistyy vedeksi. Se on vaikuttava taidonnäyte, koska elektronien lisäämisen ja veden lopullisen vapautumisen välillä on muodostuttava useita reaktiivisia happilajeja, mutta reaktiota kontrolloidaan siten, että soluvaurioiden mahdollisuus on mahdollisimman pieni. Samalla sisemmän mitokondriokalvon poikki pumpataan lisää protoneja.
- kompleksissa IV elektronit toimitetaan lopulliseen määränpäähänsä, O2-molekyyliin.
- O2 pelkistyy vedeksi.
harjoitus \(\PageIndex{1}\)
Kirjoita tasapainoinen redox-puolireaktio osoittaaksesi, kuinka monta elektronia tarvitaan pelkistämään happimolekyyli vedeksi.
vastaus
O2 → H2O
O2 → 2 H2O (O tasapainoinen)
O2 + 4H + → 2 H2O (h tasapainoinen)
O2 + 4e- + 4h+ → 2 H2O (lataus tasapainoinen))
kompleksin IV Röntgenrakenne on esitetty alla. Jälleen matriisi on kuvan alapäässä ja intermembraaniavaruus yläosassa. Sytokromi C telakoituu sinne.
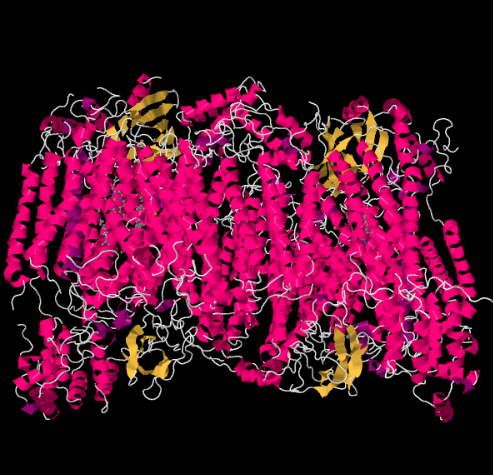
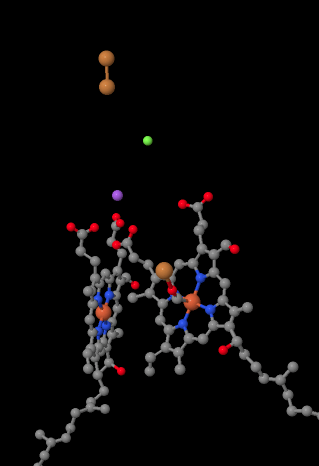
liikkuva elektroninkantaja, sytokromi c, sitoutuu kompleksissa IV ja luovuttaa elektronin kaksitumaiseen kuparikohtaan, jota kutsutaan CuA: ksi. Voimme nähdä tuon kaksirenkaisen kuparin paikan, kun katsomme proteiinin sisälle, alla. Se on sidottu vain proteiiniin eikä mihinkään muuhun, joten näemme vain kaksi kupari-Ionia yksinään kuvan yläosassa. Tämä kupariatomipari lähettää elektronin hemiin, sytokromi a: han, jonka näet alla ja vasemmalla. Sieltä elektroni etenee toiseen kaksirenkaiseen klusteriin, joka tällä kertaa koostuu hemiin sitoutuneesta raudasta (sytokromi a3) ja läheisestä kuparista (CuB). Tässä kaksirenkaisessa kohdassa dioksigeeni pelkistyy vedeksi. Rakenteessa on sytokromi a3: n ja CuB: n väliseen aktiiviseen kohtaan sitoutunut hiilimonoksidimolekyyli. Hiiliatomit ovat kiinni raudassa ja happi kuparissa. Sinne happimolekyyli sitoutuisi ja odottaisi pelkistymistä vedeksi.
jos asiaa ajattelee, se tarkoittaa, että elektronit kulkevat vastakkaiseen suuntaan kuin mitä näimme kolmessa ensimmäisessä kompleksissa. Komplekseissa I ja II elektronit vapautuivat mitokondrioiden matriisista ja kulkivat kohti intermembraaniavaruutta pysähtyen mitokondrioiden kalvossa olevaan ubikinoniin. Kompleksissa III elektronit jatkoivat tuohon” ylöspäin ” suuntaan, mitokondrion kalvolta sytokromi c: lle intermembraanitilassa. Kompleksissa IV elektronit kääntävät kurssiaan ja matkaavat takaisin kohti mitokondriomatriisia. Muista, että mitokondrion matriisi on n-seostettu protonipumppauksen takia, joten nämä elektronit kulkevat kalvon positiiviselta puolelta negatiiviselle puolelle. Se on varmasti vaikeaa.
- kompleksissa IV elektronikuljetus on päinvastaiseen suuntaan kuin muilla komplekseilla.
- elektronit kulkevat intermembraanin avaruuden puolelta mitokondrion matriisin puolelle varausgradienttia vastaan.
tarkastellaan vielä kompleksille tärkeitä ligandeja. Pilapiirros näkyy alla. Sarjakuvassa O2-molekyyli on osoitettu sitoutuvan tässä asennossa heme a3: n ja CuB: n välillä. Siinä kaksirenkaisessa metallipaikassa happimolekyyli pelkistyy vedeksi.
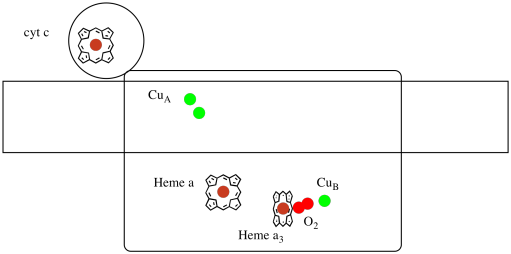
koska O2: n pelkistämiseen H2O: ksi tarvitaan neljä elektronia, neljän sytokromi c-molekyylin on sitouduttava kompleksissa IV ennen kuin pelkistys voi edetä. On todennäköistä, että happimolekyylin koordinaatioympäristö-kahden metallin välillä, eikä vain yhteen sitoutuneena-mahdollistaa sen nopeamman pelkistymisen veteen asti sen sijaan, että se muodostaisi solussa säilyviä reaktiivisia happilajeja, kuten peroksideja.
liikunta \(\PageIndex{2}\)
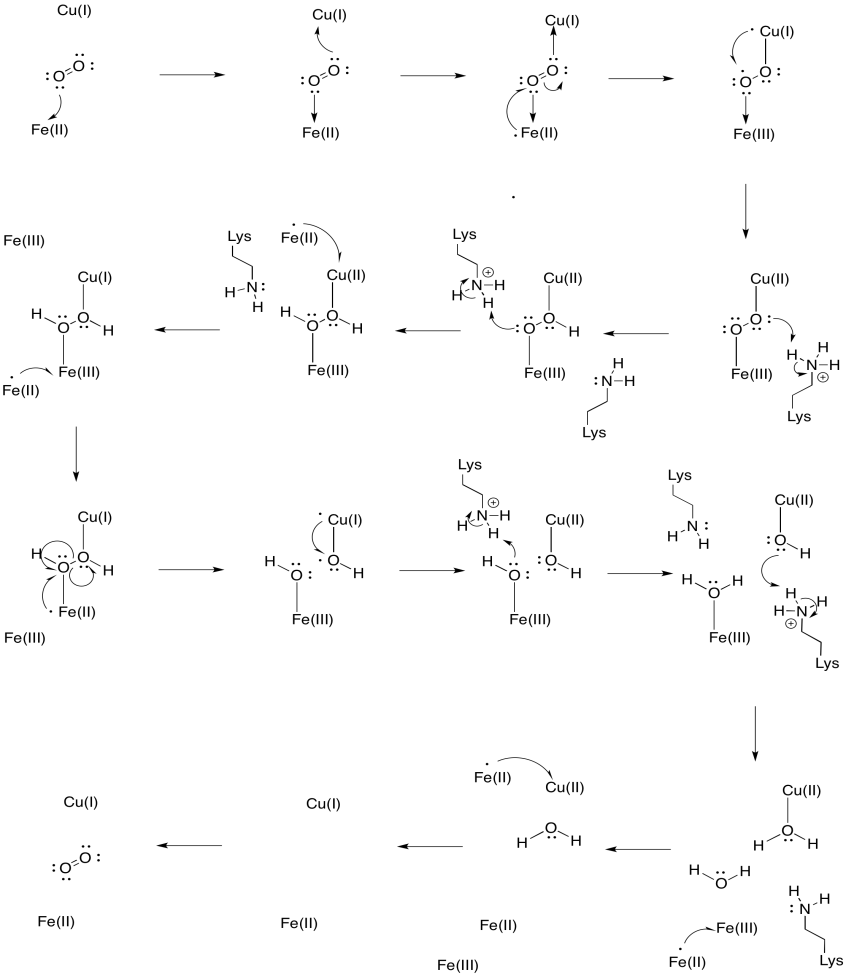
Oletetaan, että rauta heme a3: ssa alkaa pelkistetyssä Fe(II) tilassa ja kuutio alkaa pelkistetyssä Cu(I) tilassa. Tarjota mekanismi pelkistää happea veteen, lisäämällä neljä elektronia ja neljä protonia. Käytetään elektronin luovuttajana Fe (II) ja protonin luovuttajana lysiiniä.
vastaus
näiden kahden metallin lisäksi on olemassa myös muunnettu histidiini-tyrosiinikonjugaatti, joka on sitoutunut Cubiin. On ehdotettu, että tämä tyrosiini tarjoaa toisen välittömän elektronien lähteen, jota voidaan käyttää pelkistyksessä.
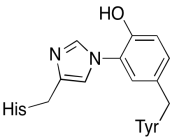
harjoitus \(\PageIndex{3}\)
Näytä, miksi tyrosiini voi olla sekä protonin että elektronin lähde biokemiallisissa prosesseissa.
vastaus
sen lisäksi, että happea on pelkistettävä vedeksi, Complex IV edistää myös protonigradienttia pumppaamalla lisää protoneja mitokondrion kalvon poikki. Tämä tehtävä tuo lisähaasteita. Yksinkertainen kytkentämekanismi ei ole mahdollinen, koska elektronit liikkuvat vastakkaiseen suuntaan. Mekanismiin liittyy kuitenkin konformaatiomuutoksia proteiinissa, joita tapahtuu metallien muuttaessa hapettumistiloja. Hienovaraiset muutokset koordinaatioympäristössä voivat johtaa aminohappojäämien siirtymiseen lähistöllä. On helppo kuvitella, että jos tietty aminohappo siirtyy ylöspäin kohti intermembraanitilaa, se saattaa vetää protonin mukanaan.
- Protonipumppaus ja elektroninsiirto kulkevat kompleksissa IV vastakkaisiin suuntiin ja ne on irrotettava.
- Protonipumppauksen kompleksissa IV on perustuttava konformaatiomuutoksiin.
harjoitus \(\PageIndex{4}\)
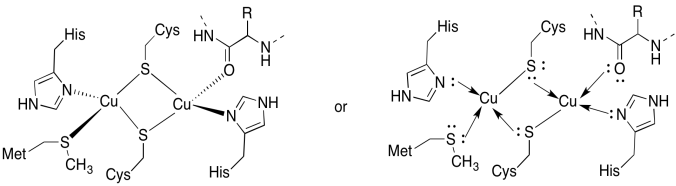
Cua sivusto sisältää kaksi coppers, Bound kaksi siltana kysteiinit. Molempia sitovat terminaaliset histidiinit. Lisäksi toiseen kupariin sitoutuu ylimääräinen metioniini, kun taas toiseen sitoutuu proteiinin selkärangasta karbonyyli.
- piirrä kopparit sidontapaikkoihinsa.
- kuvaile kunkin kuparin geometria.
- jos jokainen kupari on Cu(I), mikä on kunkin kuparin koordinoitu elektronimäärä kompleksissa?
- jos jokainen kupari on Cu(I), mikä on kompleksin kokonaisvaraus?
Vastaus a)
a)
vastaus B)
b) tetraedrinen
Vastaus c)
c) Cu(I) = d10
4 luovuttajaa = 8 e-
yhteensä = 18E –
vastaus d)
d) 2 x Cu (I) = 2+
2 x KYS-S- = 2-
kaikki muut neutraalit
yhteensä = 0
harjoitus \(\PageIndex{5}\)
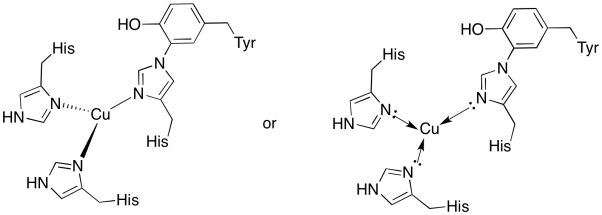
CuB-alueen kuparia sitoo kaksi histidiiniä ja histidiini-tyrosiinikonjugaatti.
- vedä kupari sidoskohtaan.
- kuvaa kuparin geometriaa.
- jos kupari on Cu(I), mikä on kompleksin koordinoitu elektronimäärä?
- jos kupari on Cu(I), mikä on kompleksin kokonaisvaraus?
Vastaus a)
a)
vastaus b)
b) trigonaalinen planaari
Vastaus c)
c) Cu(I) = d10
3 luovuttajaa = 6 e-
yhteensä = 16 E-
vastaus d)
d) Cu(I) = 1+
histidiinit neutraalit
yhteensä = 1+
harjoitus \(\PageIndex{6}\)
yksittäisen kohdan pelkistyspotentiaalia proteiinin sisällä on vaikea mitata. Tutkijat ovat kuitenkin pystyneet arvioimaan näitä arvoja mittaamalla EPR-spektrejä erilaisissa olosuhteissa. Jos oletetaan alla olevat pelkistyspotentiaalit, piirretään reaktion etenemiskaavio elektronin siirtämiseksi sytokromi c: stä molekyylihapelle.
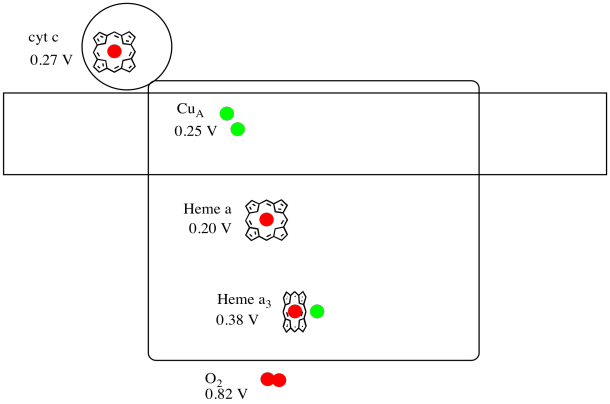 vastaus
vastaus
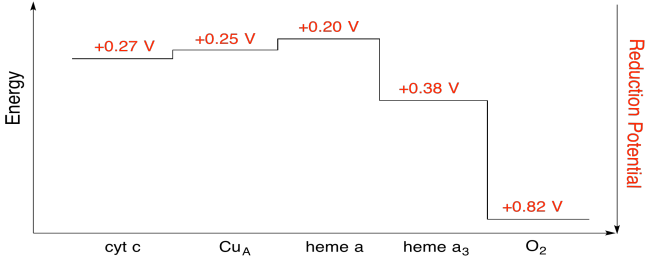
harjoitus \(\PageIndex{7}\)
laske yllä olevan kuvan arvojen avulla energian muutos, kun elektroni siirtyy heme A: sta heme a3: een.
vastaus
olettaen, että reduktiopotentiaalit ovat:
heme a(ox) + e- → heme a(punainen) Eored = 0, 20 V
heme a3(ox) + e- → heme A3 (punainen) Eored = 0.38 V
silloin reaktion potentiaaliero ΔEo = 0, 38 – (0, 20) V = 0, 18 V.
Faradayn suhde ΔG = – n F ΔEo antaa
ΔG = – 1 x 96,485 J V-1 mol-1 x 0, 13 V = 17,367 J mol-1 = 17, 4 kJ mol-1
Attribution
Chris P Schaller, Ph. D., (College of Saint Benedict / Saint John ‘ s University)