Citrate antikoagulaatio crrt: n aikana akuutin munuaisvaurion
- akuutti munuaisvaurio
- Aki – munuaisten korvaushoitojen hoito Akille
- hemodialyysi, hemofiltraatio ja hemodiafiltraatio
- RRT: n aloitus ja ajoitus Aki – jaksottainen vs. jatkuva RRT
- antikoagulaatio jatkuvan munuaiskorvaushoidon (CRRT) aikana
- sitraatti – sen antikoagulanttivaikutuksen mekanismi ja sen soveltaminen CRRT: ssä
- mahdolliset metaboliset häiriöt citrate-antikoagulanttikrt-hoidon aikana
- biokemiallinen seuranta potilailla, jotka saavat Citrate-antikoagulanttihoitoa CRRT
akuutti munuaisvaurio
akuutti munuaisvaurio (AKI), kliininen oireyhtymä, johon voi liittyä monia mahdollisia syitä, määritellään yksinkertaisesti äkilliseksi munuaisten toiminnan heikkenemiseksi tuntien tai päivien kuluessa, mistä on osoituksena seerumin kreatiniinipitoisuuden äskettäinen nousu ja/tai virtsanerityksen väheneminen .
se eroaa kroonisesta munuaissairaudesta, jossa munuaisten toiminnan heikkeneminen on hitaasti mutta peruuttamattomasti etenevää ja tapahtuu kuukausien ja vuosien kuluessa. AKI voi tietenkin esiintyä niillä, joilla on taustalla CKD, ja Akin diagnoosi liittyy normaalia suurempaan riskiin saada CKD lopulta .
kansainvälisesti hyväksytyissä ohjeissa todetaan, että Aki-diagnoosi voidaan tehdä, jos:
• seerumin kreatiniinipitoisuus nousee ≥ 0, 3 mg/dL (26, 5 µmol/L) 48 tunnin kuluessa; tai
• seerumin kreatiniinipitoisuus on noussut vähintään 50% viimeisten 7 päivän aikana; tai
• virtsan määrä on
AKI kattaa koko vaikeusasteen lievästä munuaisten toiminnan heikkenemisestä (Aki-vaiheen 1 vaihe) munuaisten vajaatoimintaan (vaihe 3 Aki). Vaiheistus riippuu seerumin kreatiniinimittauksesta, virtsanerityksestä riippumatta (taulukko I)
|
vaihe |
seerumin kreatiniini |
virtsaneritys |
|
1 |
1.5-1.9 x lähtötilanteen |
6-12 tuntia |
|
2 |
2.0-2.9 kertaa lähtötaso |
⩾ 12 tuntia |
|
3 |
3.0 kertaa lähtötaso |
⩾ 24 tuntia |
taulukko I: kolme vaihetta AKI vakavuus (alkaen ref 1)
Akin syyt on perinteisesti luokiteltu kolmeen nimikkeeseen: prenal; renal (luontainen); ja postrenal, korostaen sitä, että Akilla voi olla erityinen munuaisten etiologia, mutta se voi johtua myös ensisijaisesta ongelmasta munuaisten ulkopuolella.
mikä tahansa tila, joka vähentää veren virtausta munuaisiin (munuaisperfuusio), on mahdollinen prerenaalisen Akin aiheuttaja; näitä tiloja ovat: oksennuksesta, ripulista, verenvuodosta, palovammoista tai septisestä sokista johtuva hypovolemia ja esimerkiksi sydämen vajaatoiminnasta ja maksan vajaatoiminnasta (kirroosi) johtuva sydämen tuotannon väheneminen. Tärkein syy luontainen AKI on munuaistiehyiden nekroosi, joka johtuu munuaisten iskemian tai nauttimisesta nefrotoksisia lääkkeitä/myrkkyjä.
Sepsis, Akin yleisin syy kriittisesti sairaissa, johtuu osittain huonosti määritellystä sisäisestä munuaisvauriosta, joka muistuttaa munuaistiehyiden nekroosia . Lopuksi, postrenal AKI tulokset tahansa ehto, joka estää virtsan virtausta distaalinen munuaisiin; näitä ovat: munuaiskivet (calculi); eturauhassairaus (kasvain/hypertrofia); virtsarakon toimintahäiriö; ja virtsaputken ahtauma.
Aki – munuaisten korvaushoitojen hoito Akille
Akille ei ole olemassa erityistä hoitoa ja hoito on suurelta osin tukihoitoa perimmäiseen syyhyn suunnatulla hoidolla. Nefrotoksisten lääkkeiden peruuttaminen, nesteen elvytys ja elektrolyytin ja happo-emäshäiriön korjaus ovat kaikki osa tätä yleistä tukihoitoa . Vasopressorin tai inotrooppisten lääkkeiden antaminen normaalin verenpaineen ja sydämen tuotoksen palauttamiseksi voi olla tarpeen.
tässä artikkelissa keskityttiin Munuaiskorvaushoitoon (RRT), joka edustaa vaikeaa Akia sairastavien potilaiden viimesijaista hoitoa, joka ei vastaa konservatiivista elintoimintoja tukevaa hoitoa. Akia sairastavista teho-OSASTOPOTILAISTA noin 23 prosenttia (eli noin 13 prosenttia kaikista teho-osastopotilaista) saa RRT-hoitoa .
Renal replacement therapy (RRT) on yleisnimitys kaikille hoidoille, joilla pyritään korvaamaan munuaisten toiminta. Luovuttajan munuaisensiirto niille, joilla on loppuvaiheen munuaissairaus voidaan pitää perimmäinen RRT, mutta termi on useammin varattu niille hoitoja, jotka korvaavat veren suodatus ja homeostaattisia toimintoja munuaisten dialyysillä, prosessi, joka hyödyntää puoliläpäisevä kalvo kuin veren suodatin. Aki: n hoitoon on saatavilla kaksi laajaa dialyyttistä RRT-tyyppiä (ja itse asiassa loppuvaiheen CKD): peritoneaalidialyysi ja hemodialyysi.
sen sijaan hemodialyysissä veren suodattaminen tapahtuu kehon ulkopuolisessa koneessa (kehonulkoinen). Veri pumpataan suodattimeen / dialyzer, jossa jätteet ja ylimääräinen neste poistetaan, ja sitten palautetaan elimistöön. Tämä kehonulkoinen piiri (dialyysikone ja sen yhdysputket potilaasta ja takaisin) on prokoagulanttiympäristö.
hemodialyysi, hemofiltraatio ja hemodiafiltraatio
nykyaikaisissa dialyysilaitteissa on mahdollisuus hemofiltraatioon (HF) sekä hemodialyysiin (HD), mikä mahdollistaa kolme erilaista dialyyttistä modaliteettia AKI: n hoidossa: hemodialyysi (HD), hemofiltraatio (Hf) ja hemodiafiltraatio (HDF).
kaikkien kolmen modaliteetin ytimessä on puoliläpäisevä kalvo, joka muodostaa veren suodattimen. Kun potilaasta pumpattu veri virtaa tämän kalvon toisella puolella, ylimääräinen vesi ja jäteliuokset kulkevat kalvon poikki. Suodos tai jätevesi pumpataan jätteeksi, kun suodatettu veri palautetaan potilaalle.
hemodialyysissä (HD) käytetään dialyysinestettä, joka virtaa jatkuvasti ja vastavirtaan veren kanssa kalvon toisella puolella. Dialyysinesteen koostumus ja virtausnopeus takaavat tasaisen pitoisuusgradientin puoliläpäisevässä kalvossa suhteessa veriliuoksiin. Nämä konsentraatiogradientit puolestaan helpottavat liuotinmolekyylien hallittua diffuusiota kalvon poikki.
verestä poistettavien urean ja kreatiniinin kaltaisten liuosten pitoisuusgradientti on sellainen, että diffuusiosuunta on verestä dialyysinesteeksi, kun taas bikarbonaatin kaltaisten liuosten osalta, joita on usein lisättävä vereen vakavaan Akiin liittyvän asidoosin korjaamiseksi, dialyysineste, jonka bikarbonaattipitoisuus on suuri suhteessa vereen, takaa diffuusion vastakkaiseen suuntaan, dialyysinesteestä vereen. Dialyysinesteen koostumuksen ja virtausnopeuden säätäminen mahdollistaa siten potilaskohtaisen metabolisen korjauksen.
Nesteylimäärä on usein Akin ominaisuus, joka korjataan hemodialyysin aikana. Tämä saavutetaan ultrasuodatuksella, joka riippuu puoliläpäisevän kalvon läpi vallitsevasta hydrostaattisesta painegradientista. Suhteellinen positiivinen hydrostaattinen paine kalvon veripuolella tehokkaasti “työntää” vettä verestä dialyysinesteeseen.
tämä ultrasuodatus helpottaa myös sellaisten liuosmolekyylien kulkeutumista, jotka kulkeutuvat ultrasuodatuksen aikana veden mukana liuenneen konvektiomekanismin (tai liuotinvaahdon) avulla. Soludiffuusion, solukonvektion ja ultrasuodatuksen yhteisvaikutuksella hemodialyysin aikana pyritään varmistamaan, että nesteen tilavuus ja koostumus sekä solunulkoisessa että solunsisäisessä osastossa palautuu mahdollisimman lähelle niitä, joilla on normaalisti toimivat munuaiset.
Hemodiafiltraatio (HDF) on HF: n ja HD: n yhdistelmä. Se mahdollistaa pienimolekyylipainoisten liuosten optimaalisen puhdistuman diffuusiolla dialyysinesteeseen ja suurimolekyylipainoisten liuosten optimaalisen puhdistuman konvektiolla ja ultrasuodatuksella. Kuten HF: ssä, HDF: ssä tarvitaan jatkuvaa korvausnestettä, ja kuten HD: ssa, HDF: ssä dialyysinestettä.
RRT: n aloitus ja ajoitus Aki – jaksottainen vs. jatkuva RRT
kaikki munuaiskorvaushoidot (PD, HD, HF ja HDF) voidaan antaa jaksottaisesti (eli tyypillisesti 3-4 tunnin istunnoissa) tai jatkuvasti, kunnes munuaisten toiminta on palautunut. Potilailla, joilla on loppuvaiheen munuaisten vajaatoiminta, jotka vaativat elinikäistä (kroonista) RRT: tä, hoito on yksinomaan ajoittaista hemodialyysiä (IHD), joka toimitetaan lähes poikkeuksetta neljässä tunnin istunnossa kolme kertaa viikossa .
Akia sairastavilla potilailla on vain tilapäinen RRT-vaatimus munuaisten toiminnan tukemiseksi Akia saostaneen kriittisen/akuutin sairauden korjaantumisen aikana. RRT: n keskimääräinen kesto AKI-potilailla on noin 13 päivää , vaikka erityistapauksissa se voi olla tarpeen vain muutaman päivän ajan tai kestää useita viikkoja.
perinteisiä (absoluuttisia) indikaattoreita RRT-hoidon aloittamiseksi Akissa ovat:
• hyperkalemia (plasman kalium > 6, 0-6, 5 mmol/L)
• vaikea uremia (plasman urea > 30 mmol/l)
• uremisen enkefalopatian merkit
• asidoosi (pH • akuutti keuhkopöhö
saattaa olla hyödyllistä aloittaa hoito ennen kuin nämä Aki: n äärimmäiset vaikutukset ovat ilmeisiä, mutta optimaaliset RRT: n käynnistämisen (ja lopettamisen) ajankohta on tällä hetkellä epäselvä ja aihe käynnissä . Tällä hetkellä ei ole luotettavaa tietoa, joka tukisi Akin tietyntyyppistä RRT: tä, minkä vuoksi on käytetty kaikentyyppisiä RRT: tä.
nykyisissä ohjeissa on kuitenkin vallinnut yksimielisyys siitä, että RRT: tä tulisi antaa jatkuvasti eikä jaksoittaisesti kaikkein kriittisimmin sairaille (hemodynaamisesti epästabiileille) potilaille. Viimeaikaiset tutkimukset osoittavat, että nykyään jatkuvia munuaiskorvaushoitoja (Crrt) käytetään paljon useammin kuin ajoittaisia Akin hoitoja ja että yleisimmin käytetty CRRT on jatkuva laskimoiden hemofiltraatio (cvvhf) ja sen jälkeen jatkuva laskimoiden hemodiafiltraatio (cvvhdf).
antikoagulaatio jatkuvan munuaiskorvaushoidon (CRRT) aikana
CRRT, kuten kaikki muutkin munuaiskorvaushoidot peritoneaalidialyysia lukuun ottamatta, edellyttää veren pumppaamista ei -fysiologisen, kehonulkoisen piirin kautta. Luontainen ominaisuus veren hyytyä (hyytymä) kosketuksessa nonfysiologiset pinnat määrittää, että säilyttääkseen “hyytymä vapaa” potilaan extracorporeal piiri, veri on antikoagulanttia.
CRRT: llä on erityinen tarve antikoagulanttihoitoon verrattuna ajoittaisiin hoitojaksoihin, koska hoitojaksot ovat pitkittyneet ja veri pumpataan virtapiirissä suhteellisen hitaasti . Lisäksi CRRT: tä tarvitsevien potilaiden veri on usein jo suhteellisessa prokoagulanttitilassa taustalla olevan kriittisen sairauden (esim .sepsis) tai trauman vuoksi.
useiden vuosien ajan hepariini, joko fraktioimaton hepariini (UF) tai pienimolekyylinen hepariini (LMWH), oli ainoa antikoagulantti, jota käytettiin dialyysimenetelmissä, mukaan lukien CRRT. Hepariinia käytetään edelleen; se on halpa ja yleensä turvallinen antikoagulanttimenetelmä valtaosalle RRT-hoitoa tarvitsevista potilaista.
systeemiseen hepariinikoagulaatioon, jota ei voida välttää, liittyy kuitenkin väistämättä lisääntynyt verenvuotoriski, joten dialyysin aikana tapahtuva hepariinikoagulaatio on ehdottoman vasta-aiheinen potilaille, joilla on parhaillaan verenvuotoa tai joilla on normaalia suurempi verenvuotoriski.
lisäksi hepariini voi pienessä vähemmistössä (
hepariinin käyttöön liittyvät mahdolliset verenvuoto-ja HIT II-riskit korostivat vaihtoehtoisen antikoagulantin tarvetta joillekin RRT-hoitoa tarvitseville potilaille. Sitraatti tarjosi tällaisen vaihtoehdon. Regional citrate antikoagulaatio dialyysin piiri, ensimmäinen käytetty menestyksekkäästi 1980-luvun alussa, oli alun perin varattu että pieni vähemmistö potilaista, joille hepariini on vasta. Tämä muuttui satunnaistetuissa kontrolloiduissa tutkimuksissa, joissa verrattiin hepariini-ANTIKOAGULANTTIKRT: tä sitraatti-antikoagulanttikrt: hen; nämä osoittivat, että sitraatti on sekä tehokkaampi että turvallisempi antikoagulantti kuin hepariini .
sitraatti onkin viime vuosina noussut kaikkien CRRT-hoitoa tarvitsevien Aki-potilaiden suosimaksi antikoagulantiksi . Tehohoitoyksiköt ympäri maailmaa raportoivat vaihtavansa hepariinista regional citrate antikoagulanttiin CRRT: ssä . Jotkut viranomaiset jopa suosittelevat sitraatin käyttöä hepariinin sijaan ajoittaisessa (kroonisessa) hemodialyysissä.
sitraatti – sen antikoagulanttivaikutuksen mekanismi ja sen soveltaminen CRRT: ssä
sitraatti, jota on käytetty antikoagulanttina/luovutetun veren säilyttämiseen verensiirtoa varten yli vuosisadan ajan , estää veren hyytymistä, koska se kykenee sitomaan (kelaattina) veriplasmassa kiertävää ionisoitunutta kalsiumia (iCa). Tämä iCa on välttämätön kofaktori sekä verihiutaleiden aggregaatiolle että useille keskeisille vaiheille fibriinin tuotannosta ja siten fibriinihyytymän muodostumisesta vastaavissa sisäisissä ja ulkoisissa hyytymisreiteissä.
veren hyytymistä estää plasman iCa-pitoisuuden pieneneminen noin 0, 35 mmol/L (normaali ref-vaihteluväli 1, 15-1, 30 mmol/L). Tämä ei-fysiologinen, vakavasti hypokalseeminen tila saavutetaan nostamalla plasman sitraattipitoisuus noin 3 mmol/L (normaali plasman sitraattipitoisuus ~0,1 mmol/L ).
vaikka Morabiton ym. esittämissä yksityiskohdissa on eroja, kaikissa citrate-antikoagulanttiprotokollissa CRRT: n aikana sitraattia sisältävän liuoksen (yleensä joko trinatriumsitraatti tai ACD-sitraattidekstroosi-liuos) jatkuva infuusio prefilter – /dialyysilinjaan, lähelle sitä, mistä potilas lähtee, joko erillisenä liuoksena tai yhdistettynä prefiluutionesteeseen. Tämän infuusion virtausnopeutta säädetään siten, että veren sitraattipitoisuus on ~3 mmol/L ja siten plasman iCa on noin 0,35 mmol/L.
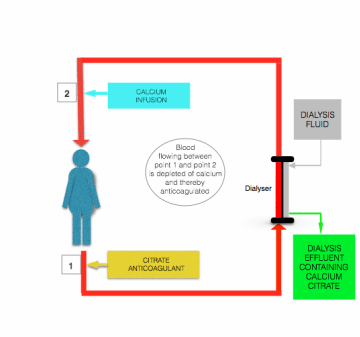
sitraatti-infuusion aiheuttama hypokalsemia korjataan ennen veren palautumista potilaalle antamalla kalsiumia sisältävää liuosta (kalsiumkloridia tai kalsiumglukonaattia) infuusiona jälkisuodatuslinjaan lähelle sitä kohtaa, jossa se tulee potilaaseen (KS.yllä oleva kuva).
sitraatin antikoagulaation tärkein turvallisuusetu hepariinin antikoagulaatioon verrattuna on se, että antikoagulaatio rajoittuu kehonulkoiseen kiertoon. Tämä niin sanottu” alueellinen antikoagulaatio ” saavutetaan, koska suurin osa infusoidusta sitraatista poistetaan (joko sitraattianioneina tai kalsiumsitraattikelaattina) verestä suodattimen/dialysaattorin läpi kulkemisen aikana .
kaikki jälkisuodatusveressä jäljellä oleva sitraatti laimenee systeemisessä verenkierrossa ja metaboloituu nopeasti hiilidioksidiksi ja vedeksi hapesta riippuvaisen Krebs-kierron kautta kudossolujen (pääasiassa maksasolujen) mitokondrioissa.
sitraatin metabolia liittyy bikarbonaatin tuotantoon: jokaista 1 mmol sitraattia kohti muodostuu 3 mmol bikarbonaattia. Sitraatin nopea puhdistuma (sitraatin puoliintumisaika veressä on yleensä noin 5 minuuttia) tämän pääasiassa maksan kautta varmistaa yleensä systeemisen antikoagulaation puuttumisen CRRT: n aikana eikä siten lisää verenvuotoriskiä.
mahdolliset metaboliset häiriöt citrate-antikoagulanttikrt-hoidon aikana
ilmeistä haluttomuutta omaksua täysin citrate-antikoagulanttikrt-hoito kaikilla AKI-potilailla viime aikoihin asti on pidetty huolena happo-emäs-ja elektrolyyttihäiriöistä, joita saattaa esiintyä hoitoa saavilla potilailla .
seuraavia elektrolyytti-ja happo-emäshäiriöitä on raportoitu citrate-antikoagulanttihoitoa CRRT: tä saavilla potilailla :
• hypokalsemia/hyperkalsemia
• hypomagnesia/hypernatremia
• hyponatremia/hypernatremia
• metabolinen alkaloosi
• metabolinen asidoosi
näitä häiriöitä voi esiintyä useista syistä, mutta sitraatin kertyminen ääreisverenkiertoon (sitraattimyrkytys) voi olla keskeisessä osassa useimmissa näistä häiriöistä. Syitä sitraatin kertymiseen CRRT: n aikana ovat:
• membraanisuodatuksen asteittainen väheneminen dialyysin aikana, mikä vähentää sitraatin suodatusta ja samanaikaisesti lisääntyy sitraatin annostelu systeemiseen verenkiertoon
• toimintavirhe – sitraatti – infuusion vahingossa lisääntynyt määrä kehonulkoiseen kiertoon ja samanaikaisesti lisääntynyt sitraatin annostelu systeemiseen verenkiertoon
• verituotteiden verensiirto-sitraatti-säilöntäaine lisää CRRT: stä johtuvaa sitraattikuormaa systeemisessä verenkierrossa
syystä riippumatta, kertyminen sitraatti ääreisverenkierron voi johtaa sitraatti Kelaatio kiertävän ionisoidun kalsiumin, mikä vähentää plasman ionisoidun kalsiumin pitoisuus (hypokalsemia). Riittävän vakava hypokalsemia voi aiheuttaa sydämen rytmihäiriöitä ja lopulta sydänpysähdyksen .
vaikka plasman ionisoitunut kalsium vähenee sitraatin kertymisen aikana (toksisuus), kalsiumin kokonaismäärä kasvaa (mikä viittaa hyperkalsemiaan), koska sitraattiin sitoutunut kalsium sisältyy mitattuun kokonaiskalsiumiin. Kokonais-ja ionisoituneen kalsiumin (yleensä 2,0) suhdeluvun nousu arvoon > 2.1: n on todettu olevan luotettavin signaali sitraattimyrkytyksestä, koska rutiininomaisesti saatavilla olevaa plasman sitraattiarviota ei ole .
sitraattikoagulanttihoitoon liittyvä plasman natriumin (hypernatremian) lisääntymisen riski johtuu eräiden CRRT-hoidossa käytettävien sitraattiliuosten korkeasta natriumpitoisuudesta (hypertonisuudesta). Esimerkiksi joissakin tutkimussuunnitelmissa käytetty 4-prosenttinen trinatriumsitraattiliuos sisältää natriumia pitoisuutena 420 mmol/L. käytännössä hypotonisen dialyysin / korvausnesteiden käyttö voi pienentää tätä riskiä ja hypernatremia on kaikesta päätellen harvinainen sitraattikoagulantin komplikaatio .
hypomagnesian (seerumin magnesiumin pienenemisen) riski sitraattikoagulaation aikana johtuu siitä, että magnesium on kalsiumin tavoin kaksiarvoinen ioni, joka voi myös sitoutua (kelaattiin) sitraattiin. Jos magnesiumin kelaatiovaikutuksesta johtuvia magnesiumhäviöitä ei täysin kompensoida dialyysissä/korvausnesteissä, voi esiintyä hypomagnesiaa .
biokemiallinen seuranta potilailla, jotka saavat Citrate-antikoagulanttihoitoa CRRT
tehohoitoyksikköön sijoitetulla verikaasuanalysaattorilla tehtävä Hoitotestaus mahdollistaa useimpien parametrien (ionisoitu kalsium, pH, bikarbonaatti, emäsylijäämä, natrium ja laktaatti) nopean ja kätevän mittauksen, mutta seerumin kalsiumin ja magnesiumin kokonaisarviointi ei yleensä ole saatavilla näillä alustoilla, ja näytteet on lähetettävä laboratorioon näitä mittauksia varten.
kaksi tuoretta tutkimusta osoittavat, että jotkin verikaasuanalysaattorit eivät välttämättä ole luotettavia mittaamaan ionisoitunutta kalsiumia erittäin alhaisilla, ei-fysiologisilla pitoisuuksilla (~0.3 mmol / L) esiintyy jälkisuodatusveressä, vaikka niiden kyky mitata tarkasti plasman ionisoitunutta kalsiumia systeemisessä verenkierrossa (jossa pitoisuus on paljon suurempi) ei ole kyseenalainen.
|
mitattu parametri |
Seurantaväli |
tavoitearvot tai n. viitealueet |
mittauksen tarkoitus |
korjaavat toimet, jos kohde on ulkopuolinen |
|
Postfilter ionized calcium (iCa) pitoisuus, eli verinäytteet postfilter port. |
1 tunnin kuluessa aloituksesta ja mahdollisen sitraattiannoksen muutoksen jälkeen, sitten 4-6 tunnin välein |
0.25-0.35 mmol / L |
|
sitraattiannoksen säätö: suurentaminen, jos iCa > 0, 35, pienentäminen, jos iCa |
|
systeeminen ionisoitunut kalsium (iCa), ts. potilaan verinäytteet |
lähtötilanne (ennen aloittamista), sitten 1 tunti aloittamisen jälkeen, sitten vähintään 4-6 tunnin välein |
1.15-1.30 mmol / L |
|
kalsiuminfuusionopeuden säätö; 1.30 |
|
systeeminen kokonaiskalsium (TotCa), ts. verinäytteet potilaalta (TotCa = iCa + albumiiniin sitoutunut kalsium + sitraattiin sitoutunut kalsium) |
vähintään 12-24 tunnin välein (on tehtävä samanaikaisesti systeemisen ionisoituneen kalsiumin arviointi) |
vaaditaan vain totCa: iCa-suhteen määrittämiseen (KS.) |
||
|
kokonaispitoisuuden suhde ionisoituneeseen kalsiumiin (TotCa:iCa) |
vähintään 12-24 tunnin välein |
tunnistaa sitraatti kertyminen / myrkyllisyys joskus kutsutaan “sitraatti Lukko” |
vaihtoehtoja ovat:
|
|
|
Valtimoverikaasuanalyysi
|
lähtötilanne (ennen aloittamista). 1 tunnin kuluessa aloittamisesta, sitten vähintään 4-6 tunnin välein. |
pH 7, 35-7, 45 bikarb 23-28 mmol / L äk–2-+3 mmol / L |
happo-emäshäiriöiden havaitseminen: metabolinen alkaloosi metabolinen asidoosi |
vaihtoehtoja metabolisen alkaloosin tapauksessa ovat:
|
|
seerumin natrium |
kerran päivässä |
135-145 mmol / L |
hypernatremian/hyponatremian havaitseminen |
harvinainen esiintyminen-tarkista oikea dialyysi / korvausneste |
|
Seerumilaktaatti |
lähtötilanne (ennen aloittamista), sitten kliinisen tarpeen mukaan |
auttaa tunnistamaan ne, joilla on sitraattimyrkytysriski |
harkitse yhdessä TotCa: iCa-suhteen kanssa sitraattimyrkytyksen riskiä |
|
|
seerumin magnesium |
vähintään kerran päivässä |
hypomagnesian havaitseminen |
korjaus magnesiuminfuusiolla |
taulukko II: biokemiallinen seuranta CRRT-antikoagulanttihoidon aikana (viite 24)