Dr. Chittaranjan Das
laboratoriomme pääpaino on ymmärtää toiminnallista roolia deubikvitinoivat entsyymit (deubikvitinaasit tai DUBs) soluradoissa, erityisesti ne, jotka liittyvät neurodegeneraatioon (asteittainen menetys neuronien), kuten Alzheimerin tauti (AD) ja Parkinsonin tauti (PD). Monenlaisia biologisia prosesseja ohjaa proteiinien reversiibeli, translaation jälkeinen modifikaatio, johon ubikitiini, erittäin säilyvä 76-jäämäinen eukaryoottinen polypeptidi, sitoutuu kovalenttisesti. Ubikitinaatiota voidaan pitää signalointikaskadin (ubikitiini-signalointi) alkutapahtumana, joka lopulta päättyy ubikitiini-tagin hydrolyyttiseen poistamiseen DUB: lla. Tutkimus ihmisen genomin paljastaa läsnäolo noin 90 DUBs, viittaa niiden osallisuudesta monenlaisia biokemiallisia reittejä. Lähestymistapamme Dubsin tutkimiseen perustuu useiden työkalujen yhdistettyyn soveltamiseen, kuten pienimolekyyliluotainten kemiallinen synteesi, Röntgenkristallografia ja massaspektrometriapohjainen proteomiikka.
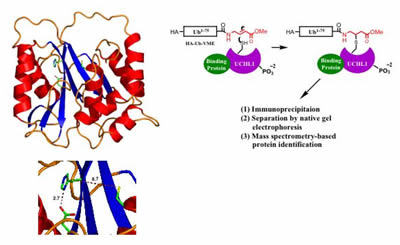
Uchl1: n rakenne, joka määritetään Röntgenkristallografialla, viittaa siihen, että entsyymi voi hyväksyä kaksi tilaa, inaktiivisen tilan (jossa katalyyttiset jäämät ovat vinossa, kuvassa vasemmalla) ja oletetun aktiivisen tilan-jossa jäämät tuodaan yhdenmukaistamiseen proteiinin vuorovaikutuksella tuntemattomien kofaktorien kanssa. Ehdotettu menetelmä UCHL1: n kofaktorien tunnistamiseksi kokosoluuutteista tehtäväpohjaisella puhdistuksella (oik.).
tällä hetkellä tutkimme neuronaalisen DUB ubikitiinin C-terminaalisen hydrolaasin L1 (UCHL1) normaalia toimintaa – PD-liittyvä,neuronispesifinen proteiini, jolla on tuntematon fysiologinen tehtävä. Pyrkimyksemme tähän suuntaan on suunnattu kehittämään soluläpäiseviä pieniä molekyylin estäjiä UCHL1: stä, joita voidaan käyttää sen toiminnan (sekä normaali että sairauteen liittyvä) mittaamiseen, sen sitovien kumppaneiden määrittämiseen affiniteettipohjaisella puhdistuksella kokosoluuutteista ja molekyylitason määrittelyyn siitä, miten tämän entsyymin luonnossa esiintyvä variantti-jossa ser asemassa 18 on korvattu Tyr: llä (kutsutaan S18y polymorph: ksi)-suojaa Parkinsonin taudilta (PD). UCHL1: n lisäksi teemme myös rakenteellisia ja mekanistisia tutkimuksia ofmuut niihin liittyvät entsyymit, joiden uskotaan osallistuvan perustavanlaatuisiin biokemiallisiin prosesseihin, kuten DNA: n korjaukseen, histonin muokkaukseen ja plasman kalvoproteiinien endosytoosiin.
Koulutus
- Ph. D., Indian Institute of Science, 2001
- Tutkijatohtori, Harvard Medical School ja Brandeis University, 2006
tunnustukset
- Senior Research Fellowship, University Grants Commission, India , 1996
julkaisut
Julkaisuluettelo