Frontiers in Medicine
- Introduction
- potilaat ja menetelmät
- Potilaan valinta seuranta -, epidemiologia-ja Lopputulostietokannassa
- tilastollinen analyysi
- tulokset
- Potilasominaisuudet
- T1-vaiheen riski parani muihin t-vaiheisiin verrattuna, kun seerumin CEA-tason nousu oli
- ennen leikkausta saavutetun seerumin CEA – korkeuden vaikutus T-vaiheessa
- Keskustelu
- tiedon Saatavuuslausunto
- Etiikkalausunto
- tekijän kannanotot
- eturistiriita
- kiitokset
Introduction
peräsuolen syöpä on yksi yleisimmistä maligniteeteista maailmanlaajuisesti (1). Mukaan American Joint Committee on Cancer (AJCC) lavastusjärjestelmä, anatominen laajuus primaarikasvaimen (t vaihe) on yksi tärkeimmistä ennusteiden ennustajia. Potilailla, joilla on sama t-vaihe peräsuolisyövässä, saattaa kuitenkin esiintyä huomattavasti erilaisia kliinisiä tuloksia.
ensimmäisen kerran vuonna 1965 raportoitu karsinoembryoniantigeeni (CEA) on 180-200 kDa: n glykoproteiini ja immunoglobuliini-superperheen jäsen (2). CEA: ta erittävät erilaiset kiinteät kasvaimet, mukaan lukien 90% paksusuolen syövistä (3). Koska se on tärkein ja luotettavin seerumin ennustava biomarkkeri kolorektaalisyövässä, kohonneiden cea-pitoisuuksien ennen leikkausta on havaittu olevan yhteydessä huonompaan kolorektaalisyövän ennusteeseen (4-9).
aiemmat tutkimukset ovat osoittaneet, että cea: lla oli yhteys syöpäsolujen adheesioon ja synnynnäiseen immuniteettiin kolorektaalisyövässä. Lisäksi CEA: n raportoitiin myös helpottavan paksusuolen syöpäsolujen kiinnittymistä etäpesäkkeisiin ja tukevan kasvaimen etenemistä (10-12).
perinteisesti kasvainsolujen kaukaista leviämistä on pidetty myöhäisenä tapahtumana, mutta useiden aiempien tutkimusten tulokset osoittivat, että metastaattisen potentiaalin saaminen voi tapahtua kasvaimen etenemisen hyvin varhaisessa vaiheessa (13-16). Wo ym. (17) raportoitu, että hyvin pieni kasvain koko mukana imusolmuke positiivisuus voi olla korvike aggressiivinen biologia. Sitten epäilemme, että hyvin varhaisessa vaiheessa peräsuolen syöpä seerumin cea nousu voisi viitata varhainen hankinta metastaattinen potentiaali ja ennustaa erittäin huono eloonjääminen peräsuolen syöpä.
kuitenkin tietojemme mukaan vain harvoissa tutkimuksissa on selvitetty T-vaiheen ja seerumin CEA-tasojen (C0 ja C1) yhteyttä peräsuolen syövän ennusteen määrittämiseen. Siksi teemme tämän suuren väestöpohjaisen tutkimuksen selvittääksemme, voiko hyvin varhainen t-vaihe seerumin CEA: n nousun yhteydessä olla korvike biologisesti aggressiiviselle taudille ja ennustaa peräsuolen syövän huonoa syy-spesifistä selviytymistä (CSS). Poistaaksemme imusolmukepositiivisuuden vaikutuksen tutkimukseemme jätimme sitten pois solmukepositiiviset potilaat ja keskitimme analyysin vaiheen I-II potilaisiin.
potilaat ja menetelmät
Potilaan valinta seuranta -, epidemiologia-ja Lopputulostietokannassa
arvovaltaisena tietolähteenä syövän ilmaantuvuudesta ja eloonjäämisestä Yhdysvalloissa ja kattavana väestöpohjaisen tiedon lähteenä, mukaan lukien kaikki äskettäin diagnosoidut syöpätapaukset seuranta -, epidemiologia-ja Lopputulostietokannassa (SEER) – osallistuvilla alueilla, SEER-tietokanta kattaa noin 28 prosenttia Yhdysvaltain väestöstä. SEER-tietokanta ei sisältänyt tunnisteita, ja se oli julkisesti tutkijoiden saatavilla. SEER*Stat on SEER-ohjelman tarjoama ohjelmisto, jolla saa potilastietoja verkkoyhteyden avulla. Aluksi SEER*Stat-ohjelmiston (SEER*Stat 8.3.5) tapauslistausistunnossa listattiin kaikki potilaskohtaiset tiedot, ja potilaat, joilla diagnosoitiin vaiheen I-II (node–negative) peräsuolisyöpä tammikuun 1.päivän 2004 ja joulukuun 31. päivän 2015 välisenä aikana, tunnistettiin SEER-tietokannasta (Kuva 1). Peräsuolisyöpäpotilaat tunnistettiin ICD-O-3-sivuston koodeilla C199 ja c209 sekä käyttäytymiskoodilla 3 (NAACCR-kohdat 522 ja 523) (9). Valitsimme nämä vuodet mukaan, koska preoperative serum CEA: n tiedot kirjattiin vuodesta 2004 alkaen ja SEER-seuranta päättyi vuonna 2015.

Kuva 1. Potilaskohorttien määritelmien vuokaavio.
tämän jälkeen ne, jotka saivat neoadjuvanttista sädehoitoa, joilla ei ollut positiivista histologista vahvistusta, joiden rotu ei ollut tiedossa, joilla ei ollut adenokarsinooman histologiaa tai joilla ei ollut aktiivista seurantaa, suljettiin pois tutkimuksestamme. Tutkimukseemme otettiin potilaita, joilla oli ennen leikkausta käytettävissä oleva cea-pitoisuus seerumissa, ja ryhmittelimme “positiivinen / kohonnut” ja ” negatiivinen / normaali; normaaleissa rajoissa ” C1 ja C0 (C-vaiheen tiedot). CEA: n raja-arvot olivat 2, 5 ng/ml tupakoimattomilla ja 5 ng/ml tupakoitsijoilla. Lisäksi SEER-tietokannasta haettiin myös seuraavat potilaan klinikanpatologiset muuttujat: t-vaihe, rotu, sukupuoli, kasvaimen sijainti, ikä diagnoosihetkellä, diagnoosivuosi, luokka ja histologia.
tilastollinen analyysi
tässä tutkimuksessa Pearsonin chi-squared-testiä käytettiin vertaamaan kaikkia SEER-tietokannasta haettuja potilaiden klinikopatologisia muuttujia normaalin ja ennen leikkausta kohonneiden seerumin cea-arvojen välillä. Eräät monimuuttujamallit Coxin suhteelliselle riskille on rakennettu tunnistamaan peräsuolen syövän riippumattomia ennustemuuttujia analyyseissämme. Selviytymiskäyrät luotiin Kaplan-Meier-menetelmällä, ja käyrien väliset erot analysoitiin log-rank-testillä. Tässä tutkimuksessa kiinnostuksen ensisijaiset tulokset olivat CSS ja overall survival (os). CSS laskettiin diagnoosin päivämäärästä syöpäkohtaisen kuoleman päivämäärään. Peräsuolisyövän aiheuttamiksi todettuja kuolemia käsiteltiin tapahtumina, ja muista syistä johtuneita kuolemia käsiteltiin sensuroituina havaintoina kuolinpäivänä. Määrittääksemme, oliko css: n ennustamisessa merkittävää vuorovaikutusta preoperatiivisen seerumin cea-tason ja t-vaiheen välillä, määritimme myös vuorovaikutusmuuttujan (t-vaiheen ja seerumin CEA-tason). Kaksipuolista P < 0, 05: tä pidettiin tilastollisesti merkitsevänä. Tilastolliset analyysit tehtiin pääasiassa SPSS-versiolla 22 (IBM Corporation, Armonk, NY, USA).
tulokset
Potilasominaisuudet
kaiken kaikkiaan SEER–tietokannasta tunnistettiin 19 184 potilasta, joilla diagnosoitiin vaiheen I-II peräsuolen syöpä 1.tammikuuta 2004-31. joulukuuta 2015 välisenä aikana (kuvio 1). Näistä potilaista 13 007 (67, 8%) määrättiin C0-vaiheeseen ja 6 177 (32, 2%) C1-vaiheeseen. AJCC-vaiheistusjärjestelmän mukaan T1-vaiheessa oli 6 077 potilasta, T2-vaiheessa 4 783 potilasta, T3-vaiheessa 7 021 potilasta ja T4-vaiheessa 1 303 potilasta. Kaikkiaan 2 560 potilasta (13,3%) kuoli peräsuolisyöpään seuranta-ajan lopussa. Koko kohortin seuranta-ajan mediaani oli 44 kuukautta (0-143 kuukautta). Potilaiden lähtötilanteen ominaisuudet on esitetty yhteenvetona taulukossa 1.
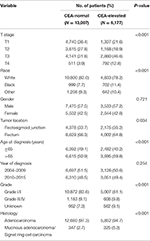
Taulukko 1. Vaiheen I-II peräsuolen syövän lähtötason ominaisuuksien vertailu seerumin karsinoembryoniantigeenin (cea) tasolla.
T1-vaiheen riski parani muihin t-vaiheisiin verrattuna, kun seerumin CEA-tason nousu oli
havaittiin, että C1-vaihe korreloi todennäköisemmin korkeamman T-vaiheen, mustan, rektosigmoidin liitoksen, vanhemman iän, korkeamman asteen ja limaisen adenokarsinooman/Sinettirengassolusyövän kanssa (Taulukko 1, p < 0, 05). Kuten taulukosta 2 käy ilmi, monivariaattisessa Cox-analyysissä otettiin huomioon rotu, sukupuoli, kasvaimen sijainti, ikä diagnoosihetkellä, diagnoosivuosi, Luokka, histologia, t-vaihe ja seerumin cea-taso. Kun monimuuttuja Cox-analyysi tehtiin, vakuutimme seuraavat klinikopatologiset ominaisuudet itsenäisinä ennustetekijöinä vaiheen I–II peräsuolen syövässä; näitä olivat rotu, sukupuoli, kasvaimen sijainti, ikä diagnoosin hetkellä, kasvaimen luokka, T-vaihe ja seerumin cea-taso, kun taas riski välillä T2,C0 ja T1,C0 ei ollut tilastollinen ero (p = 0.925). Seerumin CEA-arvojen kohoamisen yhteydessä T1-vaiheeseen liittyi odottamattoman suurempi riski sairastua peräsuolen syöpään kuin vaiheisiin T2 ja T3. Vaiheen T1 taudissa seerumin CEA-pitoisuuden suurenemiseen liittyi 227, 6%: lla lisääntynyt kuolleisuusriski normaaliin seerumin cea-tasoon verrattuna.

Taulukko 2. Multivariate Cox regression analyses of cause-specific survival (CSS) in stage I–II rektal cancer.
Kaplan-Meier-eloonjäämiskäyrät on piirretty kuviin 2, 3. Viiden vuoden CSS-osuus oli 92, 2% T1C0-ryhmässä, 75, 2% T1C1-ryhmässä, 93, 1% T2C0-ryhmässä, 86, 7% T2C1-ryhmässä, 84, 6% T3C0-ryhmässä, 76, 3% T3C1-ryhmässä, 62, 9% T4C0-ryhmässä ja 43, 6% T4C1-ryhmässä (kuva 2, P < 0, 001). Siksi T1C1: n CSS-luku oli samanlainen 5 vuoden kuin T3C1: n (75, 2 vs. 76, 3%, P = 0, 238). Lisäksi löydös oli vielä selvempi OS: ssa. 5 vuoden OS-korko oli 78, 6% T1C0: ssä, 48, 3% T1C1: ssä, 77, 1% T2C0: ssä, 62, 3% T2C1: ssä, 68, 5% T3C0: ssä, 54, 5% T3C1: ssä, 45, 3% T4C0: ssä ja 30, 0% T4C1: ssä (kuva 3, P < 0, 001). T1C1: n CSS-aste oli huomattavasti pienempi kuin t3c1: n (48, 3 vs. 54, 5%, P < 0, 001).
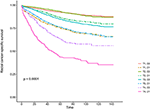
kuva 2. T-vaiheen Kaplan-Meier-syyspesifiset eloonjäämiskäyrät (CSS) yhdistettynä seerumin karsinoembryoniantigeenin (cea) tasoon.
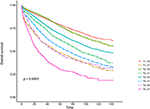
kuva 3. T–vaiheen Kaplan-Meier-kokonaiselinaikakäyrät yhdistettynä seerumin karsinoembryoniantigeenin (cea) tasoon.
ennen leikkausta saavutetun seerumin CEA – korkeuden vaikutus T-vaiheessa
metsäpalsta piirrettiin näyttämään riskisuhteet (HS), jotta CSS: ää voitaisiin verrata normaali-ja kohonneiden CEA-ryhmien välillä vastaavissa t-vaiheissa (Kuva 4). Normaaliin seerumin CEA-tasoon verrattuna vaiheessa T2 kohonnut seerumin CEA-taso liittyi 69, 0%: n kasvuun peräsuolen syöpään liittyvän kuolleisuuden riskiin ; vaiheessa T3 kohonnut seerumin cea-taso liittyi 67, 2%: n kasvuun peräsuolen syöpään liittyvän kuolleisuuden riskiin (HR = 1, 672, 95% CI = 1, 486-1, 882, p < 0, 001); vaiheessa T4 seerumin cea–tason nousuun liittyi 81, 3%: n nousu peräsuolen syöpään liittyvän kuolleisuuden riski (HR = 1, 813, 95% CI = 1, 485-2, 213, P < 0, 001); sen sijaan vaiheessa T1 seerumin CEA: n kohonnut pitoisuus oli jopa 211.6% lisääntynyt riski sairastua peräsuolen syöpään (HR = 3, 116, 95% CI = 2, 639–3, 679, P < 0, 001).
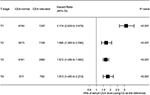
Kuva 4. Syyspesifisen eloonjäämisen (CSS) riskisuhteet (HR) seerumin normaalin ja kohonneen karsinoembryoniantigeenin (cea) välillä T-vaiheen mukaan.
Keskustelu
pyrimme tutkimaan t-vaiheen ja seerumin CEA-tasojen yhteyttä peräsuolisyövän CSS: n määrittämisessä. Oletimme, että peräsuolen syöpä, jossa on hyvin varhainen t-vaihe (vaihe T1) ja seerumin cea-nousu, voi olla biologinen korvike aggressiiviselle taudille, mikä ennustaa huonoa onkologista lopputulosta. Mukana tutkimuksessamme oli noin 20 000 potilasta, joilla oli I–II asteen peräsuolen syöpä.
tässä tutkimuksessa havaittiin, että seerumin CEA-arvojen kohoaminen korreloi todennäköisemmin korkeamman T-vaiheen, mustan, rektosigmoidin liitoksen, vanhemman iän sekä korkeamman asteen ja limaisen adenokarsinooman/Sinettirengassolusyövän kanssa. Kaplan-Meier-eloonjäämisanalyysit osoittivat, että seerumin CEA-arvojen kohoamisen yhteydessä vaiheen T1 5 vuoden CSS-esiintyvyys oli 75, 2%, mikä ei saavuttanut tilastollista eroa vaiheeseen T3 (76, 3%). Kokonaiselossaoloajan osalta vaiheen T1 5 vuoden OS-osuus, kun seerumin CEA-nousu oli ennen leikkausta (48, 3%), oli jopa pienempi kuin vaiheen T3, kun cea-nousu tapahtui (54, 5%), eikä tilastollista eroa saavutettu vaiheeseen T4 (45.3%), eli kohonnut CEA: n seerumitaso ennen leikkausta voisi tunnistaa aliryhmän T1-vaiheen peräsuolisyövistä, joilla on samanlainen CSS kuin joillakin T3-vaiheen sairauksilla ja samankaltainen käyttöjärjestelmä verrattuna joihinkin T4-vaiheen sairauksiin.
määrittämämme interaktiomuuttujan (t-vaihe ja CEA-taso seerumissa) osoitettiin olevan riippumaton peräsuolen syövän ennustetekijä, kun sitä oli mukautettu peräsuolen syövän tunnettujen ennustetekijöiden (rotu, sukupuoli, kasvaimen sijainti, ikä diagnoosihetkellä, diagnosointivuosi, luokka ja histologia) mukaan. Monimuuttuja Cox-analyysi osoitti, että seerumin CEA-arvojen kohoamisen yhteydessä T1-vaiheeseen liittyi odottamattoman suurempi riski sairastua peräsuolen syöpään kuin vaiheisiin T2 ja T3. Vaiheen T1 taudissa seerumin CEA-pitoisuuden suurenemiseen liittyi 227, 6%: lla lisääntynyt kuolleisuusriski normaaliin seerumin cea-tasoon verrattuna. Lisäksi rotu, sukupuoli, kasvaimen sijainti, ikä diagnoosin, ja kasvaimen Luokka tunnistettiin myös riippumattomia ennustavia tekijöitä vaiheen I–II peräsuolen syöpä. T1: n lisäksi havaittiin, että ennen leikkausta seerumin CEA-arvon nousu aiheutti noin 75% suuremman riskin peräsuolisyöpäspesifiseen kuolleisuuteen vastaavassa T-vaiheessa, mutta T1-vaiheessa määrä kasvoi huomattavasti 211, 6%: iin.
vuonna 2000 AJCC: n Kolorektaalityöryhmä ehdotti CEA: n (C-vaiheen) seerumipitoisuuden sisällyttämistä tavanomaiseen AJCC: n TNM-vaiheistusjärjestelmään (18). Lisäksi American Society of Clinical Oncology ja European Group on Tumor Markers ovat molemmat tukeneet preoperatiivisen seerumin cea-tason sisällyttämistä ennustusvälineeksi paksusuolen syövässä (19-21).
useat aiemmat tutkimukset kertoivat seerumin CEA-pitoisuuden olevan vahva ennustava rooli paksusuolen syövässä (4-7, 22-26). Vuonna 2011 Thirunavukarasu et al. (25) ilmoitti, että ennen leikkausta seerumin cea-taso oli itsenäinen ennustava paksusuolen syövän biomarkkeri, ja ennuste oli huonompi potilailla, joilla oli matalampi CEA-aste kuin potilailla, joilla oli korkeampi CEA-aste. Kyseisessä tutkimuksessa korkea CEA arvioitiin jopa yhtä vahvaksi kuin solmupositiivisuus paksusuolisyövän huonojen onkologisten tulosten ennustamisessa.
kuitenkin vain harvat tutkimukset keskittyvät selvittämään seerumin CEA-pitoisuuden ennustavaa roolia peräsuolen syövässä. Vuonna 2016, käyttäen myös SEER-tietokantaa, Tarantino et al. (9, 27) suoritti kaksi laajaa väestöpohjaista tutkimusta, joissa saatiin vakuuttavaa näyttöä siitä, että kohonnut cea-pitoisuus ennen leikkausta ennusti voimakkaasti peräsuolen syövän yleistä ja syöpäperäistä eloonjäämistä huonommin. Vuonna 2018 Liu et al. (8) osoitti, että ennen leikkausta seerumi cea oli itsenäinen peräsuolen syövän ennustava tekijä, ja kohonnut seerumin cea–taso oli ilmeisesti heikompi kuin normaali seerumin cea-taso vaiheissa I-IV.
vaikka tavanomainen osoittaa, että syöpä saa metastaattisen potentiaalin askel askeleelta kasvaessaan suureksi (28), jotkin aiemmat tutkimukset kuitenkin osoittivat, että metastaattisen potentiaalin saaminen voi tapahtua hyvin varhaisessa vaiheessa kasvaimen etenemisessä. Aiempi tutkimus osoitti hyvin pienen kasvaimen koon erittäin heikon selviytymisen, kun se liittyy imusolmukepositiivisuuteen (17). Lisäksi tutkimuksemme tulokset osoittavat, että preoperatiivisen seerumin cea-tason nousu hyvin varhaisessa vaiheessa (vaihe T1) peräsuolisyövässä on yhteydessä erittäin huonoon käyttöjärjestelmään ja CSS: ään ja voi olla aggressiivisen biologian korvike. Uskomme, että sekä imusolmukkeisiin osallistumista että seerumin CEA: n nousua pidetään metastaattisen kyvyn hankkimisena. Meidän tutkimus, yhdistettynä että Wo et al. johdonmukaisesti tukea edellä mainittua ajatusta, että hankinnan metastaattinen potentiaali voisi tapahtua hyvin varhaisessa kasvaimen etenemistä, mikä liittyy huono onkologisen tuloksia, ja alkuperäinen biologinen ominaisuus ovat todennäköisemmin määrittää potentiaalia kaukaisen etäpesäkkeiden aikana syövän etenemisen, eikä kertynyt metastaattinen kyky (29).
lisäksi tutkimuksemme löydöksillä on kliinistä merkitystä. Tällä hetkellä vaiheen I peräsuolen syöpä hoidetaan radikaali kirurginen resektio yksin, koska suhteellisen suotuisa onkologisen tuloksia. Kuitenkin noin 10-15% potilaista kehittää kasvaimen uusiutumisen jälkeen radikaali resektio (30, 31). Tässä tutkimuksessa, satumme tunnistamaan alaryhmä vaiheen T1 peräsuolen syöpä erittäin huono ennuste verrattuna muuhun vaiheen I peräsuolen syöpä, mikä tarkoittaa, että vaiheen T1 peräsuolen syöpä osallistuminen ennen leikkausta seerumin cea nousu pitäisi saada enemmän huomiota onkologit.
tutkimuksessamme on kuitenkin kaksi rajoitusta. Tämä tutkimus ei sisältänyt analyyseissämme eräitä peräsuolisyövän ennustavia tekijöitä, kuten mikrosatelliitin epävakauden tilaa ja leikkauksen jälkeisiä komplikaatioita, joita ei ollut saatavilla SEER-tietokannasta ja jotka saattavat aiheuttaa jossain määrin harhoja. Emme voi antaa CEA: n vaihteluvälejä ja keskiarvoja kummastakaan ryhmästä. Toisaalta tämä tutkimus oli pikemminkin takautuva kuin prospektiivisiin tietoihin perustuva. Siksi tuloksemme on vielä validoitava muissa kohorteissa, erityisesti suurissa prospektiivisissa kliinisissä tutkimuksissa.
johtopäätöksenä tutkimuksemme osoittaa, että T1-vaiheen peräsuolisyöpä, kun se liittyy ennen leikkausta tapahtuvaan seerumin CEA-arvon nousuun, voi olla biologisesti aggressiivisen sairauden korvike ja korreloi epäedulliseen käyttöjärjestelmään ja CSS: ään. Lisäksi tämä alaryhmä peräsuolen syöpä ansaitsee kliinistä huomiota onkologit. Löydöksemme, jos ne validoidaan tulevissa tietokantatutkimuksissa, tarjoaisivat uuden hoitoidean varhaisen vaiheen peräsuolisyöpään.
tiedon Saatavuuslausunto
tätä tutkimusta varten luodut aineistot ovat pyynnöstä vastaavan tekijän saatavilla.
Etiikkalausunto
tämän tutkimuksen potilaat tunnistettiin SEER-tietokannasta, ja hyväksyntä tietojen käytölle saatiin SEER-ohjelmalle toimitetulla pyynnöllä. Institutionaalisen arviointilautakunnan hyväksyntää ei tarvittu, koska SEER-tietokanta on julkisesti saatavilla.
tekijän kannanotot
SW ja WG ovat antaneet merkittävän ja suoran panoksen tähän tutkimukseen ja hyväksyneet sen toimitettavaksi.
eturistiriita
kirjoittajat toteavat, että tutkimus tehtiin ilman kaupallisia tai taloudellisia suhteita, jotka voitaisiin tulkita mahdollisiksi eturistiriidoiksi.
kiitokset
tätä työtä tuki osittain Yanchengin lääketieteen ja teknologian Kehittämissuunnitelmahanke (YK2015075).
1. Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancer in 185 countries. CA Cancer J Clin. (2018) 68:394–424. doi: 10.3322 / caac.21492
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Gold P, Freedman SO. Kasvainspesifisten antigeenien demonstrointi ihmisen paksusuolen karsinomatassa immunologisella toleranssi-ja absorptiotekniikalla. Käyt.Viim. (1965) 121:439–62. doi: 10.1084 / jem.121.3.439
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Goldstein MJ, Mitchell EP. Karsinoembryoninen antigeeni kolorektaalisyöpäpotilaiden lavastuksessa ja seurannassa. Syöpä Sijoittaa. (2005) 23:338–51. doi: 10.1081 / CNV-58878
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Becerra AZ, Probst CP, Tejani MA, Aquina CT, González MG, Hensley BJ, et al. Evaluating the prognostic role of preoperative carinoembryonic antigen levels in colon cancer patients: results from the national cancer database. Ann Surg Oncol. (2016) 23:1554–61. doi: 10.1245 / s10434-015-5014-1
PubMed Abstrakti / CrossRef kokoteksti / Google Scholar
5. Ogata Y, Murakami H, Sasatomi T, Ishibashi N, Mori S, Ushijima m, et al. Kohonnut seerumin karsinoembrioninen antigeenitaso ennen leikkausta voi olla tehokas indikaattori, kun tarvitaan adjuvanttihoitoa toisen vaiheen paksusuolen syövän mahdollisesti parantavan resektion jälkeen. J Surg Onkol. (2010) 99:65–70. doi: 10.1002 / jso.21161
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Quah HM, Chou JF, Gonen M, Shia J, Schrag D, Landmann RG, et al. Korkean riskin vaiheen II paksusuolisyöpää sairastavien potilaiden tunnistaminen liitännäishoitoa varten. Tämä Paksusuolen Peräsuoli. (2008) 51:503–7. doi: 10.1007 / s10350-008-9246-z
PubMed Abstract | CrossRef Full Text / Google Scholar
7. Spindler BA, Bergquist JR, Thiels CA, Habermann EB, Kelley SR, Larson DW, et al. CEA: n sisällyttäminen parantaa riskin ositusta vaiheen II paksusuolisyövässä. J Gastrointest Surg. (2017) 21:770-7. doi: 10.1007 / s11605-017-3391-4
PubMed Abstrakti / CrossRef kokoteksti / Google Scholar
8. Liu Q, Lian P, Luo D, Cai S, Li Q, Li X. Karsinoembryonisen antigeenin yhdistelmä American Joint Committee on Cancer TNM staging system in rektal cancer: a real-world and large population-based study. Onco Tähtää Sinne. (2018) 11:5827–34. doi: 10.2147 / OTT.S171433
PubMed Abstract | CrossRef Full Text / Google Scholar
9. Tarantino I, Warschkow R, Schmied BM, Güller U, Mieth M, Cerny T, et al. CEA: n ennustearvo eloonjäämiselle vaiheen I peräsuolisyövässä: populaatiopohjainen alttiusarvoanalyysi. J Gastrointest Surg. (2016) 20:1213-22. doi: 10.1007/s11605-016-3137-8
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Beauchemin N, Arabzadeh A. Carcinoembryonic antigen-related cell adhesion molecules (CEACAMs) in cancer progression and metastasis. Cancer Metastasis Rev. (2013) 32:643–71. doi: 10.1007/s10555-013-9444-6
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Arabzadeh A, Chan C, Nouvion AL, Breton V, Benlolo S, DeMarte L, et al. Host-related carcinoembryonic antigen cell adhesion molecule 1 promotes metastasis of colorectal cancer. Onkogeeni. (2013) 32:849–60. doi: 10.1038 / onc.2012.112
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Cai Z, Xiao J, He X, Ke J, Zou Y, Chen Y, et al. Hakeminen Uusi prognostinen merkitys preoperative karsinobryonic antigeeni paksusuolen syöpä vastaanottavan kasvaimen resektio: enemmän kuin positiivinen ja negatiivinen. Syövän Biomerkki. (2017) 19:161–8. doi: 10.3233 / CBM-160287
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Engel J, Eckel R, Kerr J, Schmidt M, Fürstenberger G, Richter R, et al. Rintasyövän metastasoitumisprosessi. EUR J Syöpä. (2003) 39:1794–806. doi: 10.1016 / S0959-8049(03)00422-2
PubMed Abstrakti / CrossRef kokoteksti / Google Scholar
14. Hüsemann Y, Geigl JB, Schubert F, Musiani P, Meyer M, Burghart e, et al. Systeeminen leviäminen on rintasyövän varhainen vaihe. Syöpäsolu. (2008) 13:58–68. doi: 10.1016 / J. ccr.2007.12.003
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Podsypanina K, Du YC, Jechlinger M, Beverly LJ, Hambardzumyan D, Varmus H. Siirtämättömien hiiren nisäsolujen Kylvö ja leviäminen keuhkoihin. Tiede. (2008) 321:1841–4. doi: 10.1126 / tiede.1161621
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Schmidt-Kittler O, Ragg T, Daskalakis A, Granzow M, Ahr A, Blankenstein TJ, et al. Piilevistä disseminoituneista soluista avoimeen etäpesäkkeeseen: systeemisen rintasyövän etenemisen geneettinen analyysi. Proc Natl Acad Sci USA. (2003) 100:7737–42. doi: 10.1073 / pnas.1331931100
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Wo JY, Chen K, Neville BA, Lin nu, Punglia RS. Hyvin pienen kasvaimen koon vaikutus syöpäperäiseen kuolleisuuteen solmupositiivisessa rintasyövässä. J Clin Onkol. (2012) 23:32–3. doi: 10.1016 / J.breastdis.2012.01.026
CrossRef Full Text | Google Scholar
18. Compton C, Fenoglio-Preiser CM, Pettigrew N, Fielding LP. American joint committee on cancer prognostic factors consensus conference: colorectal working group. Syöpä. (2015) 88:1739–57. doi: 10.1002 / (SICI)1097-0142(20000401)88:7<1739::tuki-CNCR30>3.0.CO;2-T
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Duffy MJ, van Dalen A, Haglund C, Hansson L, Holinski-Feder E, Klapdor R, et al. Tuumorimarkkerit kolorektaalisyövässä: European Group on Tumor Markers (EGTM) guidelines for clinical use. EUR J Syöpä. (2007) 43:1348–60. doi: 10.1016 / j.ejca.2007.03.021
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Locker GY, Hamilton s, Harris J, Jessup JM, Kemeny N, Macdonald JS, et al. ASCO 2006 update of recommendations for the use of tumor markers in gastrointestinal cancer. J Clin Onkol. (2006) 24:5313–27. doi: 10.1200 / JCO.2006.08.2644
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Duffy MJ, Lamerz R, Haglund C, Nicolini A, Kalousová M, Holubec L, et al. Tumor markers in colorectal cancer, mahasyöpä ja ruoansulatuskanavan stroomal Cancer: European group on tumor markers 2014 guidelines update. Int J Syöpä. (2014) 134:2513–22. doi: 10.1002 / ijc.28384
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Harrison LE, Guillem JG, Paty P, Cohen AM. Preoperatiivinen karsinoembryoniantigeeni ennustaa tuloksia solmunegatiivisilla paksusuolisyöpäpotilailla: monimuuttuja-analyysi 572 potilaasta. J Am Coll Surg. (1997) 185:55-9. doi: 10.1016 / S1072-7515(97)00012-4
PubMed Abstrakti / CrossRef kokoteksti / Google Scholar
23. Huh JW, Oh BR, Kim HR, Kim YJ. Preoperatiivinen karsinoembryonin antigeenitaso itsenäisenä ennustetekijänä mahdollisesti parantavassa paksusuolisyövässä. J Surg Onkol. (2010) 101:396–400. doi: 10.1002 / jso.21495
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Ozawa H, Kotake K, Hosaka M, Hirata a, Nakagawa Y, Fujita s, et al. Seerumin karsinoembryonisten antigeenitasojen liittäminen paksusuolisyövän ennusteelliseen ryhmitysjärjestelmään. Int J Colorrect Tämä. (2017) 32:1–9. doi: 10.1007 / s00384-017-2772-1
PubMed Abstrakti / CrossRef kokoteksti / Google Scholar
25. Thirunavukarasu P, Sukumar S, Sathaiah M, Mahan M, Pragatheeshwar KD, Pingpank JF, et al. C-stage in colon cancer: implications of carinoembryonic antigen biomarker in staging, prognosis, and management. J Natl Cancer Inst. (2011) 103:689–97. doi: 10.1093 / jnci / djr078
PubMed Abstract / CrossRef Full Text | Google Scholar
26. Margalit O, Mamtani R, Yang YX, Reiss KA, Golan T, Halpern n, et al. Arvioidaan karsinoembryonisten antigeenitasojen prognostista arvoa vaiheen I ja II paksusuolen syövässä. EUR J Syöpä. (2018) 94:1–5. doi: 10.1016 / j.ejca.2018.01.112
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Tarantino I, Warschkow R, Worni M, Merati-Kashani K, Köberle D, Schmied BM, et al. Kohonneet preoperatiiviset CEA-arvot ovat yhteydessä huonompaan eloonjäämiseen vaiheen I-III peräsuolen syöpää sairastavilla potilailla. BRJ Syöpä. (2012) 107:266. doi: 10.1038 / bjc.2012.267
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Norton L, Massague J. onko syöpä sairaus itse kylvö? Nat Med. (2006) 12:875–8. doi: 10.1038 / nm0806-875
PubMed Abstract | CrossRef Full Text | Google Scholar
29. Yu KD, Jiang YZ, Chen s, Cao ZG, Wu J, Shen ZZ, et al. Suuren kasvaimen koon vaikutus syöpäperäiseen kuolleisuuteen solmunegatiivisessa rintasyövässä. Mayo Clin Proc. (2012) 87:1171–80. doi: 10.1016 / J. mayocp.2012.07.023
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Blumberg D, Paty PB, Picon AI, Guillem JG, Klimstra DS, Minsky BD, et al. Vaihe I peräsuolisyöpä: riskipotilaiden tunnistaminen. J Am Coll Surg. (1998) 186:574-9; keskustelu: 579-80. doi: 10.1016 / S1072-7515(98)00018-0
PubMed Abstrakti / CrossRef kokoteksti / Google Scholar
31. Gunderson LL, Sargent DJ, Tepper JE, Wolmark N, O’Connell MJ, Begovic m, et al. T-ja N-vaiheen ja hoidon vaikutus eloonjäämiseen ja relapsiin liitännäissyövässä peräsuolen syövässä: yhdistetty analyysi. J Clin Onkol. (2004) 22:1785-96. doi: 10.1200 / JCO.2004.08.173
PubMed Abstract | CrossRef Full Text / Google Scholar