Institute for Creation Research
 yksi suositummista argumenteista, joita on käytetty apinoista oletettavasti kehittyville ihmisille, tunnetaan kromosomifuusiona. Sysäyksenä tälle käsitteelle on evolutiivinen ongelma, että apinoilla on ylimääräinen kromosomipari—ihmisillä niitä on 46 ja apinoilla 48. Jos ihmiset kehittyivät apinamaisesta olennosta vain kolme-kuusi miljoonaa vuotta sitten, mikä oli vain pieni täplä evoluutiokertomuksen suuressa suunnitelmassa, miksi ihmisillä ja apinoilla on tämä ristiriita?
yksi suositummista argumenteista, joita on käytetty apinoista oletettavasti kehittyville ihmisille, tunnetaan kromosomifuusiona. Sysäyksenä tälle käsitteelle on evolutiivinen ongelma, että apinoilla on ylimääräinen kromosomipari—ihmisillä niitä on 46 ja apinoilla 48. Jos ihmiset kehittyivät apinamaisesta olennosta vain kolme-kuusi miljoonaa vuotta sitten, mikä oli vain pieni täplä evoluutiokertomuksen suuressa suunnitelmassa, miksi ihmisillä ja apinoilla on tämä ristiriita?
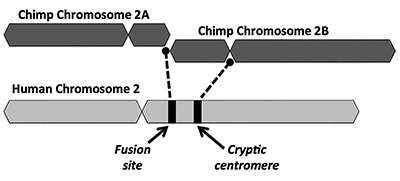
evoluutioratkaisu esittää, että kahden pienen apinamaisen kromosomin (nimiltään 2a ja 2b) päästä päähän-fuusio tuotti ihmisen kromosomin 2 (Kuva 1). Fuusion käsite syntyi ensimmäisen kerran vuonna 1982, kun tutkijat tutkivat mikroskoopilla ihmisen ja apinan kromosomien yhtäläisyyksiä. Vaikka tekniikka oli hieman karkeaa,se riitti ideaan.1
Niin Sanottu Fuusiopaikka
ensimmäinen varsinainen DNA-jälki mahdollisesta fuusiotapahtumasta löydettiin vuonna 1991 ihmisen kromosominumerosta 2.2 tutkijat löysivät pienen, sekavan joukon telomeerimäisiä loppusekvenssejä, jotka epämääräisesti muistuttivat mahdollista fuusiota. Telomeerit ovat kromosomien päissä yhä uudelleen toistuvien DNA-kirjainten ttagg: n kuuden emäsjärjestys.
fuusiosignaali oli kuitenkin jossain määrin arvoitus, joka perustui luonnossa silloin tällöin esiintyviin todellisiin fuusioihin. Kaikki dokumentoidut fuusiot elävissä eläimissä liittyvät tietyntyyppiseen sekvenssiin nimeltä satelliitti-DNA (satDNA), joka sijaitsee kromosomeissa ja löytyy katkoksista ja fuusioista.3-5 ihmisen kromosomissa 2 olevasta fuusiojäljestä puuttui tämä kertova satDNA.6
toinen ongelma on fuusiokohdan pieni koko, joka on vain 798 DNA-kirjainta pitkä. Telomeerijaksot kromosomien päissä ovat 5 000-15 000 emästä pitkiä. Jos kaksi kromosomia olisi fuusioitunut, näkisit fuusioituneen telomeerijäljen, joka on 10 000—30 000 emästä pitkä-ei 798.
sen lisäksi, että pieni koko on fuusiotarinan ongelma, signeeraus ei varsinaisesti edusta telomeerien selvää fuusiota. Kuvassa 2 on 798-emästen fuusiokohdan DNA-kirjaimet ja lihavoidulla printillä korostetut kuuden emästen (DNA-kirjaimen) ehjät telomeerijaksot. Kun fuusiosekvenssiä verrataan samankokoisen koskemattoman fuusiojäljen vastaavaan, se on vain 70-prosenttisesti identtinen.

maalliset tutkijat ovat huomauttaneet tästä ristiriidasta ja ovat leimanneet fuusioalueen merkittävästi “rappeutuneeksi.”7 ottaen huomioon ihmisen evoluution teoreettisen mallin, sen pitäisi olla noin 98-99% identtinen, ei 70%. Tätä löytöä kuvailleet tutkijat kommentoivat: “fuusiokohdassa toistuvien ryhmien päät ovat degeneroituneet merkittävästi (14%) telomeereista löydetyistä lähes täydellisistä (TTAGGG)n ryhmistä” ja esittivät asiaankuuluvan kysymyksen “jos fuusio tapahtui telomeeristen toistuvien ryhmien sisällä alle ~6 Mya, miksi fuusiokohdassa olevat ryhmät ovat niin rappeutuneita?”7 on huomattava, että kirjoittajien mainitsema 14%: n rappeutuminen viittaa vain kuuden emäksen sekvenssien itsensä korruptioon, ei koko 798 emäksen.
fuusion paikka geenin sisällä?
merkittävin anti-evolutiivinen havainto fuusiopaikasta osoittautui olevan sen sijainti ja se, mitä se todellisuudessa tekee. Tämä löytö syntyi, kun luin tutkimuspaperia, – jossa analysoitiin yksityiskohtaisesti 614 000 DNA-sekvenssiä, – jotka ympäröivät väitettyä fuusiokohdetta. Huomasin yhdessä kuvassa, että fuusiopaikka sijaitsi geenin sisällä, – eikä tätä kummallisuutta edes huomattu paperissa.8
tällainen havainto on erittäin huomionarvoinen. Ehkä tämä tieto olisi ollut niin sanotusti naula evoluution arkkuun, minkä vuoksi tutkijat kieltäytyivät keskustelemasta asiasta. Tämä suuri poikkeama inspiroi minua tutkimaan fuusiopaikkaa lähemmin. Tämä paperi julkaistiin vuonna 2002, ja panin sen merkille vuonna 2013. Tällä välin oli julkaistu valtava määrä tietoa ihmisen perimän rakenteesta ja toiminnasta, ja tarinassa oli todennäköisesti paljon muutakin paljastettavaa.
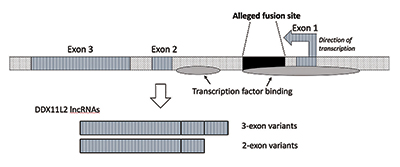
kun tein lisätutkimuksia, varmistin, että fuusiokohta oli sijoitettu RNA-helikaasigeenin sisään, jota kutsutaan nyt DDX11L2: ksi. Useimmilla kasvien ja eläinten geeneillä on koodaussegmenttinsä kappaleina, joita kutsutaan eksoneiksi, joten ne voidaan vaihtoehtoisesti yhdistää toisiinsa. Eksonien lisäämisen tai poissulkemisen perusteella geenit voivat tuottaa monenlaisia tuotteita. Eksonien väliin jääviä alueita kutsutaan introneiksi, jotka sisältävät usein erilaisia geenien toimintaa ohjaavia signaaleja ja kytkimiä. Väitetty fuusiokohta sijaitsee DDX11L2-geenin ensimmäisen intronin sisällä (kuva 3).9
DNA-molekyyli on kaksijuosteinen, jossa on plus-juoste ja miinus-juoste. Se suunniteltiin tällä tavalla maksimoimaan informaatiotiheys ja samalla lisäämään tehokkuutta ja toimintaa. Tämän seurauksena vastakkaisilla säikeillä on eri suuntiin juoksevia geenejä. Kuten käy ilmi, DDX11L2-geeni on koodattu miinusjuosteeseen. Koska geenit ihmisillä ovat kuin Sveitsin armeijan veitset ja voivat tuottaa erilaisia RNAs, ddx11l2-geenin tapauksessa se tuottaa lyhyitä variantteja, jotka koostuvat kahdesta eksonista ja pitkiä variantteja, joissa on kolme (kuva 3).9
Fuusiopaikka on geenin promoottori
mitä tämä DDX11L2-geeni mahtaa tehdä? Tutkimukseni mukaan sitä esiintyy ainakin 255 eri solu-tai kudostyypissä.9 Se on myös co-ilmentynyt (päällä samaan aikaan) useiden muiden geenien kanssa ja on yhteydessä prosesseihin, jotka liittyvät solujen signalointiin solunulkoisessa matriisissa ja verisolujen tuotannossa. Niin kutsutun fuusiosekvenssin sijainti funktionaalisen geenin sisällä, joka liittyy erilaisten soluprosessien genetiikkaan, kumoaa vahvasti ajatuksen, että kyseessä olisi päästä päähän-telomeerisen fuusion sattumanvarainen sivutuote. Geenit eivät muodostu katastrofaalisista kromosomifuusioista!
Vielä hämmästyttävämpää on, että fuusioalue on itsessään toimiva ja palvelee tärkeää suunniteltua tarkoitusta. Sivusto toimii itse asiassa kytkimenä geenien toiminnan ohjaamiseen. Tässä suhteessa runsaasti biokemiallista tietoa osoitti, että 12 erilaista proteiinia, joita kutsutaan transkriptiotekijöiksi, säätelevät tätä geenin segmenttiä. Yksi näistä on RNA polymeraasi II, tärkein entsyymi, joka kopioi RNA-molekyylejä DNA: sta prosessissa, jota kutsutaan transkriptioksi. Tätä havaintoa tukee myös se, että varsinainen transkriptioprosessi alkaa niin sanotun fuusioalueen alueella.
teknisesti kutsuisimme väitetyn fuusioalueen toimintaa promoottorialueeksi. Promoottorit ovat geenien alussa pääkytkimiä, jotka käynnistävät ne, ja niissä myös RNA-polymeraasi alkaa muodostaa RNA: ta. Monilla geeneillä on vaihtoehtoisia promoottoreita, kuten DDX11L2-geeni.
DDX11L2-geenissä on itse asiassa kaksi transkriptiotekijän sitoutumisaluetta. Ensimmäinen on promoottorissa suoraan ensimmäisen eksonin edessä ja toinen on ensimmäisessä intronissa, joka vastaa fuusiopaikkasekvenssiä. Sen lisäksi, että DDX11L2-geeni itsessään on monimutkainen, väitetyllä fuusiosekvenssillä on keskeinen rooli, myös tuotetut RNA-transkriptit ovat hyvin monimutkaisia. Rnat itsessään sisältävät monenlaisia sitoutuminen-ja kontrollipaikkoja microRNAs-nimiselle pienten säätelymolekyylien luokalle.9
toiminnallisia sisäisiä Telomeerisekvenssejä on kaikkialla genomissa
sisäisesti sijaitsevaa telomeerisekvenssiä on kaikkialla ihmisen genomissa. Näitä näennäisesti Out-of-place-telomeerejä on kutsuttu interstitiaalisiksi telomeereiksi. Näiden sekvenssien läsnäolo on toinen haaste fuusiopaikkaidealle. Fakta on, että vain harva telomeeri toistuu fuusiokohdassa samanaikaisesti. Kuten kuvassa 2 todetaan, 798-kantaisen fuusiokohdan sekvenssi sisältää vain muutamia tapauksia, joissa kaksi toistoa on todellisuudessa tandemina, eikä yksikään, jossa on kolme toistoa tai enemmän. Ihmisen perimässä on kuitenkin monia muitakin interstitiaalisia telomeeripaikkoja, joissa toistuminen tapahtuu täydellisenä tandemina kolmesta kymmeneen kertaa tai enemmän.10-11
senkin lisäksi, että niillä on rooli kromosomien päissä, näyttää siltä, että interstitiaalisilla telomeerisilla toistoilla voi olla tärkeä tehtävä geenien ilmentymiseen liittyvässä genomissa. Eräässä tutkimushankkeessa tunnistin telomeerien toistuvan kaikkialla ihmisen genomissa ja leikkasin sitten niiden genomipaikat moninaisilla tietokokonaisuuksilla, jotka sisälsivät funktionaalista biokemiallista tietoa geenien toimintaa varten.12 kirjaimellisesti tuhannet sisäiset telomeeriset toistot genomissa liittyivät suoraan geeniekspression tunnusmerkkeihin. Samantyyppistä transkriptiotekijän sitoutumista ja väitetyssä fuusiokohdassa esiintyvää geenitoimintaa esiintyi genomin laajuisesti myös lukuisissa muissa interstitiaalisissa telomeerisissä toistoissa. Nämä DNA-piirteet eivät selvästikään ole evoluution sattumia, vaan tarkoituksellisesti ja älykkäästi suunniteltua toiminnallista koodia.
tekaistu kryptinen Centromere geenin sisällä
toinen keskeinen ongelma fuusiomallissa on se, ettei ylimääräisen centrome-alueen allekirjoituksesta ole pitäviä todisteita. Sentromeerit ovat kromosomien sektioita, usein keskeisissä paikoissa, joilla on keskeinen rooli solunjakautumisen aikana. Kuten kuvassa 1 on kuvattu, vastamuodostuneella kimeerisellä kromosomilla olisi ollut kaksi centromeeria välittömästi kahden kromosomin väitetyn pään ja pään välisen fuusion jälkeen. Tällöin toinen sentromeereista olisi toimintakykyinen, kun taas toinen olisi pois käytöstä. Kahden aktiivisen sentromeerin esiintyminen on huono uutinen kromosomeille ja johtaisi toimintahäiriöihin ja solujen tuhoutumiseen.
mielenkiintoista on, että ihmisen kromosomissa 2 olevan kryptisen (vammaisen) centromeerin todistusaineisto on vielä heikompi kuin telomeeripitoisen fuusiokohdan. Evolutionistit selittävät selvästi erotettavan epäfunktionaalisen sekundaarisen centromeerin puuttumisen väittämällä, että toinen centromere olisi valittu nopeasti vastaan. Sen jälkeen, vammaiset centromere olisi heikentynyt ajan myötä, koska ei ollut toiminnallisia rajoituksia asetetaan sitä enää sen tekee jotain hyödyllistä genomissa.
kuitenkin todisteet toisen jäännöksen sentromeerista missä tahansa sekvenssin degeneraation vaiheessa ovat ongelmallisia evolutionaarisen paradigman kannalta. Funktionaaliset centromere-sekvenssit koostuvat toistuvasta DNA-tyypistä, jota kutsutaan alfoidiseksi sekvenssiksi, ja jokainen alfoidinen toisto on noin 171 emästä pitkä. Jotkut alfoidiset toistot ovat kaikkialla genomissa, kun taas toiset ovat spesifisiä sentromeereille. Ihmisen kromosomi 2: n kryptisestä centromeeripaikasta löydettyjen sekvenssien rakenne ei vastaa funktionaalisten centromeerien rakennetta.13 vielä pahempi evolutiivisen mallin kannalta on se, että niillä ei ole simpanssien genomissa kovin samanlaisia vastineita—ne ovat ihmiskohtaisia.13
myös väitetty fossiilinen centromere on poikkeuksellisen pieni verrattuna todelliseen. Tavallisen ihmisen centromeerin koko vaihtelee pituudeltaan 250 000-5 000 000 emästä.14 väitetty kryptinen centromere on vain 41,608 emäkset pitkä, mutta on myös tärkeää huomata, että on olemassa kolme eri alueilla, jotka eivät ole edes alpho toistaa.15 näistä kahta kutsutaan retroelementeiksi, joista toinen on LPA3 / LINE repeat 5,957 emästä pitkä ja toinen SVA-E-elementti, jossa on 2,571 emästä. Kun vähennämme näiden ei-alfoidisten sekvenssien insertiot, saadaan pituudeksi vain 33 080 emästä, mikä on murto-osa todellisen centromeerin pituudesta.
fossiilisen centromeerin idean vakavin evolutiivinen ongelma on kuitenkin se, että se on väitetyn fuusiokohdan tavoin sijoitettu geenin sisään. Väitetty kryptinen centromere sijaitsee ANKRD30BL-geenin sisällä, ja sen sekvenssi ulottuu sekä geenin intronialueille että eksonialueille.12,15
itse asiassa se osa fossiilisesta sentromeerisekvenssistä, joka laskeutuu eksonin sisään, itse asiassa koodaa syntyvän geenin proteiinin aminohappoja. Geeni tuottaa proteiinia, jonka uskotaan osallistuvan solun sisällä olevan rakenteellisen proteiiniverkoston, sytoskeletonin, vuorovaikutukseen solukalvoon upotettujen reseptoriproteiinien kanssa.16 se, että niin kutsuttu fossiilinen tai kryptinen centromere on funktionaalinen alue tärkeän proteiinia koodaavan geenin sisällä, kumoaa täysin ajatuksen, että se olisi kuollut centromere.
johtopäätös: Ei fuusiota
väitettyjen fuusio-ja fossiilisten centromere-kohteiden sekavien allekirjoitusten ja pienen koon vuoksi on erittäin kyseenalaista, että niiden sekvenssi olisi evolutionaalisesti johdettu muinaisesta kromosomifuusiosta. Lisäksi ne edustavat funktionaalista sekvenssiä geenien sisällä. Väitetty fuusiokohde on tärkeä geneettinen kytkin, jota kutsutaan promoottoriksi DDX11L2: n pitkän koodaamattoman RNA-geenin sisällä, ja niin sanottu fossiilinen centromere sisältää sekä koodausta että koodaamattomuutta suuren ankyriinin toistuvaa proteiinia koodaavan geenin sisällä.
tämä on kiistaton kaksoisisku koko myyttistä fuusioajatusta vastaan tuhoten sen pätevyyden täysin. Ylivoimainen tieteellinen johtopäätös on, että fuusiota ei koskaan tapahtunut.
- Yunis, J. J. ja O. Prakash. 1982. The origin of man: a chromosomal pictorial legacy. Tiede. 215 (4539): 1525-1530.
- Ijdo, J. W. ym. 1991. Ihmisen kromosomin 2 alkuperä: esi-isien telomeerien ja telomeerien fuusio. Proceedings of the National Academy of Sciences. 88 (20): 9051-9055.
- Chaves, R. et al. 2003. Molecular cytogenetic analysis and centromeric satellite organization of a novel 8;11 translocation in sheep: a possible intermediate in biarmed chromosome evolution. Nisäkkäiden Perimä. 14 (10): 706-710.
- Tsipouri, V. et al. 2008. Vertailevat sekvenssianalyysit paljastavat esi-isien kromosomien fuusioitumispaikat Intian muntjacin genomissa. Genomibiologia. 9 (10): R155.
- Adega, F., H. Guedes-Pinto ja R. Chaves. 2009. Satelliitti DNA karyotype evoluutio kotieläinten-kliiniset näkökohdat. Sytogeneettistä ja Genomitutkimusta. 126 (1-2): 12-20.
- Tomkins, J. P. ja J. Bergman. 2011. Telomeres: implications for aging and evidence for intelligent design. Journal of Creation. 25 (1): 86-97.
- Fan, Y. et al. 2002. Genomirakenne ja esi–isien kromosomien Fuusiokohdan kehitys 2q13-2q14.1: ssä ja Halvaantuneilla alueilla muissa ihmisen kromosomeissa. Genomitutkimus. 12 (11): 1651-1662.
- Fan, Y. et al. 2002. Ihmisen kromosomissa 2q13–2q14.1 ja Halvaantuneilla alueilla olevan esivanhempien kromosomien Fuusiokohdan geenisisältö ja toiminta. Genomitutkimus. 12 (11): 1663-1672.
- Tomkins, J. P. 2013. Väitetty ihmisen kromosomi 2: n “Fuusiokohta” koodaa aktiivisen DNA: ta sitovan domeenin monimutkaisen ja voimakkaasti Ilmentyvän geenejä kieltävän fuusion sisällä. Answers Research Journal. 6: 367-375.
- Azzalin, C. M., S. G. Nergadze ja E. Giulotto. 2001. Ihmisen intrakromosomaalinen telomeerinen toistuu: sekvenssin organisaatio ja alkuperämekanismit. Kromosomi. 110: 75-82.
- Ruiz-Herrera, A. et al. 2008. Telomeeri toistuu kaukana ääripäistä: alkuperän mekanismeista ja roolista evoluutiossa. Sytogeneettistä ja Genomitutkimusta. 122 (3-4): 219-228.
- Tomkins, J. P. 2018. Kombinatoriset genomitiedot kumoavat ihmisen kromosomi 2: n evolutionaarisen fuusion ja rakentavat funktionaalisen suunnittelun mallin interstitiaalisille telomeerisille toistoille. Vuonna Proceedings of the Eighth International Conference on Creationism. J. H. Whitmore, toim. Pittsburgh, PA: Creation Science Fellowship, 222-228.
- Tomkins, J. and J. Bergman. 2011. The chromosome 2 fusion model of human evolution-part 2: re-analysis of the genomic data. Journal of Creation. 25 (2): 111-117.
- Aldrup-Macdonald, M. E. ja B. A. Sullivan. 2014. Ihmisen Centromere-genomiikan menneisyys, nykyisyys ja tulevaisuus. Geenit (Basel). 5 (1): 33-50.
- Tomkins, J. P. 2017. Debunkers: a Response to Criticism and Obfuscation Regarding Refutation of The Human Chromosome 2 fuusio. Answers Research Journal. 10: 45-54.
- Voronin, D. A. ja E. V. Kiseleva. 2008. Ankyriiniä sisältävien proteiinien toiminnallinen rooli toistuu. Solu-ja Kudosbiologia. 49 (12): 989-999.
* Dr. Tomkins On Life Sciences Johtaja Institute for Creation Research ja suoritti Ph. D. genetics Clemson University.