kloridi-ionikanavat ja-kuljettajaproteiinit: ihmisen sairauksien kuriositeeteista huumekohteisiin
Posted: 20 elokuu 2013 | |
perustutkintokoulutuksensa alussa opiskelija tutustuu erilaisiin integraalisiin kalvoproteiineihin: reseptoreihin, adheesioproteiineihin, ionikanaviin, ionipumppuihin ja ioninkuljettajiin. Kun he edistyvät tutkimuksissaan, he saavat selville, että diskreetit geeniperheet ja proteiinirakenteet ovat vastuussa näistä eri proteiiniluokista, eikä ole koskaan mitään syytä ajatella, että olisi mitään epäselvyyttä määrittää jokin tietty proteiini sen sopivaan proteiiniluokkaan.
tämä täyttää käytännössä jokaisen tapauksen luokkahuoneesta tutkimuslaboratorioon, kunnes tarkastellaan kloridikanavia. Tiedämme, että ne ovat olemassa, että ne ovat tärkeitä ja että ne voivat olla hyviä lääkekohteita useilla tautialueilla, mutta viime aikoihin asti ne ovat pysyneet jossain määrin leimattuina ja epämuodikkaina hoitomaailmassa. Valikoivien ligandien puuttuminen ei ole auttanut yhtään. Ainoa poikkeus tähän on ollut GABA-a-reseptori, joka on kytketty luontaiseen kloridikanavaan, joka avautuu estävän välittäjäaineen GABA: n sitoutuessa. Bentsodiatsepiinit ovat voimistaneet tätä reseptoria siitä lähtien, kun Valium tuli saataville 1960-luvulla, ja sillä on sedatiivisia ja antikonvulsantteja antavia vaikutuksia. Tämä esittelee tärkeän käsitteen: on olemassa useita geeniperheitä ja erilaisia proteiinityyppejä, joita voidaan kuvata kloridikanaviksi.
tämä on vastakohta sille, mitä ymmärrämme kationiselektiivisistä ionikanavista, joissa proteiinirakenteessa on vain vähän joustavuutta, joka voi muodostaa kalium -, natrium-tai kalsiumselektiivisen huokosen; näiden ionikanavien moninaisuus johtuu avaus-sulkeutumiskäyttäytymiseen vaikuttavista proteiinidomeenien vaihteluista. Rehellisesti sanottuna ei näytä olevan monia fysiologisia syitä sille, miksi anionikanavan pitäisi olla kloridiselektiivinen, koska sillä ei ole juurikaan fysiologista roolia muiden halidien tai pienten anionien kalvokuljetuksessa; mikä tahansa anionikanava on fysiologiselta kannalta lähtökohtaisesti kloridikanava. Toisaalta kalium -, natrium-ja kalsiumkalvovirroilla on kullakin erilainen perustehtävä, ja selektiivinen kalvon läpäisevyys näille kationeille on ratkaisevaa solujen toiminnan ja itse elämän kannalta.
GABA-a-reseptorit kuuluvat kyssilmukan pentameerisiin ligandi-aidattuihin ionikanavaperheisiin, joihin kuuluu useita erilaisia eksitatorisia ja inhibitorisia neurotransmitteri-aidattuja kanavia. Kystinen fibroosi transmembrane regulator (CFTR)-proteiini on nukleotidisäädelty kloridikanava. Se kuuluu monimuotoiseen ATP: tä sitovaan kasettiperheeseen (ABC) ja on ainoa, joka ei näytä kuljettavan mitään substraattia kalvon yli, vaan toimii pikemminkin kloridikanavana. Jännitekloridikanavien CLC-perhe syntyy toisesta erillisestä geeniperheestä, ja sen yleinen rakenne on ainutlaatuinen kalvoproteiinien joukossa. Tämä proteiiniperhe on tuonut monia yllätyksiä viimeisten 30 vuoden aikana ja tämän perheen jäseniä esitellään täällä ja myös miten heitä voidaan pitää huumeiden kohteina.
muita jännittäviä kehitysvaiheita kloridikanavakentästä on tullut esiin kalsiumaktivoitujen kloridikanavien (ClCa) taustalla olevien proteiinien molekyylitason tunnistamisen jälkeen. Toiminnallisesti olemme tienneet niiden fysiologisista rooleista jo jonkin aikaa, mutta kanavaproteiinien viimeaikainen molekyylitunnistus on mahdollistanut molekyylisten ja farmakologisten työkalujen kehittämisen niiden toiminnan tutkimiseksi ja muuttamiseksi. Tässä katsauksessa keskitytään clca-kanaviin ja CLC-proteiineihin kohdistuvien farmakologisten mahdollisuuksien tarkasteluun; niiden funktio ja solujen lokalisaatio esitetään lyhyesti kuviossa 1.
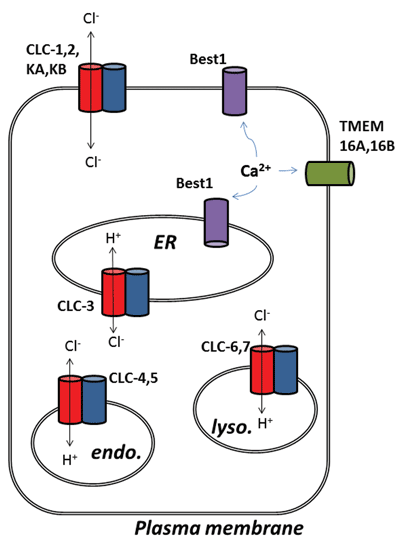
Kuva 1
johdatus CLC-proteiineihin
tämän proteiiniperheen yhdeksän jäsentä ovat CLC-1-7, CLC-KA ja KB. Perustajajäsen, CLC-1, on luurankolihasten jänniteporttinen kloridikanava ja sitä käsitellään jäljempänä. Monia funktionaalisia tutkimuksia on tehty CLC-0-arvonimellä varustetulle homologille, joka on eristetty Elektroplax – sähköelimestä, jonka avulla rausku voi tainnuttaa vedessä elävät uhrinsa. CLC-0: n ennallistaminen lipidikerroksiksi ja yksittäisten ionikanavien läpi virtaavien virtojen elektrofysiologinen tallentaminen paljastivat kiehtovan ominaisuuden. Yleensä tallennettaessa virtaa pienestä kalvolaastarista, jossa on yksi ionikanava, havaitaan vaihteluita kahden virran amplitudin välillä: toinen edustaa suljettua kanavaa ja toinen avoimen kanavan läpi virtaavaa virtaa. Vaihtelut heijastavat siirtymiä avoimen ja suljetun kineettisen tilan välillä. CLC-0: n kohdalla oli kuitenkin selvää, että yksi ionikanavaproteiini koostui kahdesta vastaavasta huokoisesta, jotka voivat avautua itsenäisesti1. Tämän vuoksi kanavaa kuvailtiin kaksipiippuiseksi (kuva 2). Näin ollen ei tullut suurena yllätyksenä, että enteeristen bakteerien homologien kiderakenteet paljastivat, että proteiinikompleksi oli dimeeri, ja jokaisella alayksiköllä oli Ionia johtava polku2 (kuva 2).
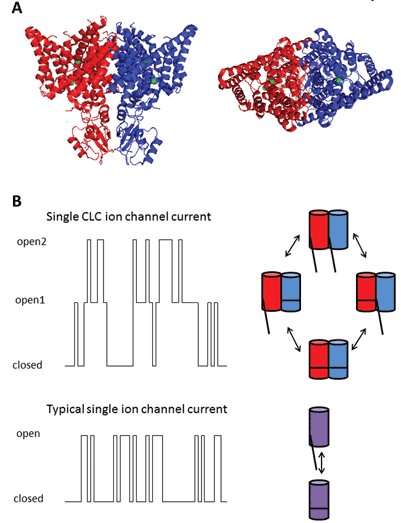
kuva 2
toinen yllätys syntyi, kun E. coli-bakteerin CLC-ec1: llä tehtiin yksityiskohtaisia funktionaalisia kokeita. Sen sijaan, että CLC-ec1 toimisi kloridikanavana, kuten sen kauan kadoksissa ollut sukulainen selkärankaisten luurankolihaksissa, se on 2cl-/H+–vaihtokuljettaja eli antiporteri, jolla on tiukka 2:1-vaihtostoikiometria3. Tämä proteiini on tärkeä enterobakteerien eloonjäämiselle alhaisessa pH4: ssä ja todennäköisesti käyttää hyväkseen kloridigradienttia pitääkseen solujen pH: n siedettävällä tasolla. Prokaryoottiset KLC: t voivat siten olla patogeenisen E. coli-tai Salmonella-infektoinnin estäjien kohteita4. Ioninvaihtokäyttäytymisen löytyminen luonnollisesti kannusti lisätoimiin sen määrittämiseksi, esiintyikö nisäkkäiden CLCs-bakteereissa mitään tällaista kloridi-protoni–vaihtoa, olettaen, että CL – /H+ – vaihto saattaa olla arkkityyppisten CLCs-yhdisteiden todellinen funktio ja kloridikanaviksi tunnistetut saattavat olla vain poikkeuksia säännöstä. Näin näyttää olevan, koska on olemassa vahvaa näyttöä siitä, että CLC-3: sta CLC-7: ään toimivat 2cl–/H+-vaihtokuljettajina, jotka asuvat pääasiassa solunsisäisissä organelleissa, kun taas CLC-1, CLC-2, KA ja KB ovat todellisia plasmakalvokloridia johtavia ionikanavia 5-9. Koska arkkityyppisen CLC: n ominaisuus on vaihtokuljetus, jota esiintyy kaikissa soluelämän muodoissa, jälkimmäistä proteiinien alaluokkaa, bona fide kloridikanavia, voidaan siis pitää “rikkinäisinä” kloridinkuljettajina, jotka ovat menettäneet kloridinkuljetuksen kytkennän toisen substraatti-ionin liikkeeseen.
CLC-1
tämä CLC-perheen perustaja on luurankolihaksen jännitesuojattu kloridikanava, joka säätelee kalvopotentiaalia ja repolarisoi kalvoa sen jälkeen, kun lihas rentoutuu. Useimmissa kudoksissa odotamme kaliumkanavien olevan tässä roolissa, mitä ne tekevät sydän-ja sileälihaksissa sekä säätelevän kalvon excitability muissa solutyypeissä. Poikittainen tubulusjärjestelmä on plasmakalvon (sarkolemma) jatke ja tunkeutuu supistumiskudokseen. Se on kriittinen sähköisen toiminnan nopealle leviämiselle koko lihaksessa ja orkestroi nopeaa ja hallittua supistumista. Kaliumin poistuminen lihassoluista t-tubuluksen ahtaaseen tilaan nostaisi solunulkoista kaliumpitoisuutta ja romahduttaisi tämän ionigradientin, mikä johtaisi pitkittyneeseen kalvon depolarisaatioon. Kloridikanavilla on hallitseva repolarisoiva rooli, joten tämä estetään. CLC-1: n funktiomutaatioiden häviäminen johtaa myotoniaan ihmisellä, vuohilla ja hiirillä (tuoreessa katsauksessa KS.10), ja sille on ominaista heikentynyt lihasrelaksaatio, joka on sopusoinnussa repolarisoivan kalvovirran häviämisen kanssa.
KLC-1 saattaa olla houkutteleva kohde lääkkeille, jotka hillitsevät lihasten supistumista lisäämällä tai vähentämällä KLC-1: n toimintaa ja siten vähentävät tai lisäävät lihasten kiihtyvyyttä. CLC-1: n toimintaa lisäävät yhdisteet voisivat ehkä hoitaa myotoniaa erityisesti silloin, kun ne voisivat kompensoida kloridikanavaaktiivisuuden osittaista menetystä. CLC-1: n esto voi alentaa lihasten supistumisen kynnystä ja se voi olla hyödyllinen lihasheikkouden tai rappeuttavien sairauksien, kuten lihasdystrofian, yhteydessä.
CLC-2
sisäänpäin vetäytyvässä kloridikanavassa, CLC-2: ssa, on jonkin verran laajaa kudosjakautumista. Sitä löytyy keskushermosoluista, joissa se säätelee hermosolujen toimintaa 11-13. Astrosyyteissä sen subsellulaarista kohdentumista soluliitoksiin säätelee vuorovaikutus Glialkaamin (MLC1) kanssa, mutaatiot, jotka häiritsevät tätä kohdentamista ja aiheuttavat megalenkefalista leukoenkefalopatiaa14. Viimeaikaiset terapeuttiset intressit liittyvät CLC-2 ilmentyminen suolen limakalvon ja keuhkojen keuhkoputkia, jossa sillä on rooli suoliston ja keuhkojen eritteiden, vastaavasti. Lubiprostone-nimistä lääkettä, jota käytetään kliinisesti ummetuksen lievittämiseen, ehdotettiin käyttämään sen vaikutusta aktivoimalla CLC-2: ta, mutta tämä vaikutus on kiistanalainen. Vaikka tämä yhdiste aktivoi CLC-2-kanavia joissakin tutkimuksissa, toisissa se säätelee CLC-2-salakuljetusta ja lisää CFTR-toimintaa prostaglandiinireseptorin aktivaatiolla 15,16. On kuitenkin vielä riittävästi näyttöä siitä, että lisääntyvä hengitysteiden CLC-2-toiminto voisi tarjota vaihtoehtoisen kloridireitin kystiseen fibrosis17: ään.
CLC-KA/KB
nämä kloridikanavat ilmenevät erityisesti munuaisten epiteeleinä ja edistävät solukalvojen läpäisevyyttä passiiviseen kloridivuotoon. Ne ovat avainasemassa nefronin nousevassa raajassa ja distaalisissa tubuluksissa, jotka tarjoavat basolateraalisen reitin kloridin takaisinimeytymiselle sen jälkeen, kun se on kulkeutunut primaarisesta virtsasta apikaalikalvon kautta. CLCKB-geeni, joka koodaa CLC-KB: tä, on yksi viidestä bartterin oireyhtymän taustalla olevasta geenistä. CLC-KB: n toimintakyvyttömät mutaatiot johtavat vialliseen kloridin takaisinimeytymiseen ja johtavat siten suolaantumishäiriöön, joka liittyy polyuriaan. Yksi CLC-KB-mutaatioiden (Bartterin tyyppi III) vaikuttamien yksilöiden pääpiirteistä on alhainen verenpaine. Taudin vakavampi muoto johtuu mutaatioista bsnd-geenissä (Bartterin tyyppi IV), joka koodaa Bartin, joka on sekä CLC-KA: n että KB: n salakuljetuksessa tärkeä lisäproteiini plasmamembrane18: aan. Tähän häiriön muotoon kuuluu myös aistinvarainen kuurous, jonka arvellaan johtuvan sekä CLC-KA: n että KB: n ihmiskaupan häviämisestä sisäkorvan epiteelikalvoille. Oletettavasti kuulojärjestelmä voi sietää joko CLC-KA: n tai KB: n aktiivisuuden menetystä, mutta ei molempia. Tämä viittaa siihen, että joko CLC-KA: lle tai CLC-KB: lle selektiiviset estäjät tai molempien osittainen esto voivat toimia uutena loop-diureettina, joka voi alentaa verenpainetta ja jolla on vain vähän sivuvaikutuksia. Tämä on johtanut niiden farmakologian tutkimiseen ja uusien inhibiittorijohdannaisten kehittämiseen, joilla on alhainen mikromolaarinen affiniteetti19, jolla oli diureettisia vaikutuksia, kun sitä annettiin rats20: lle. Toisaalta CLC-KB-kanavia aktivoivat lääkkeet saattavat lisätä viallisten kanavien jäännösaktiivisuutta Bartterin tyypin III potilailla.
CLC-7
2cl–/H+ exchange transporter-alaluokasta CLC-7 on lupaava lääkeintensiivinen kohde, ja sen estosta saattaa olla hyötyä osteoporoosissa. Jälleen kerran tämä käyttöaihe on saanut alkunsa havainnoista, jotka koskevat ihmisen sairauksia, jotka johtuvat CLC-7: n toimintakyvyttömistä mutaatioista, jotka aiheuttavat osteropetrosis21: tä. Tässä häiriössä osteoklastien luunmuodostus on puutteellista, minkä arvellaan johtuvan puutteellisesta hapon ja entsyymien erityksestä. Tämä johtaa tiheään luuhun,joka voi CLC-7-inhibiittorin jäljentämänä vähentää luun liukenemista ja siten vahvistaa osteoporoosipotilaiden luurankoa22, 23. Proof-of-concept-tutkimuksissa farmakologinen happifikaation esto24 tai antibodies25: n aiheuttama CLC-7: n toiminnan häiriintyminen vähensi luun resorptiota. CLC-7: n esto ei kuitenkaan välttämättä ole ilman komplikaatioita, koska ihmisillä ja hiirillä tehdyt tutkimukset viittaavat siihen, että CLC-7: n toiminnan puutteeseen voi liittyä myös hermosolujen varastoimis-ja degeneraatiohäiriöitä, jotka johtuvat lysosomaalisen toiminnan heikkenemisestä 26.
Loss-of-function human mutations – lessons from CFTR
tässä vaiheessa on syytä pitää pieni tauko, jotta voidaan ottaa huomioon, että joidenkin uusien CLC-kohdennettujen lääkkeiden käyttöaiheiden tarkoituksena on hoitaa häiriöitä, jotka ovat erillisiä ja spektrin vastakkaisessa päässä kuin ne, jotka johtuvat CLC: n viallisesta toiminnasta. Edellä kuvattujen lisäksi Dentin I-tauti on X-linkitetty munuaissairaus, joka johtuu CLC-5: n toiminnan menetyksestä (katso tuore katsaus27). Kaikki ovat harvinaisia perinnöllisiä sairauksia ja merkittävä proteiinivirhe liittyy joko vähentynyt proteiinin aktiivisuus tai salakuljetus kohdekalvoon. Itse asiassa monet yksittäiset mutaatiot aiheuttavat ER-retentiota ja proteiinin kypsymisen puutetta. Kystisen fibroosin kanssa voidaan tehdä rinnakkaisuus, ja suurimmalla osalla sairastuneista yksilöistä on ER-säilyttänyt ΔF508-mutaation. Viimeaikaiset ja kerrostuneet lähestymistavat kystisen fibroosin hoitoon ovat johtuneet kaksihaaraisesta hyökkäyksestä mutanttiproteiinin taittumisen korjaamiseksi (CF correctors) ja/tai plasmakalvon CFTR-kloridikanavien aktiivisuuden lisäämiseksi (CF-potentiaattorit). Potentiaattori class28 on osoittautunut tehokkaaksi potilailla, joilla on mutaatioita, jotka vähentävät CFTR-aktiivisuutta ilman proteiinin biosynteesin tai ihmiskaupan menetystä (esim.G551D), mutta taittokorjaajien tehokkuus (joka on tarpeen useimmissa tapauksissa) on vielä vahvistamatta 29. Vaikka CLC-toiminnan menetykseen liittyvät sairaudet ovat kaikki harvinaisia geneettisiä sairauksia, voimme jonain päivänä hoitaa myotoniaa, Bartterin oireyhtymää, dentin tautia ja osteopetroosia sekä kystistä fibroosia lääkkeillä, jotka korjaavat niiden häiriön todellisen syyn.
lopuksi mainitaan kalsiumaktivoidut kloridikanavat (ClCa), joilla on selvästi määritelty fysiologinen rooli useissa solutyypeissä, mutta niiden molekyylitunnistus kärsi muutamasta väärästä ja änkyttävästä alusta. Tarinassa on mukana neljä proteiinityyppiä: clca -, Bestrophin -, Tweety-ja TMEM16-geeniperheiden jäsenet. Kaikissa tapauksissa niiden rekombinantti yli-ekspressio johti kalvokloridivirtojen syntymiseen, joita stimuloidaan nostamalla solunsisäistä kalsiumpitoisuutta ja vaihtelevassa määrin kalvon depolarisaatiota. Clca: n matka päättyi, kun huomattiin, että kyseessä oli erittämänsä proteiini, joka todennäköisesti myös sääteli endogeenisten clca-kanavien kalvoekspressiota ilmentymäjärjestelmään30. Tweety ja Bestrofin proteiinit eivät osoita kaikkia ominaisuuksia ClCa kanavat tutkittu suurissa kudoksissa, vaikka Best1 näyttää vastuussa osa clca sensorinen neurons31 ja voi myös olla tärkeä säätelijä kalsiumin vapautumisen endoplasminen retikulum32, 33. Kolme riippumatonta tutkimusta ehdotti tmem16a: ta (jota kutsutaan myös Ano1: ksi) ehdokkaaksi kalsiumaktivoidun kloridikanavan pääkomponentiksi, ellei kokonaan, 34-36: lle. Tätä ovat tukeneet monet myöhemmät tutkimukset, joita molekyylityökalujen luominen on helpottanut. TMEM16A on tärkeä säätelemään kalvon excitability verisuonten sileän lihaksen, on ylös regulated eläinmallissa keuhkoverenpainetauti ja sävy voidaan vähentää kanavan esto37, 38. Sensorisissa neuroneissa tmem16a yhdistää tulehduksellisten välittäjäaineiden läsnäolon kalvojen yliekscitabiliteettiin ja tmem16a inhibitiolla on antinosiseptisiä vaikutuksia39. Astman eläinmalleissa tämän kloridikanavan ilmentyminen lisääntyy, ja sen estolla voi olla hyödyllisiä vaikutuksia40. Sitä esiintyy myös suoliston Cajalin interstitiaalisoluissa ja kanavan toimintaa tarvitaan sileän lihaksen rytmisessä supistumisessa41. Lisäksi tmem16a-aktivaatio voi tarjota vaihtoehtoisen reitin epiteelikloridin eritykselle kystisessä fibrosis42: ssa. Vaikka tmem16-perheen muun osan täsmällisestä toiminnasta on vielä jonkin verran keskusteltu, ClCa-funktio on myös katsottu tmem16b: ksi (Ano2), jonka uskotaan olevan clca-kanavan taustalla hajuaistin karvasoluissa43,44. Tälle ionikanavaluokalle voi olla rooleja myös syöpäsolubiologiassa ja sen inhibitio voi estää solujen proliferaatiota 45-48.
Loppuhuomautukset
tässä katsauksessa on korostettu kloridia johtavien tai kuljettavien proteiinien moninaisia rooleja ja sitä, miten niiden toimintahäiriö liittyy ihmisen häiriöön tai sairauden kaltaisiin oireisiin eläinmalleissa. Kloridikanavien ja kuljettajaproteiinien salakuljetusta estävien, aktivoivien tai tehostavien farmakologisten reagenssien puute on vakava. Edistystä on tapahtunut sellaisten lääkkeiden kanssa, jotka kääntävät CFTR: n viallisen toiminnan kystisessä fibroosissa, mikä toivottavasti johtaa erilaisiin perinnöllisiin mutaatioihin erikoistuneisiin lääkkeisiin. Tmem16a-kalsiumaktivoitujen kloridikanavien estäjät ja aktivaattorit 42, 49 ovat osoittautumassa hyödyllisiksi laboratoriovälineiksi ja uudet yhdisteet saattavat tehdä tehokkaita lääkkeitä, varsinkin jos ne voivat tuottaa kudoskohtaisia vaikutuksia. Tietyille CLC-yhdisteille ominaiset molekyylit ovat todennäköisesti vaikeimmin tavoitettavia. Jännitteellä varustetun CLC-aktivointi50: n rakenteellisen perustan ymmärtäminen saattaa tunnistaa proteiinialueita, jotka on kohdennettavissa rationaaliseen rakenteeseen perustuvalla lääkesuunnittelulla. Tällaisten välineiden avulla voimme testata joitakin uusia terapeuttisia ajatuksia, joita on tarkasteltu ja esitelty täällä.
tekijän elämäkerta

tohtori Jon Lippiat väitteli tohtoriksi kaliumkanavien rakenteesta, toiminnasta ja farmakologiasta Leicesterin yliopistossa. Hän tutki haiman beetasolujen toimintaa ja diabetesta Oxfordin yliopistossa ennen nimitystään farmakologian lehtoriksi Leedsin yliopistoon. Hänen tutkimustyössään selvitetään useiden erilaisten ionikanava-ja transportterityyppien rakenteellisia ja fysiologisia ominaisuuksia ja niiden mahdollista kohdentamista uusilla farmakologisilla reagensseilla.
Issue
Issue 4 2013
aiheeseen liittyviä aiheita
Kloridikanavat, lääkeaineet, ionikanavat