Kognaatti-antigeenin sitoutuminen parenkyymisoluihin stimuloi CD8+ T-solujen proliferaatiota in situ
- Kognaatti CD8 + T-soluja löytyy Ln: stä ja tulehtuneesta kudoksesta
- CD8 + T-solut laajenevat tulehduskohdassa
- kognitiivinen vuorovaikutus saarten kanssa edistää laajenemista
- kognitiivinen vuorovaikutus kotimaisten leukosyyttien kanssa ei ole tarpeen
- kognitiivinen vuorovaikutus parenkyymisolujen kanssa on tärkeää
- T-solut lisääntyvät tulehduskohdassa
- Kognaatti vuorovaikutus parenkymaalisten solujen ajaa proliferaatiota
- IL-2 on tärkeämpi tulehduskohdassa
Kognaatti CD8 + T-soluja löytyy Ln: stä ja tulehtuneesta kudoksesta
ensimmäisissä kokeissa (Kuva. 1) perustimme mallin, jossa CD8 T-solujen vasteet parenkymaaliseen antigeeniin, ovalbumiiniin (OVA), voitaisiin analysoida. OT – i-hiiret ilmentävät SIIRTOGEENISTÄ TCR: ää, joka välittää CD8+ T-solujen tunnistusta MHC-luokan I molekyylissä H-2kb esitetystä ova257-264-peptidistä. CD8 T-solut rikastettiin OT-I / CD45.1-hiiristä, jotka on merkitty CFE-väriaineella ja jotka on adoptiivisesti siirretty i. v.: llä B6 (CD45.2+) – isäntähiiriin. Adoptiivisesti siirretyt T-solut voitiin erottaa isäntäsoluista CD45.1-värjäyksellä (samoin kuin ot-I TCR: n CD8-ja Va2-ketju), kun taas CFSE-väriainelaimennosta käytettiin proliferoituneiden solujen tunnistamiseen (esimerkiksi Fig. 1a, täydentävä Kuva. 1). Parenkymaalinen antigeeni otettiin käyttöön siirtämällä B6.ßOVA-saaret (tällaiset saaret ilmentävät munasoluja parenkymaalisissa β-soluissa rotan insuliinipromoottorin alla, täydentävä Taulukko 1) niiden isäntähiirten munuaiskapselin alapuolella, jotka olivat jo saaneet OT-I/CD45.1 T-soluja. Kaikilla kolmella lähteellä (host, T-soluluovuttaja ja islet-luovuttaja) on B6-tausta ja siten ilmaistuna H-2kb. Näin ollen, vaikka OVA-antigeenin ilmentyminen rajoittui oksastettuihin β-soluihin, oletimme,että β-soluista johdettujen munasolujen esittäminen ei-parenkyymisillä APC: llä, kuten DC: llä ristiesityksen kautta, olisi tarpeen LN-pohjustukseen ja ehkä paikallisiin T-soluvasteisiin 17, 18.

jakautuneita OT-I-soluja (elinkelpoisia CD45.1+CD8+Va2+ gate) munuaisten LN: n ja siirteen tyhjennyksessä 3 tai 6 päivän kuluttua 400 B6: n siirteen vastaanottamisesta.ßOVA-saaret. a) edustavat virtaussytometria-käyrät. Jakamattoman OT-I-piikin sijainti määritettiin B6-saarisiirteen “no antigen” – kontrollin avulla. (B) jaetun OT-i: n kokonaismäärä munuaisten LN: ssä ja siirteessä, jossa jokainen piste edustaa yksittäistä hiirtä. Yhdistetyt tiedot seitsemästä riippumattomasta kokeesta: n=8 siirteen vastaanottajaa 3.päivänä ja n = 14 siirteen vastaanottajaa 6. päivänä. Eräänä päivänä 6 siirrettä menetettiin virtaussytometrin toimintahäiriön vuoksi. Vaakatangot ovat keskiarvoja, P-arvot laskettiin parittamattomalla, kaksipyrstöisellä t-testillä Welchin korjauksella.
CD8 + T-solut laajenevat tulehduskohdassa
odotetusti ensin havaittiin voimakas OT-i-vaste munuaisten LN: ssä, joka tyhjentää siirrekohdan, ja tämä riippui OVA-antigeenin esiintymisestä (Kuva. 1 A,b). 3 päivän kuluttua siirrosta, jaettu OT – i voidaan havaita LNS tyhjennys B6.ßOVA islet grafts (Kuva. 1a)ja olivat runsaasti (kuva. 1B, keskiarvo=9, 2 × 104). Sitä vastoin B6: ssa voitiin havaita 100 kertaa vähemmän jakautuneita OT-I-soluja.ßOVA graftit (Kuva. 1A, b, keskiarvo=6, 6 × 102). Jakautuneiden OT-I-solujen määrä kasvoi siirteen kohdalla 300-kertaiseksi päivästä 3 päivään 6 (Kuva. 1b, keskiarvo = 6, 6 × 102 päivänä 3-2, 1 × 105 päivänä 6, P<0, 0001, pariton kaksipyrstöinen t-testi Welchin korjauksella), kun taas LN: ssä ei ollut kasvua (Kuva. 1b). OT – i-vastaus B6: ssa.ßOVA-graftit voitiin selittää infiltraatiolla OT-I-soluihin, jotka olivat lisääntyneet LN: ssä. CFE: n profiilit olivat kuitenkin erilaiset siirteen ja siirteen kohtien välillä, koska siirteen OT-I-solut jakautuivat enemmän kuin siirteen solut 6. päivänä (Kuva. 1 A). Tälle erolle on ainakin kaksi mahdollista selitystä. Siirteeseen tunkeutui vain monta kertaa jakautuneita soluja. Vaihtoehtoisesti siirteeseen saapuvat solut jakautuvat nopeammin, mikä johtuu mahdollisesti saatavilla olevan antigeenin runsaudesta. Siirteen absoluuttisten solujen määrän kasvu verrattuna LN: ään 6.päivänä johti tämän jälkimmäisen selityksen tutkimiseen.
kognitiivinen vuorovaikutus saarten kanssa edistää laajenemista
määrittääksemme siirteessä olevan KOGNAATIN MHC: n mahdollisen osuuden paikalliseen laajenemiseen käytimme bm1: stä johdettuja saaria.ßOVA-hiiret (täydentävä Taulukko 1). Bm1: ssä.ßOVA-hiirillä h–2kbm1-molekyyli ei kykene esittämään OVA257-264-peptidiä johtuen kolmesta h-2kb: n mutaatiosta (ref. 19). Vertailu B6: n vastauksista.ßOVA ja bm1.ßovan saaresiirrännäiset osoittivat, että huolimatta samanlaisista OT-I-vasteista munuaisten LN: n tyhjennyksessä, ot-I: n laajeneminen väheni kuusinkertaiseksi bm1: ssä.ßOVA verrattuna B6: een.ßOVA graftit (keskiarvo=4.7 × 104 verrattuna 2, 6 × 105 jaettuun OT-I: een; P=0, 0153 parittamattomaan kaksipyrstöiseen t-testiin Welchin korjauksella; Kuva. 2 a). Tämä vähemmän tehokas laajentuminen ot-i solujen infiltroituu bm1.ßOVA-graftit ehdottivat, että kognaattiset vuorovaikutukset vartettujen islet-solujen kanssa edistivät paikallista T-solujen laajenemista.

OT-I-solujen Virtaussytometria-analyysi (elinkykyinen CD45.1+CD8+Va2+ gate) 6 päivää siirteen jälkeen. (a) yhteensä jaettuna OT-i: n vuotavaan munuaisten LN: ään ja siirteeseen 400 B6: n kerta-siirteen vastaanottamisen jälkeen.ßOVA tai bm1.ßOVA-saaret. Tiedot B6: ta varten.ßOVA vartetut hiiret ovat osajoukko, joka on esitetty kuvassa. 1b. jokainen piste edustaa yksittäistä hiirtä. Kussakin paneelissa esitetään kahden riippumattoman kokeen yhdistetyt tiedot: n=5 B6: n vastaanottajaa.ßOVA-siirrännäiset ja N = 6 bm1: n saajaa.ßOVA-siirrännäiset. Vaakatangot ovat keskiarvoja, P-arvot laskettiin parittamattomalla, kaksipyrstöisellä t-testillä Welchin korjauksella. (b) kaavamainen kaksisuuntainen siirteen malli, jossa siirrännäiset 200 luotoa on sijoitettu vastakkaisiin napoihin saman munuaisen ja jakaa yhteinen tyhjennys munuaisten Ln. Yhteensä jaettuna OT-I kohtaan (C) B6.ßOVA ja KbKO.ßOVA bipolaarisiirrännäiset ja d) B6.ßOVA – ja B6-bipolaarisiirrännäiset (N=5 vastaanottajahiirtä, jotka yhdistettiin kahdesta riippumattomasta kokeesta kummassakin C-ja d-ryhmässä) yhdistettiin saman hiiren tietoihin katkoviivalla: P-arvot laskettiin suhdeparituksella t-testillä.
h-2kbm1 alloantigenin mahdollisen panoksen poistamiseksi tuotimme kbko: n.ßOVA-hiiret, jotka ilmentävät OVA-antigeenia saarekkeen beetasoluissa mutta joilla ei ole alloantigeenia tai H-2kb: tä (täydentävä Taulukko 1). Sitten käytimme “bipolaarisiirremallia” verrataksemme vastauksia B6: een.ßOVA ja KbKO.B6-isäntähiiren saman munuaisen vastakkaisiin napoihin sijoitetut ßOVA-isletsiirrännäiset, jotka olivat peräisin samassa Ln: ssä pohjustetuista T-soluista (Kuva. 2b). B6: ssa oli 10-100 kertaa enemmän T-soluja.ßOVA kuin KbKO.ßOVA graftit (Kuva. 2c). Käyttämällä yksittäisille hiirille laskettua jaetun OT-I: n suhdetta munuaisten vastakkaisilla napoilla, saatiin suhteellinen vastesuhde (RRR). RRR osoitti, että paikallinen T-solujen laajeneminen oli 26-kertainen, kun kognitiivinen sitoutuminen siirtosoluihin tapahtui (RRR=26, 4±14, 1 B6: ssa.kbko.ßOVA graftit, P=0, 0025, suhdepari t-testi, Kuva. 2c).
vertailimme myös bipolaarisen B6: n vasteita.ßOVA ja B6 (ei antigeenia) graftit (Kuva. 2d). Hyvin harvat OT – i voitaisiin havaita B6 graft (Kuva. 2d) ja pidämme todennäköisenä, että monet näistä olivat peräisin veren saastumisesta. Antigeenin puutteesta kärsivien siirrännäisten siirtoon liittyvä epäspesifinen tulehdus ei siis johda tehokkaaseen T-solujen laajenemiseen tulehtuneessa kudoksessa. Sen sijaan vastaus B6: een.ßOVA-graftit olivat jälleen hyvin voimakkaita ja yli 900 kertaa suurempia kuin B6-graftit (RRR=950±252 B6-grafteissa.ßOVA:B6-siirrännäiset, P<0, 0001, suhdepari t-testi, Kuva. 2d).
yhdessä nämä kokeet osoittivat, että paikallinen antigeeni edisti merkittävästi CD8 T-solujen laajenemista tulehtuneessa kohdekudoksessa. Tämä ei välttämättä sulje pois muita T-solun laajenemiseen vaikuttavia tekijöitä, esimerkiksi ristiinesittelemällä siirteessä isäntävirtaa DC. Me vain aver, että kognitiivinen vuorovaikutus T-solujen ja saarten solujen välillä johtaa merkittävään T-solujen laajenemiseen.
kognitiivinen vuorovaikutus kotimaisten leukosyyttien kanssa ei ole tarpeen
luodot ovat monimutkaisia soluryhmiä, joihin kuuluvat β-solut, endoteelisolut ja saarella olevat leukosyytit (IRL). Siksi pyrimme seuraavaksi selvittämään, mitkä luodesolut esittelivät antigeenia T-soluihin tunkeutuville t-soluille ajaakseen T-solujen laajenemista. Ilmeisin ehdokas olisi IRL. Nämä CD45+ – solut on eri tavoin määritelty DC: ksi tai makrofageiksi, koekuormitteisiksi CD11c: ksi ja F4/80: ksi, ja niiden on osoitettu prosessoivan ja esittävän antigens20,21,22,23. Siksi tutkimme luovuttajan IRL: n roolia paikallisen CD8 T-solun laajenemisen edistäjänä. B6.ßOVA-hiiret risteytettiin CD11c.DTR: ään.GFP-hiiret CD11c.DTR: n saamiseksi.GFP.ßOVA-hiiret,joiden β-solut ilmentävät munasoluja ja joiden CD11c+ – solut voivat ablatoitua kurkkumätätoksiinin (DT) injektoinnilla8. Testasimme ensin FCS: n, joka on eristetty CD11c.DTR: stä.DT: llä hoidettujen GFP-hiirten CD11c+ – solut olivat lopussa (Kuva. 3 A,b). Käsittelemättömien kontrollihiirien CD11c+ IRL tunnistettiin cd45: n ja CD11c: n värjäyksellä sekä GFP-reportterin ilmentymisellä, ja DT-hoito oli selvästi tyhjentänyt ne (Kuva. 3a, b, P=0, 0002, pariton kaksihäntäinen t-testi Welchin korjauksella). Vahvistimme myös, että CD11c + IRL co-ilmaistuna F4 / 80 ja H – 2 Kb MHC class I (täydentävä Kuva. 2a) ja näin ollen myös F4/80+ – solut hupenivat DT-hoidettujen hiirten luodoilta (täydentävä Kuva. 2b). CD11c. DTR.GFP.hoitamattomista ja DT-hoidetuista hiiristä eristetyt ßOVA-saaret siirrettiin saman munuaisen vastakkaisiin napoihin. Jaettu OT-i-luku oli samanlainen siirrännäisten välillä, mikä viittaa siihen, että IRL-poistuma ei vaikuttanut CD8+ T-solun laajenemiseen siirteen kohdassa (Kuva. 3c). Varmistaaksemme, että IRL: llä ei ollut merkitystä paikalliselle CD8 T-solun laajenemiselle, teimme toisen sarjan kokeita. KbKO.ßOVA-hiiriä säteilytettiin ja ennallistettiin joko kbko: lla tai B6-luuytimellä (BM), jotta saatiin aikaan ßOVA-saarekkeiden lähde, jossa h-2kb: n ilmentymä puuttui kaikista soluista tai palautui selektiivisesti IRL: ään (Kuva. 3d). Tällaisten luotojen vertailu kaksisuuntaisessa siirteen mallissa osoitti ot-I-solujen laajenemisen olevan samantasoista molemmissa siirteissä (Kuva. 3 e). Näin ollen IRL ei ole merkittävä paikallisen CD8 T-solun laajenemisen ajuri.

Virtaussytometrian analyysi osoittaa cd11c: n ja IRL: n vähenemisen CD11c.DTR: ssä.DT: llä hoidetut GFP-hiiret: a) edustavat havaintoalat, jotka osoittavat CD11c+IRL-arvon porttikäytävällä hoitamattomien kontrollihiirien luodoilla ja niiden häviämisen yhden DT-käsittelyn jälkeisenä päivänä, ja B) CD11c+IRL-arvojen lukumäärän käsittelemättömillä ja DT-hoidetuilla hiirillä. Jokainen piste edustaa yksittäistä saarivalmistetta, joka sisältää 1-8 hiiren yhdistetyt luodot, N=5 käsittelemätöntä saarivalmistetta ja 6 DT hoidettua saarivalmistetta, jotka on yhdistetty neljästä riippumattomasta kokeesta. P-arvo laskettu parittamattomalla, kaksihäntäisellä t-testillä Welchin korjauksella. c) CD11c.DTR: stä saatu OT-i: n kokonaismäärä 6 päivän kuluttua kaksisuuntaisen luoteissiirrännäisen jälkeen.GFP.ßOVA-hiiret, jotka olivat hoitamattomia tai hoidettuja DT: llä (N=6 vastaanottajahiirtä yhdistetty kahdesta riippumattomasta kokeesta). Saman hiiren tiedot yhdistetään katkoviivalla; p-arvot lasketaan suhdepari – t-testillä. D) edustavat havaintoalat, jotka osoittavat, että Kbko-hiirillä, jotka on ennallistettu kbko: lla, ei ole H-2kb: n ilmentymää CD11c+IRL: ssä, tai että niitä esiintyy vastaavasti B6 BM: llä. Valmiina eläviin soluihin. (E) chimaeric-hiirillä (N=3 vastaanottajahiirtä yhdestä kokeesta) saatu OT-i: n kokonaismäärä 6 päivän kuluttua kaksisuuntaisen siirteen jälkeen. Saman hiiren tiedot yhdistetään katkoviivoilla; P-arvot lasketaan suhdeparituksella t-testi.
kognitiivinen vuorovaikutus parenkyymisolujen kanssa on tärkeää
B6.RIP-Kb hiiret ilmentävät transgeenisesti h-2kb: tä β-soluissa rotan insuliini promoter24-kontrollissa. Risteyttämällä nämä hiiret KbKO: Hon.ßOVA hiiret loimme KbKO.no niin.ßKb-hiiret, joissa H-2kb: n ilmentyminen rajoittui β-soluihin (täydentävä Taulukko 1). H-2kb: n ilmentyminen β-soluissa vahvistettiin saarten FACS-analyysillä (Kuva. 4 A). Me aidattiin islet hematopoieettiset solut (CD45+) ja endoteelisolut (CD31+) ja osoitti, että H-2kb ei ilmaistu näissä soluissa joko KbKO.ßOVA tai KbKO.no niin.ßKb-hiiret verrattuna voimakkaaseen ilmentymiseen B6-hiirillä (Kuva. 4 A). Loput CD45-CD31-solut ovat autofluoresoivia positiivisia ja rikastuneet endokriinisissä soluissa. FACS analyysi luodot kbko.no niin.ßKb-hiirillä h-2kb ilmentyi β-soluilla rikastetussa autofluoresenssipopulaatiossa samalla tasolla kuin B6-saarilla (Kuva. 4 A). Vertailu kaksisuuntaisen siirteen mallissa osoitti, että ot-I: n laajeneminen oli 14-kertainen, kun kognaatti-antigeeni ilmaistiin β-soluilla (RRR=14, 0±4, 1 kbko: lla.no niin.YKB: KbKO.ßOVA graftit, P=0, 0008, suhdepari t-testi, Kuva. 4b).

(a) Virtaussytometriset käyrät (aidatuilla elävillä soluilla), jotka osoittavat h-2kb: n selektiivisen palautumisen parenkyymisoluissa. Histogrammit kuvaavat saaria kbko: lta (varjostettu), B6: lta (rikottu) tai KbKO: lta.ßKb (lihavoidut) hiiret. (B) yhteensä jaettuna OT-I 6 päivän kuluttua kbko: n kaksisuuntaisesta siirteestä.ßOVA ja KbKO. no niin.YKB. luodot (n=6 vastaanottajahiirtä yhdistetty kolmesta riippumattomasta kokeesta). Saman hiiren tiedot yhdistetään katkoviivalla; p-arvot lasketaan suhdepari – t-testillä.
T-solut lisääntyvät tulehduskohdassa
edellä mainitut havaintomme osoittavat, että kohdekohdassa esiintyi paikallista proliferaatiota. Havaitaksemme aktiivisesti jakautuvia soluja ristimme OT-I / CD45.1-hiiret FucciRG-hiiriin tuottaaksemme FucciRG/OT-I/CD45-hiiriä.1 hiiri (lyhennettynä FucciOT-I). Tällaisilla hiirillä solut fluoresoivat punaista (FucciR) G0/G1: n aikana ja vihreää (FucciG) s/G2/M: n solusyklin vaiheissa25,26. Fuccir-ja FucciG-reportterien asteittainen hajoaminen ja kasautuminen syklivaiheiden välillä mahdollistaa lisäerottelun: voimakkaampi fuccir-ilmentyminen lepäävissä G0 – soluissa verrattuna sykliseen G1-soluihin, kaksoisnegatiiviset FucciR− G-solut hyvin varhaisessa G1-soluissa ja heikosti tuplapositiiviset FucciR+G+ – solut G1/s-soluissa (viite 26, 27). Siittämättömien hiirten lepäävät fucciot-I-solut olivat FucciG – (Kuva. 5A, ylempi paneeli, piirtämätön). Välttääksemme häiriöt Fucci-väriaineiden kanssa korvasimme CFSE: n CTV: llä. Hiirillä, jotka olivat saaneet B6: ta.ßOVA-siirrännäiset, CTV-laimennoksen analyysi osoitti, että jakautunutta FucciOT-I: tä esiintyi valuvassa munuaisten LN: ssä, ja jotkut näistä olivat fuccig+ – merkkejä, jotka viittasivat aktiiviseen solunjakautumiseen (Kuva. 5A, ylempi paneeli, tyhjennys LN). Siirteen paikalla havaitsimme fucciot-I: n, joka oli läpikäynyt monia jakaumia (CTV ei ole enää havaittavissa) ja monet näistä olivat fuccig+ tukevia jatkuvaan proliferaatioon (Kuva. 5a, ylempi paneeli, tuore siirteen). Fuccig+ – solujen osuuden vertailu jaetussa OT-I-populaatiossa (Kuva. 5c) osoitti, että jatkuva proliferaatio tuoreissa siirteissä (26, 8±8, 8% FucciG+) ylitti proliferaation joko drening renal LN: ssä (7, 3±1, 6%, P=0, 008, pariton kaksihäntäinen t-testi Welchin korjauksella) tai ei-drening renal LN: ssä (2, 1±2, 1%, P=0, 003, pariton kaksihäntäinen t-testi Welchin korjauksella). Itse asiassa, tutkiminen sekä FucciG ja FucciR expression osoitti, että useimmat siirteen-infiltrated OT-I olivat aktiivisesti jakamalla, että on, hyvin harvat solut näytteillä korkea ilmentymä FucciR, joka oli ominaisuus lepäävät solut Ln ungrafted hiiriä (Kuva. 5A, alapaneelit). Vaikka otaksuimme, että tämä lisääntyminen tulehduspaikalla syntyi paikan päällä, emme voineet täysin sulkea pois sitä mahdollisuutta, että tämä johtui yksinkertaisesti lisääntyvien solujen viimeaikaisesta saapumisesta. Selventääksemme tätä, keräsimme B6: n kaksisuuntaiset siirrännäiset.ßOVA-luodoilla analysoidaan yksi siirre heti irrottamisen jälkeen ja viljellään toista siirrettä 1 päivän ajan (Kuva. 5 a). Vaikka OT-I: n määrä ei kasvanut kulttuurin aikana (Kuva. 5b), mikä oletettavasti heijastaa solukuolemaa suboptimaalisissa ex vivo-olosuhteissa, monia fuccig+ OT-i-soluja havaittiin edelleen (14, 2±4, 2% FucciG+, Kuva. 5c). Viljellyn siirteen profiili, ilman mahdollista värväystä päivän ajan, viittaisi siihen, että siirteessä oli paljon de novo-kasvua.

(a) kaavamaiset ja edustavat virtaussytometria-käyrät (aidatut elinkelpoisilla CD45.1+CD8+Va2+ lymfosyyteillä), jotka osoittavat fucciot-I-solujen vasteen munuaisten LNs: ssä tai bipolaarisessa B6-bipolaarissa.ßOVA-siirrännäiset. LNs ja yhdestä navasta peräisin oleva Siirtymä tutkittiin välittömästi (tuoreena 6 päivää siirteen jälkeen), kun taas vastakkaisesta navasta peräisin olevaa siirrettä viljeltiin 1 päivä ennen analyysiä. Ln yhdistämättömästä hiirestä otettiin mukaan osoittamaan jakautumisen ja fuccig-ilmentymän puuttumista (ylempi paneeli) ja fuccir high-solujen hallitsevuutta (alempi paneeli) lepotilassa olevassa FucciOT-I: ssä.b) fucciot-I: n kokonaisjako tuoreissa ja viljellyissä siirteissä. Keskiarvo+s. d., n=5, p-arvot, jotka on laskettu kaksihäntäisen suhdeparin t-testillä. (C) %FucciG+ jaettuna OT-I: hen tuoreissa, valuttamattomissa ja siirteen valuttamissa munuaissiirroissa sekä tuoreissa ja viljellyissä siirroissa. Keskiarvo+s. d., n = 5 lukuun ottamatta tyhjenemätöntä LN: ää, jonka osalta N=4 yhden LN: n häviön vuoksi käsittelyn aikana. P-arvot laskettiin kaksihäntäisellä parittamattomalla t-testillä Welchin korjauksella. Tiedot on koottu kahdesta erillisestä kokeesta.
Kognaatti vuorovaikutus parenkymaalisten solujen ajaa proliferaatiota
seuraavaksi hyödynsimme FucciOT-I-mallia arvioidaksemme toisen mahdollisen paikallisen T-solujen proliferaation tekijän roolia siirteessä, isännästä johdetussa APC: ssä, kuten tulehduksellisessa DC: ssä. Jotta voidaan poistaa kaikki panos host APC johdimme ensin kbko Tausta. Koska kbko-hiiret hylkäsivät OT – i-solut, loimme KbKO BM: n B6-chimaeroiksi käytettäväksi isäntinä; näin hematopoieettisista soluista puuttui H-2kb, mutta ne olivat OT-I-solujen sallivia. Näille chimaeroille annettiin FucciOT-I T-soluja ja kbko: n bipolaarisiirroksia.ßOVA-luodot (joilla ei ole h-2kb-ilmentymää ja siten kyky esittää OVA-antigeenia) ja KbKO.no niin.ßKb-saaret (sekä H-2kb että OVA-antigeeni rajoittuivat β-soluihin). Koska chimaeralta puuttui APC-positiivinen h-2kb, OVA257-264 peptidipäällysteistä pernasolua oli tarpeen antaa OVA257-264 peptidillä päällystettyä pernasolua OT-i-vasteen käynnistämiseksi. Tämän pohjustuksen onnistuminen osoitettiin CTV-laimennuksella fucciot− I− soluihin munuaisten LN: ssä, vaikka ne olivat sadonkorjuuajankohtana FucciG-eivätkä näyttäneet jakautuvan aktiivisesti (0, 1±0, 0% FucciG+, Fig. 6 A, d). Soluttauduin KBKO:Hon.ßOVA graft, mutta ne laajenivat selvästi KbKO: n sisällä.no niin.ßKb-graftit (RRR 61, 4±26, 6 kbko: lle.no niin.YKB: KbKO.ßOVA, Kuva. 6b, P=0, 0008, kaksihäntäinen suhdepari t-testi). Näin ollen jopa isäntäapc: n kognaattiantigeenin puuttuessa parenkymaalisten β-solujen kognaattiantigeeni riitti ajamaan CD8 T-solujen laajenemista siirtokohdassa. Kbko: ssa esiintyvät harvat FucciOT-I T-solut.ßOVA-graftit muistuttivat LN: n grafiitteja sekä tehottoman etenemisensä että hyvin jakautuneen fraktion (Fig. 6a, c, 7, 5±0, 9% erittäin jakautunut LN: ssä ja 19, 3±3, 3% erittäin jakautunut KbKO: ssa.ßOVA graftit) ja fuccig-ilmaisun puute (Kuva. 6a, d, 0, 1±0, 0% LN: ssä ja 0, 1±0, 1% KbKO: ssa.ßOVA-graftit), mikä viittaa siihen, että siirtokohdassa esiintyi vain vähän ot-i-proliferaatiota kognaatti-antigeenin puuttuessa. Sen sijaan KBKO: n OT-I.no niin.ßKb-graftit jakautuivat pääasiassa voimakkaasti (92,3±1,0%, Fig. 6a, c)ja jotkut näistä olivat FucciG+ ja siten aktiivisesti lisääntyviä (Kuva. 6a, d, 5, 0±1, 2% FucciG+). Näin ollen cognate antigeenin esittäminen islet-parenkymaalisten β-solujen avulla pystyi ajamaan fucciot-I: n de novo-proliferaatiota in situ.

FucciOT – I-vastaus kbko BM: n siirteisiin B6-isäntähiiriin, joissa isännän hematopoieettisilla soluilla ei ole H-2kb-ilmentymää. Oksastetut hiiret saivat peptidipäällysteisiä pernasoluja siirtopäivänä OT-I-pohjustuksen aloittamiseksi. a) edustavat virtaussytometria-käyrät (aidattu elinkelpoisilla CD45.1+CD8+Va2+ – lymfosyyteillä). Ylempi paneeli osoittaa jakautumisen ja FucciG-ilmaisun puuttumisen lepotilassa OT-I: ssä hiiressä, jota ei oksastettu eikä pohjustettu. Alemmat kolme paneelia osoittavat reponses in kaksisuuntainen grafted ja pohjustettu hiiri: draining renal LN, KbKO.ßOVA ja KbKO.no niin.ßKb-graftit. Oksastetuilla hiirillä jaetut solut jaettiin kahteen sektoriin siten, että pitkälle jakautuneet solut putosivat sektoriin, jossa CTV: tä laimennettiin yli havaitsemisrajan. (B)yhteensä jaettu FucciOT-I kbko.ßOVA ja KbKO.no niin.ßKb bipolaarisiirrännäiset, p-arvot lasketaan kaksihäntäisellä suhdeparittuneella t-testillä. (c) %erittäin jakautunut ja (D) % FucciG+ OT-I munuaisten LN: n tyhjennyksessä ja bipolaarisesti siirrettyjen hiirten siirteissä. P-arvot laskettiin kaksihäntäisellä paritestillä. Yksittäisten hiirien tulokset on yhdistetty katkoviivalla, n=6 vastaanottajahiirellä, jotka on yhdistetty kahdesta riippumattomasta kokeesta.
IL-2 on tärkeämpi tulehduskohdassa
osoitamme, että IL-2ra: n ilmentyminen oli tärkeämpää CD8+ T-solujen proliferaation ja kertymisen kannalta perifeerisissä parenkyymissä (saaresiirrännäisissä) kuin pohjustuskohdassa tyhjennyksessä LN (Kuva. 7 a). Lisäksi analysoimme vasteen toisessa kohdassa, joka on kaukana pohjustuskohdasta eli ei-tyhjennyskohdassa LN. OT-I. IL-2RAKON (IL-2ra−CD45.2+) ja ot-i/Ly5.1 (IL-2RA+, CD45.1+ CD45.2+) hiirten CTV-merkityt CD8+ T-solut siirrettiin samanaikaisesti B6.CD45.1-isäntähiiriin (CD45.1+) ennen B6: n siirteen vastaanottamista.ßOVA-saaret. Kunkin siirretyn t-solupopulaation erilliset CD45-alleeliset allekirjoitukset (yhdessä CD8:n ja Va2: n värjäyksen kanssa) antoivat meille mahdollisuuden kvantifioida ja vertailla jaetun WT: n suhdetta: IL-2RAKO OT-I (kuva. 7a, täydentävä Kuva. 3). IL-2ra WT selvästi outcompeted IL-2ra KO OT-I siirtokohdassa verrattuna joko tyhjennykseen (P=0, 025, kaksihäntäinen t-testi) tai ei-tyhjennykseen (P=0, 044, kaksihäntäinen t-testi) LN. Tämä on yhdenmukaista CD8+ T-solujen lisääntyvän riippuvuuden kanssa IL-2: sta tulehduskohdan antigeenin sekundaarisen kohtaamisen yhteydessä verrattuna LN: n tyhjennysvaiheen alustukseen.
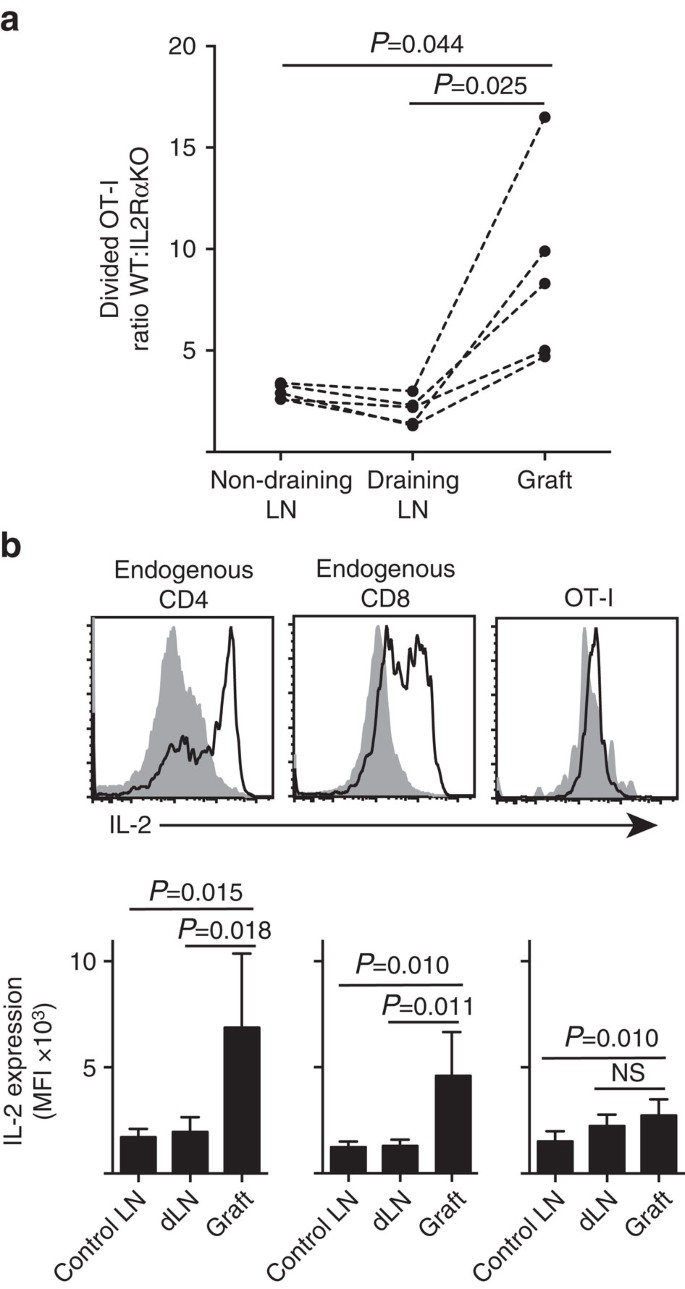
(a) jaettujen IL-2RA WT:Il-2ra KO OT-i-solujen suhde B6: sta talteen.ßOVA saaresiirre, munuaisten LN: n tyhjennys ja nivusienien LN: n tyhjennys (106 kumpaakin) samanaikaisen siirron jälkeen B6.CD45.1-isäntähiiriin. Suhdeluvut laskettiin yksittäisille elimille, ja tulokset saatiin yksittäisistä hiiristä, jotka yhdistettiin katkoviivalla, ja niitä verrattiin kaksihäntäisellä paritestillä. Tulokset N = 5-vastaanottajahiirille ja edustavat kolmea riippumatonta koetta. b) IL-2-ilmentymä endogeenisissa CD4+ – ja CD8+ – soluissa ja siirretyt OT-I-solut B6-vastaanottajissa.ßOVA islet grafts. Ylemmät paneelit osoittavat edustavat virtaussytometriset käyrät siirteen tyhjennykselle munuaisten LN: lle (kiinteä harmaa) ja siirteelle (musta viiva). Alemmissa paneeleissa on yhteenveto IL-2: n ilmentymän keskimääräisestä fluoresoivasta intensiteetistä (MFI) siirretyiltä hiiriltä (kontrolli-Ln) ja siirretyiltä hiiriltä (DLN) otettujen munuaisten Ln: ien osalta. Tulokset keskiarvona+s. d., n = 6 yhdistettiin kahdesta riippumattomasta kokeesta ja niitä verrattiin kaksihäntäisellä parittamattomalla t-testillä Welchin korjauksella.
lisääntynyt riippuvuus IL-2: sta CD8+ T-solujen proliferaatiossa tulehduskohdassa johti tarpeeseen tuottaa paikallista IL-2: ta. Siksi tutkimme eri T-solujen (endogeeniset isäntäperäiset CD4+ ja CD8+ sekä siirretyt ot-i CD8+ T-solut) mahdollisuuksia tuottaa IL-2: ta (Kuva. 7b). Siirrännäisistä tai Ln: stä valmistetut solususpensiot elvytettiin lyhyesti (4 h) PMA: lla ja ionomysiinillä ennen värjäystä solunsisäisen IL-2: n ilmentymiseksi. Endogeenisten isäntäperäisten CD4+-ja CD8+ T-solujen tutkiminen antoi vakuuttavaa näyttöä IL-2: n tuotannosta siirteen tulehduskohdassa, ja rahalaitosten IL-2: n värjäytyminen lisääntyi selvästi verrattuna joko tyhjennys-tai ei-tyhjennys-LN: ään. IL-2-tasot ot-i CD8+ T-soluissa tulehduskohdassa nousivat kohtalaisesti verrattuna LN: n pitoisuuksiin, jotka eivät olleet tyhjentyneet, mutta eivät poikenneet merkittävästi LN: n pitoisuuksista. Yksi tulkinta näistä tiedoista on, että ot-i: n kognitiivinen vuorovaikutus parenkyymisolujen kanssa aiheuttaa nopeaa proliferaatiota, mutta huonoa IL-2: n tuotantoa siten, että OT-I: t ovat riippuvaisia endogeenisista CD4+-ja CD8+ T-soluista saadusta PARAKRIINISTA IL-2: sta paikallisessa siirteen ympäristössä. Lisäkoe kuitenkin osoitti, että eksogeeninen IL-2 Ei parenkymaalisen antigeenin puuttuessa voisi ajaa OT-I CD8+ – solujen laajenemista. IL-2 (rekombinantti hIL-2, 25 000 IU) annettiin intraperitoneaalisesti B6-hiirille, joille annettiin B6-tyypin bipolaarisiirrännäisiä.ßOVA-ja B6-saaret. IL-2: sta tai kantaja-aineella hoidetuista hiiristä 6.päivänä siirrännäisen jälkeen saatujen elinten OT-I-saantojen vertailu ei osoittanut merkitsevää lisääntymistä jakautuneiden OT-I-solujen kumuloitumisessa kahteen kohtaan, joilta puuttuu parenkymaalinen antigeeni, nimittäin B6-saaresiirteeseen (3±3 hoidetulla kantaja-aineella verrattuna 49±64: ään IL-2-hoidetuilla hiirillä, P=0.342) ja non-drying inguinal LN (1 648+633 hoidetulla ajoneuvolla verrattuna 1 660+1 023 IL-2-hoidetulla hiirellä, P=0, 987, keskiarvo±S.d., n=3, kaksipyrstöinen pariton t-testi Welchin korjauksella).