Mikä on colony PCR?
pesäke-PCR on nopea, suuritehoinen PCR-menetelmä, jolla määritetään plasmidiin suoraan bakteeripesäkkeistä työnnetyn DNA: n esiintyminen tai puuttuminen.
Molekyylikloonaus on yksi suosituimmista DNA: n muuntamismenetelmistä jo pitkään. DNA-insertin läsnäolon tai puuttumisen määrittämiseksi meidän on tehtävä muuntokokeita.
pesäke PCR on uusi menetelmä, jossa suunnittelemalla sisään työnnetyt DNA-spesifiset alukkeet voimme tunnistaa, onko kiinnostava DNA: mme lisätty plasmidiin vai ei.
asia ei kuitenkaan ole niin yksinkertainen kuin nyt puhutaan.
tässä artikkelissa keskitytään erityisesti siirtokunnan PCR: ään, siirtokunnan PCR: n periaatteeseen, sen etuihin ja rajoituksiin.
sitä varten meidän on ymmärrettävä useita termejä ja aiheita. Aloitamme aiheemme perusasioista. Artikkelin sisältö on,
Keskeiset aiheet:
“plasmidi on bakteerin kehä-DNA, joka monistuu itsenäisesti bakteerin kromosomista ja jota käytetään geenimanipulaatiossa ja geeninsiirrossa.”
geneettinen kloonaus on perinteinen molekyyligeneettinen työkalu, jota on käytetty jo kauan laboratorioissa. Lyhyesti, geenien kloonauksessa, kiinnostuksemme geeni lisätään plasmidiin keinotekoisin keinoin. Tämä DNA replikoituu itsenäisesti bakteerien kromosomista.
plasmideja käytetään itse asiassa tuottamaan monia kopioita lyhyistä DNA-segmenteistä. Koska bakteerit lisääntyvät nopeammin kuin muut organismit, voimme tuottaa monia kopioita kiinnostavasta geenistä lisäämällä sen bakteeriplasmidiin.
F-plasmidi, Col-plasmidi, degradatiivinen – plasmidi ja resistenssi plasmidi ovat useita yleisiä bakteereissa esiintyviä plasmidien tyyppejä.
lisäksi plasmidi voi toimia molekyylikantajana, joka siirtää lyhyitä DNA-segmenttejä solusta toiseen.
olemme käyneet läpi hämmästyttävän syvällisen artikkelin plasmidin DNA: sta. Lue se täältä: plasmidin DNA-rakenne, toiminta, eristäminen ja sovellukset.
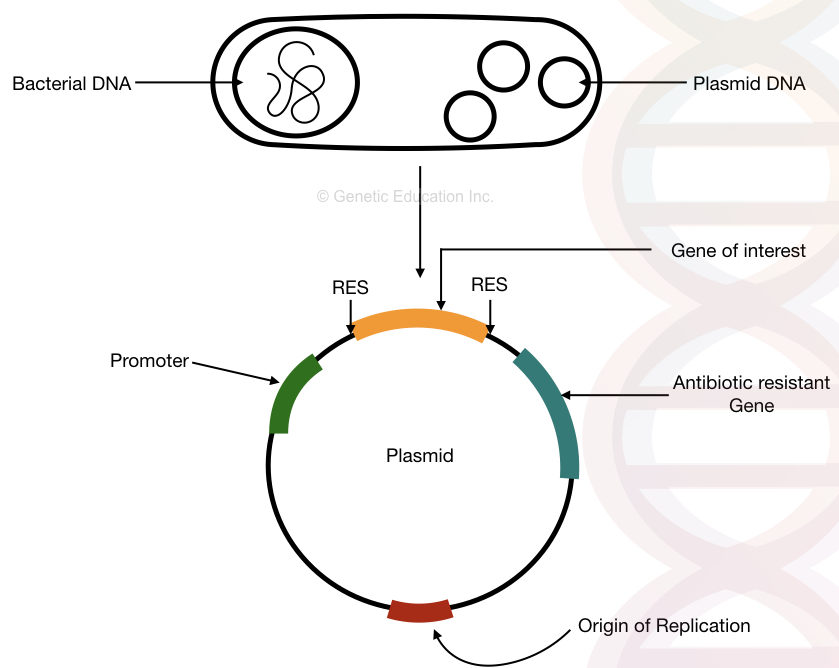
bakteerin plasmidi-DNA: n rakenne, replikaation alkuperä, antibioottiresistenssigeeni, promoottori ja kiinnostava geeni.
bakteerien lisäksi myös useat muut prokaryootit sisältävät plasmidin DNA: ta. Plasmidin tärkein tehtävä bakteereissa on niiden selviytyminen ankarissa olosuhteissa.
koska plasmidi siirtää kiinnostavan geenimme, on erittäin tärkeää selvittää, onko kiinnostava geenimme lisätty plasmidiin vai ei.
siihen voidaan käyttää useita menetelmiä, kuten PCR ja mikrobiviljely.
pesäkkeiden levittäminen vie enemmän aikaa, eikä menetelmän herkkyys ole myöskään hyvä. Kontaminaation mahdollisuus on aina suuri bakteeriviljelymenetelmissä.
, joten tulokset eivät ole tarkkoja.
PCR auttaa tässäkin. Pesäke-PCR-menetelmällä voidaan määrittää tai tunnistaa DNA-insertti.
- miten perustaa DNA extraction lab: a comprehensive guide (chemicals, instruments and other utilities).
- kromosomin 6P poisto: syy kivuttomuuteen, näläntunteeseen ja unettomuuteen
mikä on pesäkkeiden PCR?
pesäkkeiden PCR on perinteisen PCR: n muunnos, jossa bakteeripesäkkeitä käytetään suoraan PCR-mallina.
kiinnostuksemme DNA: ta sisältävä plasmidi-DNA monistuu syklisestä lämpötilasta riippuvaisissa olosuhteissa.
yhdyskunnan PCR: n graafinen esitys on esitetty alla olevassa kuvassa,
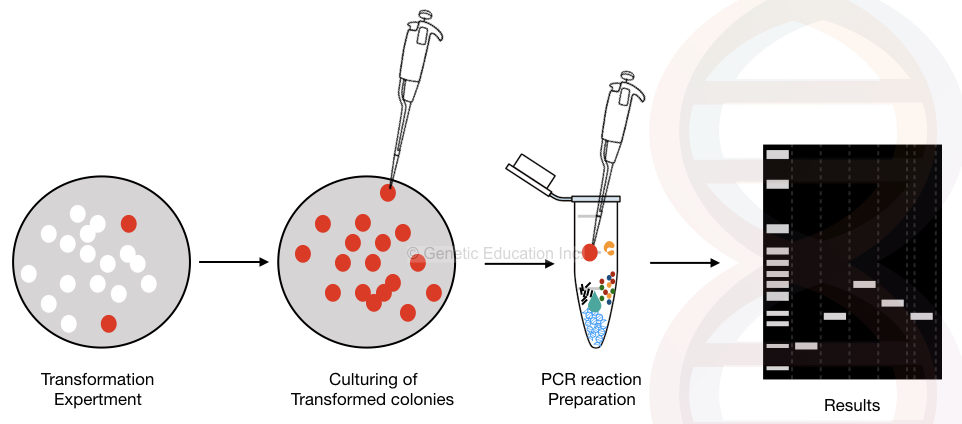
the general overview of the colony PCR method.
pesäke-PCR: n periaate:
plasmidin sisältävää bakteeripesäkettä voidaan suoraan monistaa käyttämällä kahta aluketta. Inserttispesifiset alukkeet, jotka vahvistavat insertiosekvenssiä, ja vektorispesifiset alukkeet, jotka vahvistavat muuta plasmidi-DNA: ta kuin lisättyä DNA: ta (sivualueet insertin molemmilla puolilla).
käyttämällä inserttiä reunustavia alukkeita (jotka vahvistavat muuta DNA: ta) DNA-inserttimme koko voidaan määrittää.
bakteeripesäke poimitaan ja lisätään suoraan mastermixiin, joka sisältää kaikki PCR-reagenssit. Kun PCR: ään lisätään yksi alkulämmitysvaihe, plasmidin DNA tulee ulos bakteerisolusta ja monistuu reaktiossa.
tämä on pesäkkeiden PCR: n perusperiaate, mutta sitä voidaan muuttaa vaatimusten mukaan.
siirtokunnan PCR: n protokolla:
siirtokunnan PCR on yksi perinteisen PCR: n erinomaisista muunnoksista. Templaatti-DNA: n sijaan reaktioon lisätään suoraan bakteeripesäkkeitä. Tämän lisäksi PCR-reaktiossa lisätään myös Taq-DNA-polymeraasi, alukkeet, PCR-reaktiopuskuri ja DD/w.
täällä siirtokunnan PCR: ssä alukkeiden valinta on erittäin tärkeää. Alukkeiden valinta riippuu myös kokeilumme tavoitteesta.
millaista tietoa haluamme colony PCR-kokeestamme?
-
-
- tiedot vain insertin esiintymisestä tai puuttumisesta.
- tiedot insertin koosta.
- tietoa insertin suunnasta.
-
riippuen siitä, että eri PCR alukkeet on suunniteltu pesäke PCR.
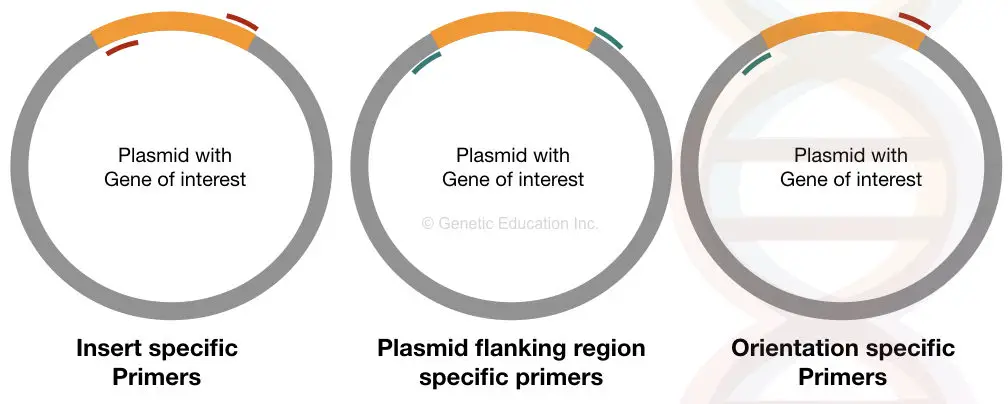
inserttikohtaiset alukkeet sitoutuvat tiettyyn paikkaan kummallekin eduksemme asetetun DNA: n puolelle. Jos se siirretään oikein plasmidiin, nämä alukkeet voivat sitoutua siihen muuten se ei pysty sitoutumaan.
tämä pohjusjoukko antaa tietoa insertin esiintymisestä tai puuttumisesta.
Orientaatiospesifiset alukkeet ovat ainutlaatuisia alukkeita, joissa yksi aluke sitoutuu insertin sisään ja toinen aluke sitoutuu plasmidin DNA-sekvenssiin (sekvenssi muu kuin insertin DNA).
tämänkaltaiset pohjustusjoukot antavat tietoa kiinnostuksemme kohteena olevan insertoidun DNA: n orientaatiosta. Jos insertti-DNA: ta ei ole kunnolla ligoitu vektoriin, sekvenssin tälle puolelle ominainen primer ei voi sitoutua, emmekä saa vahvistusta.
Plasmidispesifiset alukkeet ovat myös yhtä tärkeitä kuin orientaatiospesifiset alukkeet. Tämä joukko alukkeita on suunniteltu reunustavan alueen insertin, joka sitoutuu ulkopuolella DNA meidän edun.
tämä pohjusjoukko auttaa päättelemään insertin koon. Se laajentaa muita alueita kuin insertti-DNA: ta.
PCR-reaktio pesäke-PCR: n suorittamiseen on seuraava,
| komponentti | pitoisuus | määrä |
| Master mix (Special
for the Colony PCR) |
1X | 12µl |
| PCR-reaktiopuskuri
2mm MgCl2: lla* |
1X | 5µL |
| Forward primer | 10pm | 1µL |
| Reverse primer | 10pm | 1µL |
| supernatantti | 3µL | |
| vesi | 3µL | |
| yhteensä | ——— | 25µL |
pesäkkeiden PCR:
no, pesäkkeiden PCR ei tarvitse uutettua DNA: ta.
emme ota tästä DNA: ta. Sen sijaan käytetään useita muita menetelmiä reaktion herkkyyden lisäämiseksi.
OK, miksi emme ota DNA: ta plasmidin DNA: ta varten?
koska syy on yksinkertainen, bakteerisolun solukalvo on hyvin sileä.
olimme jo keskustelleet bakteerisolun solukalvosta. Lue se täältä: erilaiset DNA: n uuttamismenetelmät
a-bakteeri sisältää pehmeää solukalvoa, joka voidaan helposti lysäyttää kuumentamalla tai sentrifugoimalla sitä suurella nopeudella.
myöskään bakteerin omaa DNA: ta ei tarvita. Kiertävä Pyöreä plasmidi on bakteerien sytoplasmassa, joten lisäpuhdistusvaiheita ei tarvita. Repimällä solukalvon DNA on valmis vahvistukseen.
Ok, käydään nopeasti läpi menetelmä, jolla saadaan hyvä plasmidi-DNA.
steriilin poimijan avulla poimitaan useita bakteeripesäkkeitä ja siirretään ne eppendorfin putkeen.
lisää Nyt TE-puskuri siihen ja sekoita hyvin. Voit käyttää myös D/W: tä.
näytettä kuumennetaan kiehuvassa vesihauteessa 20 minuuttia.
paina sitä kevyesti.
näytettä sentrifugoidaan suurella nopeudella 2 minuutin ajan.
siirrä supernatantti toiseen putkeen ja käytä sitä templaatti-DNA: na.
reaktioon lisätään 20µl näyte.
lisätietoja:
miksi supernatantti eikä pelletti?
DNA on elämän biomolekyyliä. Plasmidi-DNA on vielä pienempi kuin bakteerin ydin-DNA. Se sisältää vain useita geenejä jopa 1000 BP-20 000 bp.
näin ollen vain sentrifugoimalla kevyempi plasmidi-DNA tulee ulos solusta ja asettuu supernatanttiin, kun taas pelletti sisältää proteiineja ja ydin-DNA: ta, joten emme käytä sitä.
nyt tulossa pisteeseen.
plasmidimme on valmis vahvistettavaksi.
toisessa menetelmässä
käytä bakteeripesäkettä suoraan.
tämä menetelmä on yhdistelmä Hotstart PCR: ää ja colony PCR: ää.
bakteeripesäkkeet poimitaan ja lisätään PCR-reaktioputkeen.
putket laitetaan PCR-koneeseen. Lisäksi lisätään yksi lämmitysvaihe.
kuumentamalla sitä 5-7 minuuttia plasmidin DNA tulee ulos solusta.
nyt inserttikohtaiset alukkeet vahvistavat lisäämämme DNA: n. Alukkeet vahvistavat loput DNA: sta.
vahvistus tehdään 20-25 kierrosta. Seuraavassa on lueteltu yhdyskunnan PCR: n sykliolosuhteet,
| PCR-vaiheet | Alkudenaturaatio | denaturaatio | hehkutus | laajennus | lopullinen laajennus | |
| lämpötila | 95 C | 95 C | 95 C | 55-65 C | 72 C | 72 C |
| aika | 3min | 10 sek | 45 sek | 50 sek | 5 min | |
| ——- | ——- | 25 syklit | —– | ——- |
lue mielenkiintoinen artikkeli tavanomaisesta PCR: stä: a Complete Guide of the Polymerase Chain Reaction
Tips for improvement:
käytä vain muutamia pesäkkeitä, sillä monet pesäkkeet lisäävät epäspesifisten sidosten mahdollisuutta.
käytetään positiivista kontrollia ja negatiivista kontolia.
koska positiivisena kontrollina käytettiin sivuperustetta, vaikka inserttiä ei olisikaan, PCR-reaktio antaa plasmidi-DNA: n DNA-kaistan, joka osoittaa, että valmistamamme reaktio on oikea.
negatiivisena kontrollina käytetään transformoimatonta plasmidia (plasmidi ilman inserttiä DNA: ta), tämä plasmidi-DNA monistuu vain, jos insertti on läsnä.
insertissä käytetään lyhyitä DNA-sekvenssejä, pidemmät DNA-sekvenssit lisäävät epäspesifisten sidosten ja PCR-reaktion epäonnistumisen mahdollisuutta.
käytä lisäksi lyhyempiä PCR-ohjelmia.
pesäkkeiden PCR: n pääasiallinen käyttökohde on oikean ligaation tunnistaminen ja insertin DNA: n lisääminen bakteereihin sekä hiivaplasmidi.
pesäke-PCR-reaktion päätyttyä PCR-tuotteet ajetaan 2-prosenttisella agaroosigeelillä. Kokeen tulokset näkyvät oheisessa kuvassa,
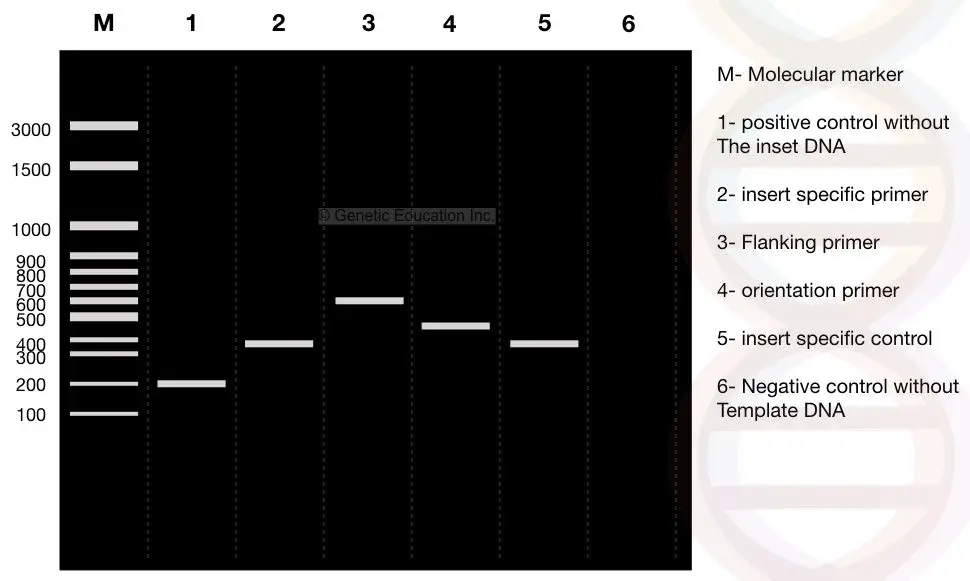
tarkkaile nyt huolellisesti tuloksia, m on 3000bp: n molekyylien DNA-markkeri. Oletetaan, DNA meidän etua, “insert” on 400bp fragmentti, joka työnnetään plasmidi.
Katso kaista 2: inserttimme 400 bp: n kappale.
suunnittelimme sivu-alukkeet 100bp pois molemmilta sivuilta. Jos reunustava primer vahvistaa DNA: ta yhdessä insertin kanssa tuote on 600 bp, katso kaista 3 (400 BP insertin DNA + 200 bp reunustavan alueen).
katso kaistaa 1, se on positiivinen kontrolli ilman inserttiä tai normaali plasmidi ilman muuntunutta DNA: ta. Siksi alukkeet vahvistavat vain 200 bp DNA: ta.
KS.kaista 1, 200 BP: n DNA-fragmentti ilman inserttiä (positiivinen kontrolli).
nyt, tarkkaile kaistaa 4. Kaista 4 on suuntakohtaisten alukkeiden tulos. Orientaatiosidonnainen pohjustusaine on pohjustuskohtaisen pohjustusaineen ja reunusaluesidonnaisen pohjustusaineen yhdistelmä.
orientaatiovahvistukseen valitaan yksi pohjustin insert DNA: sta ja yksi reunusaluekohtainen pohjustin.
näin ollen 100 bp: n fragmentti sivualueen alukkeesta ja 400 BP: n fragmentti insertistä DNA monistetaan ja 500 bp: n DNA: n fragmentti havaitaan kaistalla 4.
kaista 5 on inserttispesifinen kontrolli, joka antaa 400 bp: n DNA-fragmentin.
kaista 6 on negatiivinen kontrolli ilman mallia. Negatiivisen kontrollin avulla voidaan havaita mahdollinen kontaminaatio. Reaktioputkessa on kaikki ainekset sapluunaa lukuun ottamatta. Ihannetapauksessa tällä kaistalla ei ole DNA-nauhoja.
jos havaitaan DNA-alue, näyte on kontaminoitunut.
pesäkkeiden PCR: n edut:
- tekniikka on nopea ja kustannustehokas.
- edelleen tekniikan tarkkuus ja spesifisyys ovat korkeampia.
- asetelma on yksinkertainen aivan kuten perinteinen PCR, DNA: n poisto ja plasmidin puhdistus kuten työläitä vaiheita ei tarvita.
- ei tarvita restriktiodigestiota insertin DNA: n tunnistamiseksi.
- koko koe voidaan suorittaa 90 minuutissa.
pesäkkeiden PCR: n haitat:
- menetelmä on kustannustehokas, nopea ja luotettava, mutta mitään mutaatiota insertissä ei voida havaita.
- lisäksi sekvenssitietoja ei voi saada pesäke PCR: llä. meidän täytyy sekvensoida DNA: n muutos.
- väärien positiivisten tulosten mahdollisuus on suuri.
Lue lisää;
- mikä on multiplex PCR?
kokeen päätyttyä näyte lähetetään sekvensoitavaksi, jossa kiinnostuksemme DNA-sekvenssi voidaan määrittää.
voimme jopa tehdä multiplex PCR: ää yhdistämällä sekä insert specific alukkeet että plasmidispesifiset alukkeet.
johtopäätös:
vaikka yhdyskunnan PCR on paras valinta geeninsiirron tunnistamiseksi, ainoa yhdyskunnan PCR-tekniikka ei riitä tulosten tulkintaan. Saattaa olla mahdollista, että osa mutaatioista esiintyy insertissä, jota PCR ei voi havaita.
tulosten varmistamiseen tarvitaan DNA-sekvensointi. Määritettyään sekvenssin järjestyksessä voimme sanoa, onko meidän geeni kiinnostaa on asetettu oikein vai ei.