Frontiers in Endocrinology
- Einleitung
- Materialien und Methoden
- Studiendesign und Teilnehmermerkmale
- Intervention
- Bewertung der Ergebnisse
- Isolierung von Lymphozytenzellen
- RNA-Extraktion und Echtzeit-PCR (RT-PCR)
- Stichprobengröße und statistische Methoden
- Ergebnisse
- Diskussion
- Auswirkungen von Chrom auf die Genexpression von Insulin und den Fettstoffwechsel
- Auswirkungen von Chrom auf die Genexpression von Entzündungsmarkern
- Autorenbeiträge
- Finanzierung
- Interessenkonflikterklärung
Einleitung
Das polyzystische Ovarialsyndrom (PCOS), die Hauptursache für Anovulation und Unfruchtbarkeit bei Frauen im gebärfähigen Alter, ist die häufigste endokrine Störung, die die Entwicklung von 5-10% der Frauen weltweit (1). Eine beschleunigte Lipolyse und anschließende Dyslipidämie bei Frauen mit PCOS ist mit Stoffwechselstörungen wie Fettleibigkeit, Insulinresistenz und Typ-2-Diabetes (T2DM) verbunden (2). Die reflektierten Veränderungen in der Follikelflüssigkeit (FF) des dominanten Follikels (3, 4) können die Qualität und den Metabolismus der Eizelle direkt beeinflussen. Low-Grade chronische Entzündung wird häufig als ätiopathogenetischer Mechanismus der Unfruchtbarkeit verantwortlich gemacht. Entzündliche Zytokine sind bei Frauen mit ungeklärter Unfruchtbarkeit signifikant höher (5). Es wurde gezeigt, dass entzündungsfördernde Faktoren bei Frauen mit ungeklärter Unfruchtbarkeit signifikant mit höheren Ausfallraten der In-vitro-Fertilisation (IVF), insbesondere im Implantationsstadium, assoziiert sind (6). Studien haben erhöhte Interferon-Gamma (IFN-γ) – und Interleukin-2 (IL-2) -Spiegel und verringerte Transforming Growth Factor Beta (TGF-β) -Spiegel, einen wichtigen endogenen entzündungshemmenden Mediator, (7) im Plasma von Frauen mit ungeklärter Unfruchtbarkeit im Vergleich zu fruchtbaren Kontrollen während des Implantationsfensters (Lutealphase) (8). Darüber hinaus haben ungeklärte unfruchtbare Patienten im Vergleich zu fruchtbaren Frauen erhöhte Spiegel von Serum-IL-2, IL-4, IL-6, IL-21, Tumornekrosefaktor alpha (TNF-α) und IFN-γ gezeigt (5).
Über die positiven Wirkungen von Chrompräparaten auf Stoffwechselstörungen bei Frauen mit PCOS wurde bereits berichtet. In einer Metaanalyse von Fazelian et al. (9), Chromergänzung verringerte Seruminsulin und freies Testosteron und verbesserte Körpergewicht bei Patienten mit PCOS. Wir haben bereits Vorteile der Einnahme von Chrompräparaten für 8 Wochen auf glykämische Kontrolle, kardiometabolische Risikoparameter und oxidativen Stress bei unfruchtbaren Frauen mit PCOS veröffentlicht, die Kandidaten für IVF waren (10). Ferner zeigte eine Chromsupplementierung bei diabetischen Ratten antidiabetische Aktivitäten, die durch den Einfluss von Chrom auf die Modulation von Peroxisom-Proliferator-aktiviertem Rezeptor-Gamma (PPAR-γ), Insulinrezeptorsubstrat 1 (IRS-1) und Kernfaktor kB (NF-kB) erklärt werden können) Proteine (11). In ähnlicher Weise Wang et al. (12) fanden heraus, dass diejenigen, die mit Chrom ergänzt wurden, im Vergleich zu adipösen Kontrollratten eine signifikante Verbesserung ihrer Glukoseentsorgungsraten und eine Erhöhung der insulinstimulierten p-IRS-1- und Phosphatidylinositol-3-Kinaseaktivität in der Skelettmuskulatur aufwiesen. In einem anderen Tierversuch verringerte die Einnahme von Chrom über 7 Wochen durch diabetische Ratten die Entzündungsmarker einschließlich C-reaktives Protein (CRP), TNF-α und IL-6 signifikant (13).
In Anbetracht der antidiabetischen und lipidsenkenden Wirkung von Chrom (11, 14) stellten wir die Hypothese auf, dass eine Chromergänzung bei Frauen mit PCOS und IVF-Kandidaten, die an verschiedenen Stoffwechselstörungen leiden, von Vorteil sein könnte. Nach unserem besten Wissen wurde nichts über die Auswirkungen einer Chromsupplementierung auf die Genexpression von Insulin, Lipid und Entzündungsmarkern bei unfruchtbaren Frauen mit PCOS veröffentlicht, die für eine IVF in Frage kamen. Diese Studie zielte darauf ab, die Auswirkungen einer Chromsupplementierung auf die Genexpression von Insulin, Lipiden und Entzündungsmarkern bei unfruchtbaren Frauen zu bestimmen, die an PCOS litten und für IVF in Frage kamen.
Materialien und Methoden
Studiendesign und Teilnehmermerkmale
Diese randomisierte, doppelblinde, placebokontrollierte Studie wurde von der iranischen Website für die Registrierung klinischer Studien registriert (http://www.irct.ir:IRCT20170513033941N32). Vierzig unfruchtbare Frauen mit PCOS im Alter von 18 bis 40 Jahren, die Kandidaten für IVF ohne IVF-Vorgeschichte waren, wurden eingeschlossen. Diese Studie wurde zwischen Februar und Mai 2018 im Taleghani Hospital in Teheran, Iran, durchgeführt. Rotterdam-Kriterien wurden verwendet, um die Diagnose von PCOS zu bestätigen (15). Teilnehmer mit Stoffwechselstörungen, einschließlich Schilddrüsenfunktionsstörungen, Diabetes oder eingeschränkter Glukosetoleranz, wurden von der Studie ausgeschlossen. Diese Untersuchung wurde in Übereinstimmung mit der Erklärung von Helsinki und den Richtlinien für gute klinische Praxis durchgeführt und von der Forschungsethikkommission der Shahid Beheshti University of Medical Sciences (SUMS), Teheran, Iran, genehmigt. Die schriftliche Einverständniserklärung wurde von allen Personen unterzeichnet.
Intervention
Die Teilnehmer wurden randomisiert in Interventionsgruppen eingeteilt, um entweder 200 µg / Tag Chrompicolinat (Nature Made, Kalifornien, USA) (n = 20) oder Placebo (Barijah, Kashan, Iran) (n = 20) für 8 Wochen einzunehmen. Chromergänzungen und Placebos wurden in Bezug auf Form, Aussehen, Geruch und Verpackung aufeinander abgestimmt. Die Randomisierung erfolgte mit computergenerierten Zufallszahlen. Randomisierung und Zuordnungsprozess wurden sowohl den Forschern als auch den Teilnehmern bis zum Abschluss der endgültigen Analysen verborgen. Eine andere Person, die nicht an der Studie beteiligt war und keine zufälligen Sequenzen kannte, ordnete die Probanden den nummerierten Tablettenflaschen zu. Die Einhaltung der Nahrungsergänzungsmittel und Placebos wurde während der gesamten Studie überwacht und die Personen gebeten, die Medikamentenbehälter zurückzubringen. Um die Compliance-Rate zu erhöhen, erhielten alle Teilnehmer kurze tägliche Erinnerungsnachrichten auf ihren Handys, um die Ergänzungen zu nehmen. Die Studienteilnehmer schlossen diätetische Aufzeichnungen in Woche 0, 4 und 8 der Intervention ab.
Bewertung der Ergebnisse
Die Spiegel des hochempfindlichen C-reaktiven Proteins (hs-CRP) im Serum wurden als primäres Ergebnis betrachtet und metabolische Profile wurden als sekundäre Ergebnisse gemessen. Nüchternblutproben (15 ml) wurden zu Beginn und am Ende der 8-wöchigen Intervention im Taleghani Hospital (Teheran, Iran) entnommen. Die Hs-CRP-Spiegel wurden unter Verwendung eines kommerziellen ELISA-Kits (LDN, Nordhorn, Deutschland) mit Inter- und Intra-Assay-Koeffizientenvarianzen (CVs) von weniger als 7% gemessen. Die Plasma-Stickoxid (NO) -Spiegel wurden nach der Griess-Methode (16) mit einem Intra-Assay-CVs von < 5% gemessen.
Isolierung von Lymphozytenzellen
Zur Extraktion von Lymphozytenzellen wurden Blutproben unter Verwendung von 50% Percoll (Sigma-Aldrich, Dorset, UK) verwendet. Zellzahl und Lebensfähigkeitstest wurden unter Verwendung von Trypanblau, RNA und DNA-Extraktion durchgeführt (17).
RNA-Extraktion und Echtzeit-PCR (RT-PCR)
RNA wurde aus Blutproben unter Verwendung des RNX-plus-Kits (Cinnacolon, Teheran, Iran) extrahiert. Die RNA-Suspension wurde bei -20 ° C eingefroren, bis die cDNA abgeleitet war. Nach der Extraktion der gesamten RNAs aus jeder Probe wurde die RNA mit einem UV-Spektrophotometer quantifiziert. Jede Probe OD 260/280 Verhältnis von 1,7–2,1 stellte keine Kontamination mit Protein oder DNA dar (17). Unter Verwendung der Moloney murine leukemia Virus Reverse Transkriptase (RT) wurde isolierte RNA in die cDNA-Bibliothek reverse transkribiert. Die Genexpression von PPAR-γ, Glucosetransporter 1 (GLUT-1), Low-Density-Lipoproteinrezeptor (LDLR), IL-1, IL-8, TNF-α, TGF-β und vaskulärem endothelialem Wachstumsfaktor (VEGF) wurde an mononukleären Zellen (PBMCs) von peripherem Blut unter Verwendung des SYBR green Detection and Amplicon Kits und unter Anwendung quantitativer RT-PCR- und Light Cycler-Technologie (Roche Diagnostics, Rotkreuz, Schweiz) durchgeführt (Tabelle 1). Glyceraldehyd-3-phosphat-Dehydrogenase (GAPDH)-Primer wurden als Housekeeping-Gen verwendet. Primer wurden mit Primer Express Software (Applied Biosystems, Foster City, USA) und Beacon Designer Software (Takaposizt, Teheran, Iran) entworfen. Die relativen Transkriptionsniveaus wurden mit Pffafi− oder 2-ΔΔCT-Methoden berechnet.

Tabelle 1. Spezifische Primer für quantitative Echtzeit-PCR.
Stichprobengröße und statistische Methoden
Die Stichprobengröße wurde unter Verwendung der etablierten Formel für RCTs berechnet, wobei Fehler vom Typ eins (α) und Typ zwei (β) als 0,05 und 0 angesehen wurden.20, um die Leistung von 80% bereitzustellen. Basierend auf einer früheren veröffentlichten Studie (18) wurden eine mittlere Differenz (d) von 1500,0 ng / ml und eine Standardabweichung (SD) von 1496,1 ng / ml für hs-CRP verwendet, um die Stichprobengröße zu berechnen. Unter Berücksichtigung eines wahrscheinlichen Abbruchs von 4 Probanden in jeder Interventionsgruppe wurde die endgültige Stichprobengröße auf 20 (16 + 4) Probanden pro Gruppe festgelegt.
Die Normalität der Daten wurde mit dem Kolmogorov-Smirnov-Test bewertet. Die Analysen wurden unter Verwendung des Intention-to-Treat (ITT) -Ansatzes durchgeführt. Unabhängige Proben T-Test wurde angewendet, um die Unterschiede in anthropometrischen Messungen und Genexpression von Insulin, Lipid und Entzündung zwischen Interventionsgruppen zu bestimmen. Die Auswirkungen der Chromsupplementierung auf Entzündungsmarker wurden unter Verwendung von ANOVA-Tests mit wiederholten Messungen bewertet. Unterschiede in den Proportionen wurden durch Fishers exakten Test bewertet. Die P < 0,05 wurden als statistisch signifikant angesehen. Statistische Analysen wurden mit dem Statistical Package for Social Science Version 18 (SPSS Inc., Chicago, Illinois, USA).
Ergebnisse
In jeder Interventionsgruppe wurden aus persönlichen Gründen drei Studienabbrecher gemeldet. Insgesamt haben also 34 Teilnehmer die Studie abgeschlossen (Abbildung 1). Mit dem ITT-Ansatz wurden alle 40 Teilnehmer (20 in jeder Gruppe) in die endgültige Datenanalyse einbezogen. Die Compliance-Rate in dieser Studie war hoch, wobei mehr als 90% der Tabletten während der Intervention in beiden Gruppen konsumiert wurden. In dieser Studie wurden keine Nebenwirkungen nach dem Verzehr von Chrom bei Frauen mit PCOS berichtet.

Abbildung 1. Zusammenfassung des Patientenflussdiagramms.
Anthropometrische Messungen unterschieden sich statistisch nicht zwischen den Interventionsgruppen (Tabelle 2). Darüber hinaus unterschieden sich die IVF-Ergebnisse nach einer Chromsupplementierung, einschließlich Endometriumdicke, Anzahl der entnommenen Eizellen, Anzahl der befruchteten Eizellen, Befruchtungsrate, Schwangerschaftsrate und Anzahl der Embryonen, nicht signifikant zwischen der ergänzten und der Placebogruppe.

Tabelle 2. Allgemeine Merkmale der Studienteilnehmer.
Der Durchschnitt der Makro- und Mikronährstoffzufuhr unterschied sich auch nicht signifikant zwischen zwei Interventionsgruppen während der gesamten Behandlung (Daten nicht gezeigt).

Tabelle 3. Entzündungsmarker zu Studienbeginn und nach der 8-wöchigen Intervention bei unfruchtbaren Frauen mit polyzystischem Ovarialsyndrom Kandidaten für eine In-vitro-Fertilisation, die entweder Chrompräparate oder Placebo erhielten.
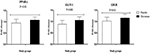
Abbildung 2. Faltenänderung (Mittelwert ± SDs) der Genexpressionsspiegel von PPAR-γ, GLUT-1 und LDLR bei Frauen mit polyzystischem Ovarialsyndrom, die für eine In-vitro-Fertilisation in Frage kamen und Chrompräparate und Placebo erhielten. Der P-Wert wurde aus einem unabhängigen T-Test ermittelt. N = 20 in jeder Gruppe. IL-1, Interleukin-1; IL-8, Interleukin-8; LDLR, oxidierter Lipoproteinrezeptor niedriger Dichte; PPAR-γ, Peroxisomproliferator-aktivierter Rezeptor Gamma; TNF-α, Tumornekrosefaktor alpha; TGF-β, transformierender Wachstumsfaktor Beta; VEGF, vaskulärer endothelialer Wachstumsfaktor.
Eine Chromsupplementierung regulierte auch die Genexpression von IL-1 (P = 0,004) in PBMC im Vergleich zum Placebo (Abbildung 3). Es gab keinen signifikanten Effekt der Chromsupplementierung auf die Genexpression von IL-8, TNF-α, TGF-β und VEGF in PBMC von Patienten mit PCOS.
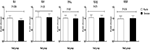
Abbildung 3. Veränderung (Mittelwert ± SDs) der Genexpressionsspiegel von IL-1, IL-8, TNF-α, TGF-β und VEGF bei Frauen mit polyzystischem Ovarialsyndrom, die für eine In-vitro-Fertilisation in Frage kamen und Chrompräparate und Placebo erhielten. Der P-Wert wurde aus einem unabhängigen T-Test ermittelt. N = 20 in jeder Gruppe. IL-1, Interleukin-1; IL-8, Interleukin-8; LDLR, oxidierter Lipoproteinrezeptor niedriger Dichte; PPAR-γ, Peroxisomproliferator-aktivierter Rezeptor Gamma; TNF-α, Tumornekrosefaktor alpha; TGF-β, transformierender Wachstumsfaktor Beta; VEGF, vaskulärer endothelialer Wachstumsfaktor.
Diskussion
Wir fanden positive Auswirkungen der Chromverabreichung für 8 Wochen bei unfruchtbaren Frauen mit PCOS, die Kandidaten für IVF waren. Eine Chromsupplementierung senkte die Entzündung und verbesserte die Genexpression von PPAR-γ, GLUT-1, LDLR und IL-1, obwohl sie die Genexpression von IL-8, TNF-α, TGF-β und VEGF nicht beeinflusste. Nach unserem besten Wissen ist dies die erste Studie, in der die Auswirkungen einer Chromsupplementierung auf die Genexpression in Bezug auf Insulin, Lipid und Entzündungsmarker bei unfruchtbaren Frauen mit PCOS diagnostiziert und Kandidat für IVF.
Auswirkungen von Chrom auf die Genexpression von Insulin und den Fettstoffwechsel
Patienten mit PCOS sind anfällig für verschiedene Stoffwechselstörungen wie erhöhte Insulinresistenz, Dyslipidämie und chronische Entzündungen (19, 20). Die aktuelle Studie ergab, dass eine 8-wöchige Chromsupplementierung bei unfruchtbaren Frauen mit PCOS, die für eine IVF in Frage kamen, die Genexpression von PPAR-γ, GLUT-1 und LDLR signifikant erhöhte. In Übereinstimmung mit unseren Ergebnissen zeigte die Chromverabreichung an diabetische Ratten antidiabetische Aktivitäten, die wahrscheinlich mit dem Einfluss von Chrom auf die Modulation von PPAR-γ- und IRS-1-Proteinen zusammenhängen (11). In: Wang et al. (12) fanden auch heraus, dass übergewichtige Ratten, die mit Chrom ergänzt wurden, ihre Glukoseentsorgungsraten signifikant erhöhten. Darüber hinaus zeigten diese Ratten im Vergleich zu adipösen Kontrollen eine Erhöhung der insulinstimulierten p-IRS-1- und Phosphatidylinositol-3-Kinase-Aktivität in den Skelettmuskeln. In einer anderen Studie regulierten Chrom, Biotin oder ihre Kombination die PPAR-γ-Expression im Fettgewebe signifikant, was eine wirksame insulinsensibilisierende Wirkung haben und die Insulinresistenz in einem diabetischen Rattenmodell verringern könnte (11). Chrom kann auch den GLUT-4-Handel und den insulinstimulierten Glukosetransport fördern (21). Ebenso zeigten Ratten mit diabetischer Retinopathie, die 12 Wochen lang mit Chrom supplementiert wurden, eine Verbesserung der Genexpression von GLUT-1, GLUT-3 und Insulin (22). PPAR-γ ist der zentrale Regulator des Insulin-, Glukose- und Fettstoffwechsels, der im Fettgewebe weit verbreitet ist. PPAR-γ könnte die Insulinsensitivität und die Lipidprofile bei Patienten mit Typ-2-Diabetes sowie bei diabetischen Nagetiermodellen verbessern (23). Aktuelle Hinweise deuten darauf hin, dass PPAR-γ-Agonisten bei der Verringerung der nierenkortikalen Lipide und Proteinurie durch einen Mechanismus unabhängig von ihrer hypoglykämischen Wirkung von Vorteil sein können (24, 25).
Auswirkungen von Chrom auf die Genexpression von Entzündungsmarkern
Unsere Studie unterstützte, dass die Verabreichung von Chrom über 8 Wochen die Genexpression von IL-1 und Serum-hs-CRP bei unfruchtbaren Frauen mit PCOS, die Kandidaten für IVF waren, signifikant verringerte, obwohl dies die Genexpression von IL-8, TNF-α, TGF-β und VEGF nicht beeinflusste. Aktuelle Beweise, die die Auswirkungen einer Chromsupplementierung auf die Genexpression von Entzündungsmarkern und deren zirkulierende Spiegel belegen, sind rar und meist auf Tierstudien beschränkt. Eine 8-wöchige Chromsupplementierung bei zuckerdiabetischen Fettratten (ZDF) senkte ihre CRP-Serumspiegel signifikant (26). In einer anderen Studie reduzierte die Einnahme von Chromniacinat über 7 Wochen die entzündungsfördernden Zytokine (TNF-α, IL-6 und CRP), den oxidativen Stress und die Lipidkonzentrationen bei diabetischen Ratten (13). Ferner verringerte die Verabreichung eines Nahrungsergänzungsmittels, das Chrompicolinat, Phosphatidylserin, Docosahexaensäure und Bor über 12 Wochen enthielt, die CRP- und TNF-α-Konzentrationen bei Ratten, die mit einer fettreichen Diät gefüttert wurden, signifikant (27). Wir fanden keine signifikante Wirkung der Chrom-Supplementierung auf IL-8, TNF-α, TGF-β und VEGF, die durch die Anwendung verschiedener Studiendesigns, Art und Dosierungen von Chrom, Interventionsdauer und Teilnehmereigenschaften erklärt werden könnten. Höhere Dosierungen von Chrom können die Stoffwechselprofile einschließlich IL-8, TNF-α, TGF-β und VEGF signifikant verbessern. Die Entzündungsmarker und oxidativer Stress sind bei vielen Diabetikern erhöht, was die Gefäßentzündung positiv darstellt (28). Insulinresistenz und nachfolgende vaskuläre Entzündung sind die Hauptrisikofaktoren für die Entwicklung von CVD (29). Die unterdrückende Wirkung von Chrom auf entzündungsfördernde Marker kann durch Inaktivierung oxidativer Stresswege und Verringerung der Akt-Phosphorylierung im Zusammenhang mit der Insulinresistenzkaskade in der Leber erleichtert werden (30). Aktuelle Erkenntnisse haben gezeigt, dass erhöhte entzündliche Zytokine an den Ergebnissen der IVF beteiligt sind. In einer Studie von Haimovici et al. (31) hatten die Frauen, die ihren Fötus lebend zur Welt brachten, niedrigere IL-6-Spiegel. Die Hemmung von Lutealzellen, die Progesteron in Gegenwart von IL-1β produzieren, kann einer der Faktoren sein, die zum Versagen der Implantation führen (32). Erhöhtes follikuläres TNF-α und IL-6 können die Mikroumgebung im Follikel verschlechtern und dadurch die Qualität von Eizelle und Embryo negativ beeinflussen (33). In einer anderen Studie von Levin et al. (34) waren höhere CRP-Spiegel während der IVF-Stimulation signifikant mit dem Versagen der Empfängnis verbunden. Nach den oben genannten veröffentlichten Erkenntnissen gingen wir davon aus, dass die Ergebnisse der IVF durch eine verminderte Entzündung beeinflusst werden können. Eine kürzlich durchgeführte Studie zeigte, dass die Verwendung von TNF-α-Inhibitor und intravenösem Immunglobulin die Ergebnisse der IVF signifikant verbesserte.; implantation, klinische Schwangerschaft und Lebendgeburtenraten bei jungen unfruchtbaren Frauen mit hohen T-Helfer-1 / T-Helfer-2-Zytokinen (35).
Es gab einige Einschränkungen in dieser Studie. Aufgrund unzureichender Finanzierung konnten wir den Chromgehalt nicht messen und die Auswirkungen von Chrom auf die Genexpression von oxidativem Stress nicht beurteilen.
Insgesamt legt unsere Studie die Vorteile einer Chromsupplementierung bei der Senkung von Entzündungsmarkern nahe Verbesserung der Genexpression von PPAR-γ, GLUT-1, LDLR und IL-1in unfruchtbaren Frauen mit PCOS, die für eine IVF in Frage kamen.
Autorenbeiträge
ZA half bei der Konzeption, Gestaltung und statistischen Analyse des Manuskripts. MA, SZ, NM, EA und SS trugen zur Datenerfassung und Manuskripterstellung bei. ZA beaufsichtigte die Studie.
Finanzierung
Diese Studie wurde durch ein Stipendium des Vizekanzlers für Forschung, der Shahid Beheshti University of Medical Sciences, und Teheran, Iran, unterstützt.
Interessenkonflikterklärung
Die Autoren erklären, dass die Forschung in Abwesenheit von kommerziellen oder finanziellen Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
1. Yildiz BO, Bozdag G, Yapici Z, Esinler I, Yarali H. Prävalenz, Phänotyp und kardiometabolisches Risiko des polyzystischen Ovarialsyndroms unter verschiedenen diagnostischen Kriterien. Hum Reprod. (2012) 27:3067–73. doi: 10.1093/humrep/des232
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
2. Es sind keine frei zugänglichen ergänzenden Materialien verfügbar in: Amato G, Conte M, Mazziotti G, Lalli E, Vitolo G, Tucker AT, et al. Serum- und Follikelflüssigkeitszytokine beim polyzystischen Ovarialsyndrom während stimulierter Zyklen. Obstet Gynecol. (2003) 101:1177–82.
PubMed Zusammenfassung / Google Scholar
3. Valckx SD, Arias-Alvarez M, De Pauw I, Fievez V, Vlaeminck B, Fransen E, et al. Fettsäurezusammensetzung der Follikelflüssigkeit von normalgewichtigen, übergewichtigen und adipösen Frauen, die sich einer assistierten Reproduktionsbehandlung unterziehen: eine beschreibende Querschnittsstudie. In: Reprod Biol Endocrinol. (2014) 12:13. doi: 10.1186/1477-7827-12-13
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
4. De Pauw I, De Neubourg D, Inion I, Berth M, Fransen E, et al. BMI-bezogene metabolische Zusammensetzung der Follikelflüssigkeit von Frauen, die sich einer assistierten Reproduktionsbehandlung unterziehen, und die Folgen für die Eizellen- und Embryonenqualität. Hum Reprod. (2012) 27:3531–9. doi: 10.1093/humrep/des350
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
7. Letterio JJ, Roberts AB. Regulation der Immunantwort durch TGF-beta. In: Annu Rev Immunol. (1998) 16:137–61
PubMed Abstract | Google Scholar
8. Fornari MC, Sarto A, Berardi VE, Martinez MA, Rocha MG, Pasqualini S, et al. Effect of ovaric hyper-stimulation on blood lymphocyte subpopulations, cytokines, leptin and nitrite among patients with unexplained infertility. Am J Reprod Immunol. (2002) 48:394–403.
PubMed Abstract | Google Scholar
10. Jamilian M, Zadeh Modarres S, Amiri Siavashani M, Karimi M, Mafi A, Ostadmohammadi V, et al. Die Einflüsse der Chrom-Supplementierung auf die glykämische Kontrolle, Marker des kardiometabolischen Risikos und oxidativen Stress bei unfruchtbaren polyzystischen Ovarialsyndrom Frauen Kandidaten für In-vitro-Fertilisation: eine randomisierte, doppelblinde, placebokontrollierte Studie. Biol Trace Elem Res. (2018):48-55. doi: 10.1007/s12011-017-1236-3
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
11. Sahin K., Tuzcu M., Orhan C., Sahin N., Kucuk O., Ozercan IH, et al. Antidiabetische Aktivität von Chrompicolinat und Biotin bei Ratten mit Typ-2-Diabetes, induziert durch fettreiche Ernährung und Streptozotocin. Br J Nutr. (2013) 110:197–205. doi: 10.1017/S0007114512004850
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
13. Jain SK, Rains JL, Croad JL. Wirkung von Chromniacinat und Chrompicolinat Supplementierung auf Lipidperoxidation, TNF-alpha, IL-6, CRP, glykiertes Hämoglobin, Triglyceride und Cholesterinspiegel im Blut von Streptozotocin-behandelten diabetischen Ratten. Kostenlos Radic Biol Med. (2007) 43:1124–31. doi: 10.1016/j.freeradbiomed.2007.05.019
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
14. Martino F, Puddu PE, Pannarale G, Colantoni C, Martino E, Niglio T, et al. Niedrig dosiertes Chrom-Polynicotinat oder Policosanol ist bei hypercholesterinämischen Kindern nur in Kombination mit Glucomannan wirksam. Atherosklerose. (2013) 228:198–202. doi: 10.1016/j.Atherosklerose.2013.02.005
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
15. Rotterdam ESHRE / ASRM-Gesponserte PCOS Konsens Workshop-Gruppe. Überarbeiteter Konsens von 2003 über diagnostische Kriterien und langfristige Gesundheitsrisiken im Zusammenhang mit dem polyzystischen Ovarialsyndrom. Fertil Steril. (2004) 81:19–25.
Google Scholar
17. Dunkley PR, Jarvie PE, Robinson PJ. Ein schnelles perkolloidales Verfahren zur Herstellung von Synaptosomen. Nat. (2008) 3:1718–28. Kennziffer: 10.1038/nprot.2008.171
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
18. Esmaillzadeh A., Esmaillzadeh A., Esmaillzadeh A., Esmaillzadeh M., Esmaillzadeh M., Esmaillzadeh M., Esmaillzadeh M. Die Auswirkungen der Chrom-Supplementierung auf endokrine Profile, Biomarker der Entzündung und oxidativen Stress bei Frauen mit polyzystischem Ovarialsyndrom: eine randomisierte, doppelblinde, placebokontrollierte Studie. Biol Trace Elem Res. (2016) 172:72-8. doi: 10.1007/s12011-015-0570-6
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
19. Asemi Z, Foroozanfard F, Haschemi T, Bahmani F, Jamilian M, Esmaillzadeh A. Calcium-plus-Vitamin-D-Supplementierung beeinflusst den Glukosestoffwechsel und die Lipidkonzentrationen bei übergewichtigen und adipösen Frauen mit Vitamin-D-Mangel mit polyzystischem Ovarialsyndrom. Clin Nutr. (2015) 34:586–92. Ursprungsbezeichnung: 10.1016/j.clnu.2014.09.015
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
20. Foroozanfard F., Jamilian M., Bahmani F., Talaee R., Talaee N., Hashemi T., et al. Calcium-plus-Vitamin-D-Supplementierung beeinflusst Biomarker von Entzündungen und oxidativem Stress bei übergewichtigen und vitamin-D-defizienten Frauen mit polyzystischem Ovarialsyndrom: eine randomisierte doppelblinde placebokontrollierte klinische Studie. In: Clin Endocrinol. (2015) 83:888–94. doi: 10.1111/cen.12840
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
21. Die Ergebnisse wurden in folgenden Studien veröffentlicht: Chen G, Liu P, Pattar GR, Tackett L, Bhonagiri P, Strawbridge AB, et al. Chrom aktiviert den Glukosetransporter 4-Handel und verbessert den insulinstimulierten Glukosetransport in 3T3-L1-Adipozyten über einen cholesterinabhängigen Mechanismus. Mol Endocrinol. (2006) 20:857–70. doi: 10.1210/mir.2005-0255
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
24. Es sind keine frei zugänglichen ergänzenden Materialien verfügbar in: Benigni A, Zoja C, Campana M, Corna D, Sangalli F, Rottoli D, et al. Die vorteilhafte Wirkung des TGFbeta-Antagonismus bei der Behandlung der diabetischen Nephropathie hängt davon ab, wann die Behandlung begonnen wird. In: Nephron Exp Nephrol. (2006) 104: e158–68. doi: 10.1159/000094967
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
25. Bobulescu IA. Renaler Lipidstoffwechsel und Lipotoxizität. In: Curr Opin Nephrolics. (2010) 19:393–402. doi: 10.1097/POSTFRISCH.0b013e32833aa4ac
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
26. Jain SK, Croad JL, Velusamy T, Rains JL, Bull R. Chrom-Dinicocysteinat-Supplementierung kann Blutzucker, CRP, MCP-1, ICAM-1, Kreatinin senken, anscheinend vermittelt durch erhöhte Blut Vitamin C und Adiponektin und Hemmung von NFkappaB, Akt und Glut-2 in Lebern von Zucker diabetischen Fettratten. Mol Nutr Lebensmittel Res. (2010) 54: 1371-80. doi: 10.1002/mnfr.200900177
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
27. Sahin N, Akdemir F, Orhan C, Aslan A, Agca CA, Gencoglu H, et al. A novel nutritional supplement containing chromium picolinate, phosphatidylserine, docosahexaenoic acid, and boron activates the antioxidant pathway Nrf2/HO-1 and protects the brain against oxidative stress in high-fat-fed rats. Nutr Neurosci. (2012) 15:42–7. doi: 10.1179/1476830512Y.0000000018
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Haimovici F, Anderson JL, Bates GW, Racowsky C, Ginsburg ES, Simovici D, et al. Stress, Angstzustände und Depressionen beider Partner bei unfruchtbaren Paaren sind mit Zytokinspiegeln und nachteiligen IVF-Ergebnissen verbunden. In: Am J Reprod Immunol. (2018) 79:e12832. modell: 10.1111/aji.12832
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
32. In: Wang XF, Xing FQ, Chen SL. Interleukin-1beta-Expression auf Ovarialgranulosazellen und ihre klinische Implikation bei Frauen, die sich einer In-vitro-Fertilisation unterziehen. Di Yi Jun Yi Da Xue Xue Bao. (2002) 22:934–6.
PubMed Zusammenfassung / Google Scholar
33. Wunder DM, Müller MD, Birkhauser MH, Bersinger NA. Erhöhte ENA-78 in der Follikelflüssigkeit von Patienten mit Endometriose. Acta Obstet Gynecol Scand. (2006) 85:336–42. doi: 10.1080/00016340500501715
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar