Frontiers in Medicine
- Einleitung
- Patienten und Methoden
- Patientenauswahl in der Surveillance, Epidemiology, and End Results Database
- Statistische Analyse
- Ergebnisse
- Patientenmerkmale
- Verbessertes Risiko für das T1-Stadium im Vergleich zu anderen T-Stadien im Zusammenhang mit einer Erhöhung der Serum-CEA
- Wirkung der präoperativen Serum-CEA-Erhöhung im T-Stadium
- Data Availability Statement
- Ethikerklärung
- Autorenbeiträge
- Interessenkonflikt
- Danksagungen
Einleitung
Rektumkarzinom ist eine der häufigsten malignen Erkrankungen weltweit (1). Laut dem American Joint Committee on Cancer (AJCC) Staging System ist das anatomische Ausmaß des Primärtumors (T-Stadium) einer der wichtigsten prognostischen Prädiktoren. Patienten mit demselben T-Stadium des Rektumkarzinoms können jedoch erheblich unterschiedliche klinische Ergebnisse aufweisen.
Erstmals 1965 berichtet, ist das karzinoembryonale Antigen (CEA) ein 180-200 kDa Glykoprotein und ein Mitglied der Immunglobulin-Superfamilie (2). CEA wird von einer Vielzahl solider Tumoren sezerniert, darunter 90% der Darmkrebserkrankungen (3). Als wichtigster und zuverlässigster prognostischer Biomarker im Serum Bei Darmkrebs wurden erhöhte präoperative CEA-Spiegel gefunden assoziiert mit einer schlechteren Prognose von Darmkrebs (4-9).
Frühere Studien haben gezeigt, dass CEA mit Krebszelladhäsion und angeborener Immunität bei Darmkrebs assoziiert war. Darüber hinaus wurde berichtet, dass CEA die Anheftung von Darmkrebszellen an Metastasierungsstellen erleichtert und das Fortschreiten des Tumors unterstützt (10-12).
Traditionell wurde die Fernausbreitung von Tumorzellen als spätes Ereignis angesehen, doch die Ergebnisse mehrerer früherer Studien deuteten darauf hin, dass der Erwerb eines Metastasierungspotentials im sehr frühen Stadium der Tumorprogression erfolgen könnte (13-16). Wo et al. (17) berichteten, dass eine sehr kleine Tumorgröße, die an der Lymphknotenpositivität beteiligt ist, ein Ersatz für aggressive Biologie sein kann. Wir vermuten dann, dass Rektumkarzinom im Frühstadium mit Serum-CEA-Erhöhung könnte auf den frühen Erwerb eines Metastasierungspotentials hindeuten und ein sehr schlechtes Überleben von Rektumkarzinom vorhersagen.
Unseres Wissens wurden jedoch nur wenige Studien berichtet, um die Assoziation von T-Stadium und Serum zu untersuchen CEA-Spiegel (C0 und C1) bei der Bestimmung der Prognose von Rektumkarzinom. Daher führen wir diese große populationsbasierte Studie durch, um zu untersuchen, ob ein sehr frühes T-Stadium im Kontext der Serum-CEA-Erhöhung kann ein Ersatz für biologisch aggressive Erkrankungen sein und vorhersagen für ein schlechtes ursachenspezifisches Überleben (CSS) von Rektumkarzinom. Um den Effekt der Lymphknotenpositivität auf unsere Forschung zu beseitigen, haben wir dann knotenpositive Patienten ausgeschlossen und die Analyse auf Patienten im Stadium I–II konzentriert.
Patienten und Methoden
Patientenauswahl in der Surveillance, Epidemiology, and End Results Database
Als maßgebliche Informationsquelle zur Krebsinzidenz und zum Überleben in den USA und umfassende Quelle bevölkerungsbasierter Informationen, einschließlich aller neu diagnostizierten Krebsfälle, die in an Surveillance, Epidemiology, and End Results (SEER) teilnehmenden Gebieten auftreten, umfasst die SEER-Datenbank ~ 28% der amerikanischen Bevölkerung. Die SEER-Datenbank enthielt keine Identifikatoren und war für Forscher öffentlich zugänglich. SEER * Stat ist eine vom SEER-Programm bereitgestellte Software zum Abrufen von Patienteninformationen über den Online-Zugriff. Zunächst wurde die Fallauflistungssitzung der SEER * Stat-Software (SEER * Stat 8.3.5) verwendet, um alle patientenbezogenen Informationen aufzulisten, und Patienten, bei denen zwischen dem 1. Januar 2004 und dem 31. Dezember 2015 Rektumkarzinom im Stadium I-II (knotennegativ) diagnostiziert wurde, wurden aus der SEER–Datenbank identifiziert (Abbildung 1). Patienten mit Rektumkarzinom wurden anhand der ICD-O-3-Standortcodes C199 und C209 und des Verhaltenscodes 3 (NAACCR-Elemente 522 und 523) identifiziert (9). Wir haben uns dafür entschieden, diese Jahre einzubeziehen, da die Informationen der präoperativen Serum-CEA ab 2004 aufgezeichnet wurden und das SEER-Follow-up 2015 endete.

Abbildung 1. Flussdiagramm der Patientenkohortendefinitionen.
Dann wurden diejenigen, die eine neoadjuvante Strahlentherapie erhielten, keine positive histologische Bestätigung mit unbekannter Rasse, Nicht-Adenokarzinom-Histologien oder keine aktive Nachsorge erhielten, von unserer Studie ausgeschlossen. Patienten mit verfügbarem präoperativem Serum-CEA-Spiegel wurden in unsere Studie eingeschlossen, und wir gruppierten “positiv / erhöht” und “negativ / normal; innerhalb normaler Grenzen” als C1 und C0 (C-Stage Information). Die Cutoff-Werte von CEA betrugen 2,5 ng / ml für Nichtraucher bzw. 5 ng / ml für Raucher. Darüber hinaus wurden die folgenden klinisch-pathologischen Variablen des Patienten ebenfalls aus der SEER-Datenbank abgerufen: T-Stadium, Rasse, Geschlecht, Tumorort, Alter bei Diagnose, Diagnosejahr, Grad und Histologie.
Statistische Analyse
In der vorliegenden Studie wurde der Pearson-Chi-Quadrat-Test verwendet, um alle klinisch-pathologischen Variablen der Patienten aus der SEER-Datenbank zwischen den normalen und erhöhten präoperativen Serum-CEA-Spiegeln zu vergleichen. Einige multivariable Cox-Proportional-Hazard-Modelle wurden erstellt, um unabhängige prognostische Variablen von Rektumkarzinomen in unseren Analysen zu identifizieren. Überlebenskurven wurden unter Verwendung der Kaplan–Meier-Methode generiert, und Unterschiede zwischen den Kurven wurden durch Log-Rank-Test analysiert. Die primären Ergebnisse der vorliegenden Studie waren CSS und Gesamtüberleben (OS). CSS wurde vom Datum der Diagnose bis zum Datum des krebsspezifischen Todes berechnet. Todesfälle, die dem Rektumkarzinom zugeschrieben wurden, wurden als Ereignisse behandelt, und Todesfälle aus anderen Ursachen wurden als zensierte Beobachtungen zum Zeitpunkt des Todes behandelt. Um festzustellen, ob es eine signifikante Interaktion zwischen dem präoperativen Serum-CEA-Spiegel und dem T-Stadium bei der Vorhersage von CSS gab, definierten wir auch eine Interaktionsvariable (T-Stadium und Serum-CEA-Spiegel). Zweiseitiges P < 0,05 wurde als statistisch signifikant angesehen. Statistische Analysen wurden hauptsächlich mit der SPSS Version 22 (IBM Corporation, Armonk, NY, USA) durchgeführt.
Ergebnisse
Patientenmerkmale
Insgesamt wurden zwischen dem 1. Januar 2004 und dem 31. Dezember 2015 19.184 Patienten mit Rektumkarzinom im Stadium I–II aus der SEER-Datenbank identifiziert (Abbildung 1). Von diesen Patienten wurden 13.007 (67,8%) Patienten dem C0-Stadium und 6.177 (32,2%) Patienten dem C1-Stadium zugeordnet. Das AJCC-Staging-System schlug vor, dass sich 6.077 Patienten im T1-Stadium, 4.783 Patienten im T2-Stadium, 7.021 im T3-Stadium und 1.303 im T4-Stadium befanden. Insgesamt 2.560 (13,3%) Patienten starben am Ende der Nachbeobachtungszeit an Rektumkarzinom. Die mediane Nachbeobachtungszeit der gesamten Kohorte betrug 44 Monate (0-143 Monate). Die Ausgangsmerkmale der Patienten sind in Tabelle 1 zusammengefasst.
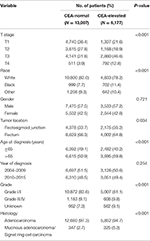
Tabelle 1. Vergleich der Ausgangsmerkmale von Rektumkarzinomen im Stadium I–II anhand des Serumspiegels des karzinoembryonalen Antigens (CEA).
Verbessertes Risiko für das T1-Stadium im Vergleich zu anderen T-Stadien im Zusammenhang mit einer Erhöhung der Serum-CEA
Es wurde festgestellt, dass das C1-Stadium eher mit einem höheren T-Stadium, Schwarz, Rektosigmoidübergang, älterem Alter, höherem Grad und muzinösem Adenokarzinom / Siegelringzellkarzinom korreliert (Tabelle 1, P < 0,05). Wie in Tabelle 2 gezeigt, wurden Rasse, Geschlecht, Tumorort, Alter bei Diagnose, Diagnosejahr, Grad, Histologie, T-Stadium und Serum-CEA-Spiegel in die multivariate Cox-Analyse einbezogen. Als eine multivariate Cox-Analyse durchgeführt wurde, identifizierten wir die folgenden klinisch-pathologischen Merkmale als unabhängige prognostische Faktoren bei Rektumkarzinomen im Stadium I-II; Dazu gehörten Rasse, Geschlecht, Tumorort, Alter bei Diagnose, Tumorgrad, T-Stadium und Serum-CEA-Spiegel, während das Risiko zwischen T2, C0 und T1, C0 kein statistischer Unterschied war (P = 0,925). Es wurde gezeigt, dass im Zusammenhang mit der Serum-CEA-Erhöhung das T1-Stadium ein unerwartet höheres Risiko für eine rektumkarzinomspezifische Mortalität im Vergleich zu den Stadien T2 und T3 aufwies. Im Stadium T1 war ein erhöhter CEA-Serumspiegel mit einem um 227,6% erhöhten Mortalitätsrisiko im Vergleich zum normalen CEA-Serumspiegel verbunden.

Tabelle 2. Multivariate Cox-Regressionsanalysen des ursachenspezifischen Überlebens (CSS) bei Rektumkarzinomen im Stadium I–II.
Kaplan-Meier-Überlebenskurven sind in den Abbildungen 2, 3 dargestellt. Die 5-Jahres-CSS-Rate betrug 92,2% in T1C0, 75,2% in T1C1, 93,1% in T2C0, 86,7% in T2C1, 84,6% in T3C0, 76,3% in T3C1, 62,9% in T4C0 und 43,6% in T4C1 (Abbildung 2, P < 0,001). Daher zeigte T1C1 eine ähnliche 5-Jahres-CSS-Rate im Vergleich zu T3C1 (75,2 vs. 76,3%, P = 0,238). Darüber hinaus war der Befund in OS noch ausgeprägter. Die 5-Jahres-OS-Rate betrug 78,6% in T1C0, 48,3% in T1C1, 77,1% in T2C0, 62,3% in T2C1, 68,5% in T3C0, 54,5% in T3C1, 45,3% in T4C0 und 30,0% in T4C1 (Abbildung 3, P < 0,001). T1C1 wies im Vergleich zu T3C1 eine signifikant niedrigere 5-Jahres-CSS-Rate auf (48,3 vs. 54,5%, P < 0,001).
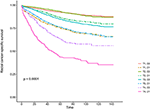
Abbildung 2. Kaplan-Meier Cause-Specific Survival (CSS) -Kurven des T-Stadiums in Kombination mit dem Serum-Carcinoembryonic-Antigen (CEA) -Spiegel.
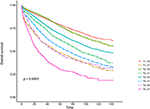
Abbildung 3. Kaplan-Meier-Gesamtüberlebenskurven (OS) des T-Stadiums in Kombination mit dem Serumspiegel des karzinoembryonalen Antigens (CEA).
Wirkung der präoperativen Serum-CEA-Erhöhung im T-Stadium
Das Walddiagramm wurde gezeichnet, um die Hazard Ratios (HRs) zu zeigen, um CSS zwischen normalen und erhöhten CEA-Gruppen in den jeweiligen T-Stadien zu vergleichen (Abbildung 4). Im Vergleich zum normalen Serum-CEA-Spiegel war im Stadium T2 ein erhöhter Serum-CEA-Spiegel mit einem um 69,0% erhöhten Risiko für eine rektumkarzinomspezifische Mortalität verbunden ; Im Stadium T3 war ein erhöhter Serum–CEA-Spiegel mit einem um 67,2% erhöhten Risiko für eine rektumkarzinomspezifische Mortalität verbunden (HR = 1,672, 95% CI = 1,486-1,882, P < 0,001); Im Stadium T4 war ein erhöhter Serum–CEA-Spiegel mit einem um 81,3% erhöhten risiko einer rektumkarzinomspezifischen Mortalität (HR = 1,813, 95% -KI = 1,485-2,213, P < 0,001); Im Gegensatz dazu zeigte sich im Stadium T1 ein erhöhter Serum-CEA-Spiegel sogar bis zu 211.6% erhöhtes Risiko für eine rektumkarzinomspezifische Mortalität (HR = 3,116, 95% -KI = 2,639–3,679, P < 0,001).
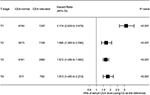
Abbildung 4. Hazard Ratios (HRs) des ursachenspezifischen Überlebens (CSS) zwischen normalem und erhöhtem serumkarzinoembryonalem Antigen (CEA) gemäß dem T-Stadium.
Wir wollten die Assoziation von T-Stadium und Serum-CEA-Spiegel bei der Bestimmung von CSS von Rektumkarzinomen untersuchen. Wir stellten die Hypothese auf, dass Rektumkarzinom mit sehr frühem T-Stadium (Stadium T1) und Serum-CEA-Erhöhung kann ein biologischer Ersatz für aggressive Erkrankungen sein und somit ein schlechtes onkologisches Ergebnis vorhersagen. Mit ~ 20.000 Patienten, bei denen Rektumkarzinom im Stadium I–II diagnostiziert wurde, eingeschlossen in unsere Studie.
In dieser Studie wurde festgestellt, dass die CEA-Erhöhung im Serum eher mit einem höheren T-Stadium, einem schwarzen, rektosigmoiden Übergang, einem höheren Alter sowie einem höhergradigen und muzinösen Adenokarzinom / Siegelringzellkarzinom korrelierte. Kaplan-Meier-Überlebensanalysen zeigten, dass im Zusammenhang mit der Serum-CEA-Erhöhung die 5-Jahres-CSS-Rate im Stadium T1 75,2% betrug, was keinen statistischen Unterschied zum Stadium T3 (76,3%) erzielte. Wenn es um das Gesamtüberleben geht, war die 5-Jahres-OS-Rate im Stadium T1 mit präoperativer Serum-CEA-Erhöhung (48.3%) sogar niedriger als im Stadium T3 mit CEA-Erhöhung (54.5%) und erzielte keinen statistischen Unterschied zum Stadium T4 (45.3%), was bedeutet, dass ein erhöhter präoperativer Serumspiegel von CEA eine Untergruppe von Rektumkarzinomen im Stadium T1 mit ähnlichem CSS im Vergleich zu einigen Erkrankungen im Stadium T3 und mit ähnlichem OS im Vergleich zu einigen Erkrankungen im Stadium T4 identifizieren könnte.
Nach Anpassung an bekannte prognostische Faktoren für Rektumkarzinome (Rasse, Geschlecht, Tumorort, Alter bei Diagnose, Diagnosejahr, Grad und Histologie) wurde die von uns definierte Interaktionsvariable (T-Stadium und Serum-CEA-Spiegel) nachgewiesen ein unabhängiger prognostischer Faktor für Rektumkarzinom. Die multivariate Cox-Analyse zeigte, dass im Zusammenhang mit der Serum-CEA-Erhöhung das T1-Stadium ein unerwartet höheres Risiko für eine rektumkarzinomspezifische Mortalität im Vergleich zu den Stadien T2 und T3 aufwies. Im Stadium T1 war ein erhöhter CEA-Serumspiegel mit einem um 227,6% erhöhten Mortalitätsrisiko im Vergleich zum normalen CEA-Serumspiegel verbunden. Darüber hinaus wurden Rasse, Geschlecht, Tumorort, Alter bei der Diagnose und Tumorgrad als unabhängige prognostische Faktoren für Rektumkarzinom im Stadium I–II identifiziert. Abgesehen von T1 wurde festgestellt, dass eine präoperative Serum-CEA-Erhöhung ein um ~ 75% höheres Risiko für eine rektumkarzinomspezifische Mortalität im jeweiligen T-Stadium darstellte, die Zahl stieg jedoch im T1-Stadium stark auf 211,6%.
Im Jahr 2000 schlug die Kolorektale Arbeitsgruppe des AJCC vor, den Serumspiegel von CEA (C-Stadium) in das konventionelle AJCC-TNM-Staging-System von einzubeziehen Darmkrebs (18). Darüber hinaus haben die American Society of Clinical Oncology und die Europäische Gruppe für Tumormarker beide die Einbeziehung des präoperativen Serum-CEA-Spiegels als prognostisches Instrument bei Darmkrebs unterstützt (19-21).
Mehrere frühere Untersuchungen berichteten, dass der Serum-CEA-Spiegel eine starke prognostische Rolle bei Darmkrebs spielt (4-7, 22-26). Im Jahr 2011 haben Thirunavukarasu et al. (25) berichteten, dass der präoperative Serum-CEA-Spiegel ein unabhängiger prognostischer Biomarker für Dickdarmkrebs war und die Prognose bei Patienten mit hohem CEA und einem niedrigeren Stadium schlechter war als bei Patienten mit niedrigem CEA und einem höheren Stadium. In dieser Studie wurde ein hoher CEA sogar als so stark wie die Knotenpositivität für die Vorhersage schlechter onkologischer Ergebnisse von Darmkrebs angesehen.
Dennoch konzentrieren sich nur wenige Studien auf die Aufklärung der prognostischen Rolle des Serum-CEA-Spiegels bei Rektumkarzinomen. Im Jahr 2016 nutzten Tarantino et al. (9, 27) führten die beiden großen populationsbasierten Untersuchungen durch, die überzeugende Beweise dafür lieferten, dass ein erhöhter CEA-Spiegel im präoperativen Serum ein starker Prädiktor für ein schlechteres Gesamt- und krebsspezifisches Überleben bei Rektumkarzinomen war. Im Jahr 2018 haben Liu et al. (8) zeigten, dass der präoperative Serum–CEA ein unabhängiger prognostischer Faktor für Rektumkarzinom war und ein erhöhter Serum-CEA-Spiegel im Vergleich zum normalen Serum-CEA-Spiegel in den Stadien I-IV offensichtlich ein schlechteres Überleben darstellte. Die einzigen beiden früheren Studien, die sich auf die Untersuchung der prognostischen Rolle des präoperativen Serum-CEA-Spiegels konzentrierten, untersuchten jedoch nicht die Assoziation von CEA-Spiegel und T-Stadium bei der Vorhersage der Tumorergebnisse von Rektumkarzinom.
Obwohl die Studie zeigt, dass Krebs das metastatische Potenzial Schritt für Schritt erwirbt, wenn er groß wird (28), deuteten einige frühere Studien jedoch darauf hin, dass der Erwerb des metastatischen Potenzials sehr früh in der Tumorprogression auftreten könnte. Eine frühere Forschung zeigte das extrem schlechte Überleben sehr kleiner Tumorgröße, wenn sie an der Lymphknotenpositivität beteiligt ist (17). Darüber hinaus zeigen die Ergebnisse unserer Forschung, dass die Erhöhung des präoperativen Serum-CEA-Spiegels im sehr frühen Stadium (Stadium T1) Rektumkarzinom ist mit sehr schlechtem OS und CSS verbunden und kann ein Ersatz für aggressive Biologie sein. Wir glauben, dass sowohl Lymphknotenbeteiligung als auch Serum-CEA-Erhöhung gelten als Erwerb der metastatischen Fähigkeit. Unsere Studie, kombiniert mit der von Wo et al. unterstützen Sie konsequent die oben genannte Idee, dass der Erwerb von metastasierendem Potenzial sehr früh in der Tumorprogression auftreten könnte, was mit schlechten onkologischen Ergebnissen verbunden ist, und das anfängliche biologische Merkmal bestimmt eher das Potenzial der Fernmetastasierung während des Fortschreitens des Krebses als die akkumulierte Metastasierungsfähigkeit (29).
Darüber hinaus sind die Ergebnisse unserer Studie von klinischer Bedeutung. Gegenwärtig wird Rektumkarzinom im Stadium I allein aufgrund relativ günstiger onkologischer Ergebnisse mit radikaler chirurgischer Resektion behandelt. Ungefähr 10-15% der Patienten entwickeln jedoch nach radikaler Resektion ein Tumorrezidiv (30, 31). In der vorliegenden Studie identifizieren wir zufällig eine Untergruppe von Rektumkarzinomen im Stadium T1 mit sehr schlechter Prognose im Vergleich zum Rest des Rektumkarzinoms im Stadium I, was bedeutet, dass diese Stadium T1 Rektumkarzinom mit Beteiligung der präoperativen Serum-CEA-Erhöhung sollte mehr Aufmerksamkeit auf sich ziehen von Onkologen.
Es gibt jedoch zwei Einschränkungen in unserer Studie. Einerseits wurden in dieser Studie einige bekannte prognostische Faktoren für Rektumkarzinom nicht in unsere Analysen einbezogen, einschließlich Mikrosatelliteninstabilitätsstatus und postoperative Komplikationen, die in der SEER-Datenbank nicht verfügbar waren und zu einem gewissen Grad Verzerrungen hervorrufen könnten. Wir können keine Bereiche und Mittelwerte von CEA in beiden Gruppen angeben. Auf der anderen Seite basierte die vorliegende Studie eher retrospektiv als auf prospektiven Daten. Daher müssen unsere Ergebnisse noch in anderen Kohorten validiert werden, insbesondere in großen prospektiven klinischen Studien.
Zusammenfassend zeigt unsere Studie, dass Rektumkarzinom im Stadium T1, wenn es an einer präoperativen Serum-CEA-Erhöhung beteiligt ist, ein Surrogat einer biologisch aggressiven Erkrankung sein kann und mit ungünstigem OS und CSS korreliert. Darüber hinaus verdient diese Untergruppe von Rektumkarzinomen mehr klinische Aufmerksamkeit von Onkologen. Unsere Ergebnisse, wenn sie in zukünftigen Datenbankstudien validiert werden, würden eine neue Therapieidee für Rektumkarzinome im Frühstadium liefern.
Data Availability Statement
Die für diese Studie generierten Datensätze stehen dem korrespondierenden Autor auf Anfrage zur Verfügung.
Ethikerklärung
Die Patienten in dieser Studie wurden aus der SEER-Datenbank identifiziert, und die Genehmigung zur Verwendung der Daten wurde durch eine Anfrage an das SEER-Programm eingeholt. Die Genehmigung durch das Institutional Review Board war nicht erforderlich, da die SEER-Datenbank öffentlich verfügbar ist.
Autorenbeiträge
SW und WG haben einen wesentlichen und direkten Beitrag zu dieser Studie geleistet und sie zur Einreichung freigegeben.
Interessenkonflikt
Die Autoren erklären, dass die Forschung in Abwesenheit von kommerziellen oder finanziellen Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Danksagungen
Diese Arbeit wurde teilweise durch das Medical Science and Technology Development Plan Project von Yancheng (YK2015075) unterstützt.
1. Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Globale Krebsstatistik 2018: GLOBOCAN schätzt die Inzidenz und Mortalität weltweit für 36 Krebsarten in 185 Ländern. CA Krebs J Clin. (2018) 68:394–424. ursprungsbezeichnung: 10.3322/caac.21492
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
2. Gold P, Freedman SO. Nachweis tumorspezifischer Antigene in humanen Kolonkarzinomen durch immunologische Toleranz- und Absorptionstechniken. In: J Exp Med. (1965) 121:439–62. doi: 10.1084/jem.121.3.439
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
3. Goldstein MJ, Mitchell EP. Karzinoembryonales Antigen im Staging und Follow-up von Patienten mit Darmkrebs. Krebs investieren. (2005) 23:338–51. doi: 10.1081/CNV-58878
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
4. Becerra AZ, Probst CP, Tejani MA, Aquina CT, González MG, Hensley BJ, et al. Bewertung der prognostischen Rolle erhöhter präoperativer karzinoembryonaler Antigenspiegel bei Dickdarmkrebspatienten: Ergebnisse aus der national Cancer Database. Ann Surg Oncol. (2016) 23:1554–61. artikelnummer: 10.1245/s10434-015-5014-1
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
5. Ogata Y, Murakami H, Sasatomi T, Ishibashi N, Mori S, Ushijima M, et al. Ein erhöhter präoperativer serumkarzinoembrionaler Antigenspiegel kann ein wirksamer Indikator für die Notwendigkeit einer adjuvanten Chemotherapie nach potenziell kurativer Resektion von Darmkrebs im Stadium II sein. J Surg Oncol. (2010) 99:65–70. doi: 10.1002/jso.21161
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
6. Es sind keine frei zugänglichen ergänzenden Materialien verfügbar in: Gonen M, Shia J, Schrag D, Landmann RG, et al. Identifizierung von Patienten mit Hochrisiko-Darmkrebs im Stadium II zur adjuvanten Therapie. Dis Colon Rektum. (2008) 51:503–7. doi: 10.1007/s10350-008-9246- z
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
7. Spindler BA, Bergquist JR, Thiels CA, Habermann EB, Kelley SR, Larson DW, et al. Der Einbau von CEA verbessert die Risikostratifizierung bei Darmkrebs im Stadium II. J Gastrointest Surg. (2017) 21:770-7. ust-idnr.: 10.1007/s11605-017-3391-4
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
8. Liu Q., Lian P., Luo D., Cai S., Li Q., Li X. Kombination von karzinoembryonalem Antigen mit dem American Joint Committee on Cancer TNM Staging System bei Rektumkarzinomen: eine reale und große populationsbasierte Studie. Onco zielt auf Ther. (2018) 11:5827–34. doi: 10.2147/OTT.S171433
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
9. Cerny T, Güller U, Warschkow R, Schmied BM, Tarantino I, Mieth M, et al. Prädiktiver Wert von CEA für das Überleben im Stadium I Rektumkarzinom: eine populationsbasierte Propensity Score-Matched-Analyse. J Gastrointest Surg. (2016) 20:1213-22. doi: 10.1007/s11605-016-3137-8
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Beauchemin N, Arabzadeh A. Carcinoembryonic antigen-related cell adhesion molecules (CEACAMs) in cancer progression and metastasis. Cancer Metastasis Rev. (2013) 32:643–71. doi: 10.1007/s10555-013-9444-6
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Arabzadeh A, Chan C, Nouvion AL, Breton V, Benlolo S, DeMarte L, et al. Host-related carcinoembryonic antigen cell adhesion molecule 1 promotes metastasis of colorectal cancer. Onkogen. (2013) 32:849–60. Ursprungsbezeichnung: 10.1038/onc.2012.112
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
12. Cai Z, Xiao J, Er X, Ke J, Zou Y, Chen Y, et al. Eine neue prognostische Bedeutung des präoperativen karzinoembryonalen Antigens bei Darmkrebs nach Tumorresektion: mehr als positiv und negativ. In: Cancer Biomark. (2017) 19:161–8. doi: 10.3233/CBM-160287
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
13. Engel J, Eckel R, Kerr J, Schmidt M, Fürstenberger G, Richter R, et al. Der Prozess der Metastasierung bei Brustkrebs. Eur J Krebs. (2003) 39:1794–806. ust-IDNR.: 10.1016/S0959-8049(03)00422-2
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
14. Hüsemann Y, Geigl JB, Schubert F, Musiani P, Meyer M, Burghart E, et al. Die systemische Ausbreitung ist ein früher Schritt bei Brustkrebs. Krebszelle. (2008) 13:58–68. ursprungsbezeichnung: 10.1016/j.ccr.2007.12.003
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
15. Es sind keine frei zugänglichen ergänzenden Materialien verfügbar Zitationen Podsypanina K, Du YC, Beverly LJ, Hambardzumyan D. Seeding und Vermehrung von untransformierten Maus-Brustzellen in der Lunge. Wissenschaft. (2008) 321:1841–4. doi: 10.1126/Wissenschaft.1161621
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
16. Schmidt-Kittler O, Ragg T, Daskalakis A, Granzow M, Ahr A, Blankenstein TJ, et al. Von latent disseminierten Zellen zur offenen Metastasierung: genetische Analyse der systemischen Brustkrebsprogression. In: Proc Natl Acad Sci USA. (2003) 100:7737–42. doi: 10.1073/pnas.1331931100
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
17. Wo JY, Chen K, Neville BA, Lin NU, Punglia RS. Auswirkung einer sehr kleinen Tumorgröße auf die krebsspezifische Mortalität bei knotenpositivem Brustkrebs. In: J Clin Oncol. (2012) 23:32–3. doi: 10.1016/j.breastdis.2012.01.026
CrossRef Volltext / Google Scholar
18. Compton C, Fenoglio-Preiser CM, Pettigrew N, Fielding LP. American Joint Committee on Cancer prognostic factors Konsensuskonferenz: kolorektale Arbeitsgruppe. Krebs. (2015) 88:1739–57. doi: 10.1002/(SICI)1097-0142(20000401)88:7<1739:: BEIHILFE-CNCR30>3.0.CO;2-T
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
19. Duffy MJ, van Dalen A, Haglund C, Hansson L, Holinski-Feder E, Klapdor R, et al. Tumormarker bei Darmkrebs: Leitlinien der Europäischen Gruppe für Tumormarker (EGTM) für die klinische Anwendung. Eur J Krebs. (2007) 43:1348–60. doi: 10.1016/j.ejca.2007.03.021
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
20. Es sind keine frei zugänglichen ergänzenden Informationen verfügbar in: Locker GY, Hamilton S, Harris J, Jessup JM, Kemeny N, Macdonald JS, et al. ASCO 2006 Aktualisierung der Empfehlungen für die Verwendung von Tumormarkern bei Magen-Darm-Krebs. In: J Clin Oncol. (2006) 24:5313–27. doi: 10.1200/JCO.2006.08.2644
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
21. Duffy MJ, Haglund C, Kalousová M, Holubec L, Kalousová M, et al. Tumormarker bei Darmkrebs, Magenkrebs und gastrointestinalem Stroma-Krebs: European group on tumor markers 2014 guidelines Update. Int J Krebs. (2014) 134:2513–22. doi: 10.1002/ijc.28384
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
22. Harrison LE, Guillem JG, Paty P, Cohen AM. Präoperatives karzinoembryonales Antigen sagt Ergebnisse bei knotennegativen Dickdarmkrebspatienten voraus: eine multivariate Analyse von 572 Patienten. J Am Coll Surg. (1997) 185:55-9. modell: 10.1016/S1072-7515(97)00012-4
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
23. Huh JW, Oh BR, Kim HR, Kim YJ. Präoperativer karzinoembryonaler Antigenspiegel als unabhängiger prognostischer Faktor bei potenziell kurativem Dickdarmkrebs. J Surg Oncol. (2010) 101:396–400. doi: 10.1002/jso.21495
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
24. Es sind keine frei zugänglichen ergänzenden Materialien verfügbar Zitation Ozawa H, Kotake K, Hirata A, Fujita S, et al. Einbau von serumkarzinoembryonalen Antigenspiegeln in das prognostische Gruppierungssystem von Dickdarmkrebs. Int J Colorect Dis. (2017) 32:1–9. ust-idnr.: 10.1007/s00384-017-2772-1
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
25. Thirunavukarasu P, Sukumar S, Sathaiah M, Mahan M, Pragatheeshwar KD, Pingpank JF, et al. C-Stadium bei Dickdarmkrebs: Auswirkungen des carcinoembryonalen Antigen-Biomarkers auf Stadium, Prognose und Management. J Natl Krebs Inst. (2011) 103:689–97. doi: 10.1093/ jnci/djr078
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
26. Margalit O, Mamtani R, Yang YX, Reiss KA, Golan T, Halpern N, et al. Beurteilung des prognostischen Wertes der karzinoembryonalen Antigenspiegel bei Darmkrebs im Stadium I und II. Eur J Krebs. (2018) 94:1–5. doi: 10.1016/j.ejca.2018.01.112
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
27. Koberle D, Schmied BM, Warschkow R, Merati-Kashani K, et al. Ein erhöhter präoperativer CEA ist mit einem schlechteren Überleben bei Patienten mit Rektumkarzinom im Stadium I-III verbunden. Br J Krebs. (2012) 107:266. Ursprungsbezeichnung: 10.1038/bjc.2012.267
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
28. Norton L, Massague J. Ist Krebs eine Krankheit der Selbstsaat? Nat Med. (2006) 12:875–8. doi: 10.1038/nm0806-875
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
29. Wu J, Shen ZZ, Yu KD, Jiang YZ, Chen S, Cao ZG, et al. Wirkung der großen Tumorgröße auf die krebsspezifische Mortalität bei knotennegativem Brustkrebs. In: Mayo Clin Proc. (2012) 87:1171–80. Ursprungsbezeichnung: 10.1016/j.mayocp.2012.07.023
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
30. Blumberg D, Paty PB, Picon AI, Guillem JG, Klimstra DS, Minsky BD, et al. Stadium I Rektumkarzinom: Identifizierung von Hochrisikopatienten. J Am Coll Surg. (1998) 186:574-9; diskussion:579-80. modell: 10.1016/S1072-7515(98)00018-0
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
31. Gunderson LL, Sargent DJ, Tepper JE, Wolmark N, O’Connell MJ, Begovic M, et al. Auswirkungen des T- und N-Stadiums und der Behandlung auf das Überleben und den Rückfall bei adjuvantem Rektumkarzinom: eine gepoolte Analyse. In: J Clin Oncol. (2004) 22:1785-96. doi: 10.1200/JCO.2004.08.173
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar