Grenzen in der Neurologie
- Einleitung
- Methoden
- Probanden
- Nervenleitungsstudien
- Ultraschall
- Statistik
- Ergebnisse
- Klinische Merkmale
- Querschnittsfläche (CSA)
- Korrelation von maxCSA und dem Medical Research Council Sum Score (MRC)
- Korrelation von CSA und CB
- Erklärung zur Datenverfügbarkeit
- Ethikerklärung
- Autorenbeiträge
- Interessenkonflikt
- Danksagung
- Ergänzungsmaterial
- Abkürzungen
Einleitung
Die multifokale motorische Neuropathie (MMN) wurde erstmals 1988 (1) als rein motorische Neuropathie beschrieben, die mehrere motorische Nerven mit Leitungsblock (CB) betrifft. Motor CB ist das elektrophysiologische Kernmerkmal für die Diagnose von MMN. Nervenultraschall kann die morphologischen Merkmale peripherer Nerven liefern. Die multifokale Vergrößerung peripherer Nerven oder zervikaler Wurzeln in Nervenquerschnittsbereichen (CSAs) wurde in MMN berichtet (2-4). Kerasnoudis et al. (5) berichteten über eine Korrelation zwischen zusammengesetzten motorischen Aktionspotentialen (CMaps) und CSAs des Nervus medianus im Oberarm (r = 0,851, p < 0,001). In: Beekman et al. (6) fanden heraus, dass Sonographiestudien eine erhöhte Nerven-CSA zeigten, die aus rein klinischen Gründen mehr als erwartet mit Leitungsstörungen vereinbar war. Darüber hinaus zeigten einige Stellen eine Nervenvergrößerung ohne CB. Multifokale CBs wurden entlang des Nervs in MMN verteilt; diese Studien maßen jedoch nur wenige vorbestimmte Stellen und lieferten begrenzte morphologische Informationen. In dieser Studie ermöglichte die Verwendung von aufeinanderfolgendem Scannen entlang des Nervs und Messen von CSA an mehreren Stellen basierend auf Ultraschall eine genauere Korrelation zwischen Leitungsblock und erhöhter CSA in MMN.
Methoden
Probanden
Zwischen Dezember 2014 und Mai 2018 wurden nacheinander 12 MMN-Patienten aus dem Peking Union Medical College Hospital rekrutiert Kriterien vorgeschlagen von der AANEM (7). Eine gleiche Anzahl von gesunden Kontrollen (HC), abgestimmt nach Alter (± 1 Jahre), wurden als Kontrollen eingeschrieben. Alle Patienten und gesunden Kontrollen wurden einer standardisierten klinischen Untersuchung unterzogen, einschließlich Muskelkrafttests des Handgelenks, Daumen- und Fingerflexion, Opponens pollicis, Abductor pollicis brevis, Fingerspreizung, und Adduktor pollicis, zusammen mit sensorischen Tests. Klinische Untersuchungen, Elektromyogramm- und Nervenultraschalluntersuchungen wurden am selben Tag durchgeführt. Die Ethikkommission des Peking Union Medical College Hospital genehmigte unser Studienprotokoll, und alle Patienten unterzeichneten eine Einverständniserklärung gemäß der Erklärung von Helsinki.
Nervenleitungsstudien
Motorische Nervenleitungsstudien (NCSs) wurden an allen Probanden an den bilateralen medianen und ulnaren Nerven mit perkutaner supramaximaler Nervenstimulation durchgeführt, während CMaps mit 10-mm-Scheibenelektroden aufgezeichnet wurden. Standardsegmente wurden definiert als Handgelenk bis Ellbogen und Ellenbogen bis Achselhöhle für den Nervus medianus und als Handgelenk bis unter den Ellbogen und oberer Ellbogen bis Achselhöhle für den Nervus Ulnaris. Eine Inching-Technik (Stimulierung entlang des Nervenverlaufs in 2-cm-Schritten) wurde über einige Standardsegmente mit einem teilweisen Leitungsblock durchgeführt, wobei die genaue Stelle von CB zusammen mit einem aufeinanderfolgenden Ultraschalltest über dasselbe Segment erfasst wurde. Die CB-Diagnose von Standardsegmenten und die Inching-Technik wurden gemäß den vom AANEM vorgeschlagenen Kriterien durchgeführt (7). Um nur einen echten Leitungsblock einzuschließen, musste die distale CMAP 1 mV betragen. Die Raumtemperatur wurde beibehalten, um sicherzustellen, dass die Hauttemperatur bei > 31 ° C blieb.
Ultraschall
Ultraschalluntersuchungen wurden mittels Nervenverfolgung vom Handgelenk bis zur Achselhöhle an den bilateralen Median- und Ulnarnerven mit einem 10 MHz Linear Array Transducer (GE LOGIQ e, USA) durchgeführt. Um eine künstliche Vergrößerung der Nervengröße auszuschließen, war die Verwendung einer Zoomvergrößerung für diese Messungen nicht zulässig. Die Ausgangseinstellungen wurden bei allen Untersuchungen einschließlich der Tiefen konstant gehalten. Der Wandler wurde senkrecht zum Nerv in einem Winkel gehalten, der ausgewählt wurde, um das kleinste und hellste Bild zu erhalten. Die CSAs an den vorbestimmten Stellen an jedem Nerv wurden durch Verfolgen direkt innerhalb des echoreichen Randes des Nervs gemessen. Nach einem früheren Bericht unseres Labors wurden an jedem Nerv zehn vorbestimmte Stellen gemessen (8). Für den N. medianus umfassten die 10 Stellen den Auslass des Karpaltunnels (M1), den Mittelpunkt der Handgelenksfalte (M2), den Einlass des Karpaltunnels (M3), 4 cm proximal zur Handgelenksfalte (M4), die Mitte zwischen Handgelenksfalte und Ellbogen (M5), den Eingang in den Pronator Teres (M6), den Ellbogen (M7), 4 cm über dem Ellbogen (M8), 8 cm über dem Ellbogen (M9) und die Achselhöhle (M10). Für den N. ulnaris umfassten die 10 Stellen das Handgelenk (U1), 4 cm proximal zum Handgelenk (U2), den Abgangspunkt von der Arteria ulnaris ulnaris (U3), neben dem Muskelbauch des Flexor carpi ulnaris (U4), den Auslass des Kubitaltunnels (U5), innerhalb des Kubitaltunnels (U6), den Einlass des Kubitaltunnels (U7), 4 cm proximal zum Einlass des Kubitaltunnels (U8), 8 cm proximal zum Einlass des Kubitaltunnels (U U9) und die Achselhöhle (U10). Mit Ausnahme der oben genannten Standorte wurden auch an allen anderen Erweiterungsorten Messungen durchgeführt. Die CSA-Vergrößerung wurde auf die normativen Werte in unserem Labor bezogen (im Nervus medianus waren die Unterarm-Ellbogen-Segmente ≤ 10 mm2 und die Ellbogen-Achsel-Segmente ≤ 9 mm2; Im Nervus ulnaris waren sowohl Unterarm- als auch Armsegmente ≤ 6 mm2). Nach der CSA-Messung wurde der Nerv erneut kontinuierlich verfolgt und gründlich aufgezeichnet. Häufige kompressive Neuropathien, die zu einer Nervenvergrößerung führten, wurden von der Studie ausgeschlossen. Sonographen wurden für Patienteninformationen geblendet.
Statistik
Die CSAs von MMN zeigten eine nicht normale Verteilung. Der Mann-Whitney-U-Test wurde verwendet, um MMN und gesunde Kontrollen und den Unterschied in der maximalen CSAs zwischen Segmenten mit CB und solchen ohne CB zu vergleichen. Der maximale CSA wurde als der maximale CSA im Standardsegment definiert. Für alle Tests wurde ein zweiseitiger P-Wert von < 0,05 als statistisch signifikant angesehen.
Ergebnisse
Klinische Merkmale
Acht Männer und 4 Frauen mit einem Durchschnittsalter von 43,7 Jahren (Bereich 21-62, SD 13,2), 12 gesunde Kontrollen (Durchschnittsalter 43,6, Bereich 28-57, SD 13,3, 8 Männer) wurden in diese Studie eingeschlossen. Die durchschnittliche Krankheitsdauer betrug 65.3 (24-108) Monate. Die mittlere Körpergröße betrug 168 (155-186) cm und das mittlere Gewicht 65,4 (56,5–88) kg. Alle Patienten waren behandlungsnaiv.
Querschnittsfläche (CSA)
Die CSA-Werte für den Median- und Ulnarnerv in MMN und HC an den 10 Stellen sind in Tabelle 1 und Abbildung 1 dargestellt. Die CSA-Vergrößerungen waren im Vergleich zu gesunden Kontrollen multifokal. Bei Mediannerven waren höhere CSA-Werte hauptsächlich im Unterarmsegment und im Oberarmsegment verteilt. Die Stellen unterhalb des Ellenbogens und das Oberarmsegment der Ulnarnerven zeigten eine offensichtlichere CSA-Vergrößerung. Interessanterweise zeigten häufige Stellen der Nervenkompression, wie der Karpalkanal und der Kubitaltunnel, keinen vorherrschenden CSA-Anstieg bei MMN-Patienten im Vergleich zu gesunden Kontrollen.

Tabelle 1. CSA an verschiedenen Stellen der medianen und ulnaren Nerven in MMN und HC.

Abbildung 1. Die Verteilung von 10 CSA-Stellen in den medianen und ulnaren Nerven. Die Linie von 10 mm2 wurde eingerichtet, um signifikante Anomalien der CSA-Stellen von den anderen Segmenten zu unterscheiden. (A) Für den Nervus medianus: M1-der Auslass der Karpellkanüle, M2-der Mittelpunkt der Handgelenksfalte, M3-der Einlass der Karpellkanüle, M4-4 cm proximal zur Handgelenksfalte, M5-der Mittelpunkt zwischen Handgelenksfalte und Ellbogen, M6-der Eingang in den Pronator Teres, M7-der Ellbogen, M8-4 cm über dem Ellbogen, M9-8 cm über dem Ellbogen, M10-die Achselhöhle. (B) Für den N. ulnaris: U1-das Handgelenk, U2-4 cm über dem Handgelenk, U3-Abgangspunkt von der Ulnararterie, U4-neben dem Muskelbauch des Flexor carpi ulnaris, U5- der Auslass des Kubitaltunnels, U6- innerhalb des Kubitaltunnels, U7-der Einlass des Kubitaltunnels, U8-4 cm proximal zum Einlass des Kubitaltunnels, U9-8 cm proximal zum Einlass des Kubitaltunnels, U10-Achselhöhle. CSA, Querschnittsfläche; MMN, multifokale motorische Neuropathie.
Korrelation von maxCSA und dem Medical Research Council Sum Score (MRC)
Bei den 12 MMN-Patienten wurden insgesamt 23 Mediannerven und 23 Ulnarnerven eingeschlossen, da einer der MMN-Patienten amputiert wurde wegen Arbeitsunfalls. Der Trend zwischen dem maximalen Nerven-CSA eines Nervs und der entsprechenden Muskelkraft wird in die folgenden zwei Typen unterteilt (Abbildung 2): (1) CSA erhöht und MRC verringert. (2) CSA erhöht und MRC zeigte keine offensichtliche Veränderung.
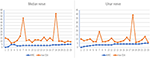
Abbildung 2. Die Korrelation zwischen Nerven maxCSA und MRC. Der Trend zwischen der maximalen Nervenquerschnittsfläche (CSA) eines Nervs und der entsprechenden Muskelkraft. Die Abszisse zeigt 23 bilaterale Nerven bei 12 Patienten an, von denen einer den Lateralnerv aufgrund einer Amputation nicht erfassen konnte; Die Ordinate stellt die Nervenquerschnittsfläche (mm2) oder die Muskelkraftbewertung dar. MRC, Medical Research Council Sum Score; maxCSA, maximale Querschnittsfläche eines bestimmten Nervs.
Korrelation von CSA und CB
Mit motorischem NCSs wurden 12 definitive CB- und 12 wahrscheinliche CB-Bereiche über Standardsegmente von medianen und ulnaren Nerven nachgewiesen. Mit Ultraschalluntersuchungen wurde an 36 Stellen eine erhöhte CSA festgestellt, wobei Segmente entfernt wurden, die anfällig für Infektionen waren. Im N. medianus betrug der Median (P25, P75) der maximalen CSA eines Standardsegments 10, 3 (8-12) mm2 für Personen ohne CB und 21, 22 (8, 5,38) mm2 für Personen mit CB (Z = 1, 409, P = 0, 159). Im N. ulnaris betrug der Median (P25, P75) der maximalen CSA eines Standardnervensegments 7,7 (5.8,7) mm2 für Personen ohne CB und 6,25 (5,8,25) mm2 für Personen mit CB (Z = 0,744, P = 0,457).
Es gab 9 Standardsegmente mit CB und erhöhtem CSA (Abbildung 3, Video 1), 15 Segmente mit CB, aber normalem CSA (Abbildung 4, Video 2) und 27 Segmente mit erhöhtem CSA, aber ohne CB (Abbildung 5, Video 3). Die Inching-Technik und das aufeinanderfolgende Scannen mit Ultraschall wurden über fünf Segmente durchgeführt, von denen Leitungsblöcke durch Standardsegmentdetektion mit einem Teilleitungsblock kaum bestätigt wurden. Durch die Kombination von Inching-Techniken und Ultraschall zeigten zwei weitere Segmente CBs und erhöhte CSA an denselben Stellen, und 3 Segmente zeigten CBs, aber normale CSA an denselben Stellen.
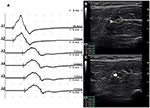
Abbildung 3. Modus 1. Ein 28-jähriger Mann mit 4 Jahren progressiver asymmetrischer Schwäche der bilateralen Hände. Untersuchung ergab Ulnarnerv innervierte Muskeln der Hand (MRC Grad rechts 3, links 4). Eine Inching-Technik, die über das linke Unterarmsegment des N. ulnaris angewendet wurde, zeigte bei einem Patienten mit MMN eine Leitungsblockade und eine CSA-Vergrößerung an derselben Stelle. (A) Ein Leitungsblock wurde zwischen A1 (Latenz 4,9 ms, Dauer 8,2 ms, Amplitude 14,8 mv, Bereich 38,2 mvms, Leitungsgeschwindigkeit 66,6 m / s) und A2 (Latenz 5,2 ms, Dauer 8,2 ms, Amplitude 9,5 mv, Bereich 26,1 mvms, Leitungsgeschwindigkeit 11,6 m / s) festgestellt. (B) Die weiße Pfeilspitze zeigte, dass der CSA von A1 8 mm2 betrug. (C) Der Pfeil zeigt, dass der CSA von A2 19 mm2 betrug (A1, Ellenbogen-6 cm; A2, Ellenbogen-4 cm; A3, Ellenbogen-2 cm) (Video 1). CSA, Querschnittsfläche; CB, Leitungsblock; l, links; r, rechts.
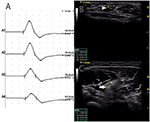
Abbildung 4. Modus 2. Eine 46-jährige Frau mit 11 Jahren progressiver asymmetrischer Schwäche der bilateralen oberen Extremitäten mit MRC Grad 3 der rechten oberen Extremität und Grad 4 der linken Extremität zeigte an derselben Stelle eine Leitungsblockade und eine normale CSA. (A) Leitungsblockaden wurden zwischen A1 und A2 festgestellt. (B) Die weiße Pfeilspitze zeigte 6 mm2 bei A1 (Latenz 2,8 ms, Dauer 3,8 ms, Amplitude 12,4 mv, Fläche 13,3 mvms, Leitungsgeschwindigkeit 50,9 m/s) und (C) Der Pfeil zeigte 8 mm2 bei A2 (Latenz 6,8 ms, Dauer 3,9 ms, Amplitude 8,2 mv, Fläche 7,7 mvms, Leitungsgeschwindigkeit 63 m/s) (A1, Handgelenk; A2, Ellbogen) (Video 2). CSA, Querschnittsfläche; CB, leitung block; l, links; r, rechts.
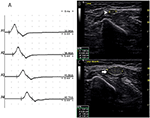
Abbildung 5. Modus 3. Eine 51-jährige Frau mit 4 Jahren Schwäche der linken oberen Extremität und MRC Grad 4 zeigte eine CSA-Vergrößerung ohne entsprechende Leitungsblockade. (A) Standardsegment motorische Nervenleitungsstudie des linken N. ulnaris. Es wurde kein CB festgestellt. Nervenultraschalluntersuchung über den linken Oberarm des N. ulnaris zeigen: (B) CSA (weiße Pfeilspitze), die an der Stelle von A3 8 mm2 betrug (Latenz 8,7 ms, Dauer 8,0 ms, Amplitude 8,2 mv, Fläche 19,2 mvms, Leitungsgeschwindigkeit 48.6 m / s) und (C) CSA (Pfeil) der Stelle 6 cm proximal des Ellenbogens des linken Ulnars, die 39 mm2 betrug (Latenz 12,0 ms, Dauer 7,9 ms, Amplitude 8,4 mv, Fläche 19,5 mvms, Leitungsgeschwindigkeit 18,2 m / s), aber kein CB wurde im selben Segment nachgewiesen (A1, Handgelenk; A2, unterhalb des Ellenbogens; A3, oberhalb des Ellenbogens; A4, Achselhöhle) (Video 3). CSA, Querschnittsfläche; CB, Leitungsblock; l, links; r, rechts.
Elektrophysiologische Studien spiegeln die physiologischen Merkmale eines Nervs wider, und Ultraschalluntersuchungen zeigen die morphologischen Merkmale eines Nervs. MMN ist eines der idealen Modelle, um die Korrelation zwischen motorischer CB und CSA zu untersuchen, bei der nur der motorische Nerv beteiligt ist, und CB ist das elektrophysiologische Hauptmerkmal. Obwohl frühere Studien eine Korrelation zwischen CB und CSA berichtet haben (5, 6, 9), wurden begrenzte Stellen ohne kontinuierliche Nervenabtastung unter Ultraschall beobachtet, und die Läsionen in MMN waren stochastisch und nicht immer an vorbestimmten Stellen verteilt.
In dieser Studie führten wir aufeinanderfolgende Scans entlang des gesamten Nervs durch, um die CSA an abnormalen Stellen aufzuzeichnen. Zusätzlich wurden CSAs an 10 vorgegebenen Stellen gemessen. Die Inch-Technik wurde bei Bedarf durchgeführt. Obwohl die Krankheitsdauer in dieser Gruppe von Patienten mit MMN lang und unterschiedlich war, was möglicherweise die Ultraschall- und elektrophysiologischen Eigenschaften beeinflusst hat, fanden wir immer noch drei Arten von Beziehungen zwischen CSA und CB: CB mit entsprechender Nerven-CSA-Vergrößerung (Modus 1), CB ohne entsprechende Nerven-CSA-Vergrößerung (Modus 2) und Nerven-CSA-Vergrößerung ohne entsprechende CB (Modus 3). Folglich korreliert CB nicht immer mit einer erhöhten CSA.
Der mögliche Mechanismus dieser unterschiedlichen Korrelationsmuster zwischen CB und CSA ist noch unklar. Darüber hinaus wurden die wahren entsprechenden pathologischen Manifestationen hinter der Nervenvergrößerung nicht eindeutig aufgedeckt. Eine echoarme Vergrößerung des Nervs kann eine aktive Entzündung und Zwiebelknollen widerspiegeln, während eine Nervenvergrößerung mit zusätzlichen echoreichen Faszikeln / perifaszikulärem Gewebe eine axonale Degeneration widerspiegeln kann (10). Das heißt, sowohl axonale als auch Myelinscheidenläsionen könnten zu einer Vergrößerung der Nerven-CSA führen (11). In Bezug auf Modus 2 kann CB ohne entsprechende CSA-Erweiterung leicht verstanden werden. Gegenwärtig wird MMN als immunvermittelte motorische Neuropathie angesehen, die mit einer Schädigung von Anti-GM1-Antikörpern an spannungsgesteuerten Na + -Kanälen am Ranvier-Knoten zusammenhängt (12, 13). Theoretisch lösen Anti-GM1-Antikörper eine direkte und komplementabhängige Schädigung der Axone aus, was zu einer Leitungsblockade führt, während möglicherweise keine offensichtlichen Myelinveränderungen vorliegen. In: Taylor et al. hypothese aufgestellt, dass der Antikörperangriff auf die Komponenten des paranodalen Myelins gerichtet sein könnte, und festgestellt, dass die axonale pathologische Veränderung von MMN gegenüber der Myelinpathologie vorherrschte (14). Darüber hinaus könnten unsere Befunde in Bezug auf normale CSA und CB bei MMN eine Folge der Tatsache sein, dass nur einzelne Faszikel vergrößert sind, während der Hauptnerv CSA unberührt bleibt (15).
In Bezug auf Modus 1 (CB mit erhöhter CSA) wurde in Magnetresonanztomographie (MRT) (16) und anderen Ultraschallstudien (3) über eine erhöhte CSA bei MMN berichtet. Unser Befund, dass Patienten mit MMN an derselben Stelle entlang des Nervs eine multifokale Nerven-CSA-Vergrößerung und einen Leitungsblock aufwiesen, könnte darauf hindeuten, dass an der Stelle der CB nicht nur beschädigte spannungsgesteuerte Na + -Kanäle vorhanden waren, sondern auch einige Läsionen wie Demyelinisierung, Ödeme und Zwiebelknollenbildung (6, 17). Dieser Modus zeigte an, dass CB durch verschiedene Mechanismen verursacht werden kann und MMN ein Syndrom sein kann. Nicht alle Fälle von MMN werden durch Anti-GM1-IgM-Antikörper verursacht, und es können auch andere Immunisierungsprozesse beteiligt sein, die zu Demyelinisierungs- / Remyelinisierungs- und axonalen Degenerations- / Regenerationsprozessen führen.
Der Mechanismus für Modus 3 muss weiter erforscht werden. Nerven-CSA-Vergrößerung ohne CB in MMN oder sogar Gliedmaßen ohne neurophysiologische Dysfunktion wurde auch in anderen Berichten gefunden (6, 9, 18). Wir stellten die Hypothese auf, dass, wenn entzündliche Infiltrate, Ödeme und Kanalfunktionsstörungen an den Ranvier-Knoten im Frühstadium auftreten, die Depolarisationsschwelle der Ionenkanäle in einem normalen Bereich bleiben kann, so dass die Funktionsstörung der kompensatorischen Reizübertragung noch nicht erreicht ist und kein CB nachgewiesen werden kann. Wenn bei Patienten mit MMN eine erhöhte CSA ohne CB nachgewiesen wird, sollten die morphologischen Veränderungen des Nervs auch klinische Bedeutung haben. Aufeinanderfolgende Scans entlang des Nervs und Messungen an einer größeren Anzahl von Stellen zur Erkennung morphologischer Veränderungen könnten die diagnostische Sensitivität für MMN erhöhen.
Zusammenfassend gab es drei Korrelationsmuster zwischen CB und CSA, und die elektrophysiologischen und morphologischen Veränderungen waren bei MMN nicht immer konsistent. Ultraschalluntersuchungen könnten mehr Läsionen entlang des Nervs in MMN erkennen, auch ohne CB. Die Kombination von motorischen NCS- und Ultraschalluntersuchungen könnte mehr Informationen für die klinische Diagnose von MMN liefern.
Dies war eine Querschnittsstudie zum Vergleich einzelner Parameter. Die unterschiedlichen Krankheitsdauern von Patienten mit MMN in dieser Studie könnten zusätzlich zu ihren unterschiedlichen Höhen und Gewichten die Erkennung von Nerven-CSA und Nervenleitungsgeschwindigkeit beeinflussen. Darüber hinaus haben wir nur beobachtet, ob motorische Nerven CB präsentiert und ob es verwandte Veränderungen in CSAs auf einem Ultraschall gab; Die möglichen Mechanismen der verschiedenen Korrelationsmuster zwischen CB und CSA erfordern weitere Untersuchungen. Nur Nerven-CSA, der wichtigste Parameter, wurde in diese Studie aufgenommen, so dass, um genauere Forschung durchzuführen, mehr Index wie Echointensität, sollte beteiligt sein.
Erklärung zur Datenverfügbarkeit
Alle Daten, die nicht im Artikel veröffentlicht wurden, sind verfügbar und werden auf Anfrage von jedem qualifizierten Ermittler geteilt.
Ethikerklärung
Die Ethikkommission des Peking Union Medical College Hospital genehmigte unser Studienprotokoll, und alle Patienten unterzeichneten eine Einverständniserklärung gemäß der Erklärung von Helsinki.
Autorenbeiträge
YL: elektrophysiologische und Ultraschalluntersuchungen, Datenerfassung, statistische Analyse und Manuskriptschreiben. JN: Elektrophysiologische und Ultraschalluntersuchungen und statistische Analysen. LC: Studienkonzept und Design und Manuskriptbearbeitung. TL: Datenerfassung und Manuskriptbearbeitung. QD: elektrophysiologische und Ultraschalluntersuchungen. SW und YG: elektrophysiologische Studien. ML: Studienkonzept und -design, Datenüberprüfung, Manuskriptbearbeitung und kritische Überarbeitung.
Interessenkonflikt
ML erhielt Unterstützung vom Beijing Capital Special Fund (Z171100001017220).
Die übrigen Autoren erklären, dass die Forschung in Abwesenheit von kommerziellen oder finanziellen Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Danksagung
Wir bedanken uns für die Finanzierung durch den Beijing Capital Special Fund (Z171100001017220).
Ergänzungsmaterial
Das Ergänzungsmaterial zu diesem Artikel finden Sie online unter: https://www.frontiersin.org/articles/10.3389/fneur.2019.01055/full#supplementary-material
Video 1. Modus 1: Leitungsblock und CSA-Vergrößerung an derselben Stelle in MMN.
Video 2. Modus 2: Leitungsblock und normale CSA an der gleichen Stelle in MMN.
Video 3. Modus 3: CSA erweiterung ohne entsprechende leitung block.
Abkürzungen
MMN, multifokale motorische Neuropathie; CB, motorische Nervenleitungsblockade; CSA, Querschnittsfläche; NCS, motorische Nervenleitungsstudien.
1. Parry GJ, Clarke S. Multifokale erworbene demyelinisierende Neuropathie, die sich als Motoneuronerkrankung tarnt. Muskelnerv. (1988) 11:103–7. doi: 10.1002/mus.880110203
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
2. Grimm A, Rattay TW, Winter N, Axer H. Periphere Nervenultraschall-Scoring-Systeme: Benchmarking und vergleichende Analyse. J Neurol. (2017) 264:243–53. ust-idnr.: 10.1007/s00415-016-8305- y
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
3. Rattay TW, Winter N, Decard BF, Dammeier NM, Hartig F, Ceanga M, et al. Nervenultraschall als Follow-up-Tool bei behandelter multifokaler motorischer Neuropathie. In: Eur J Neurol. (2017) 24:1125–34. doi: 10.1111/ene.13344
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
4. Loewenbruck KF, Liesenberg J, Dittrich M, Schafer J, Patzner B, Trausch B, et al. Nervenultraschall bei der Differenzierung von multifokaler motorischer Neuropathie (MMN) und Amyotropher Lateralsklerose mit vorherrschender Erkrankung der unteren Motoneuronen (ALS / LMND). J Neurol. (2016) 263:35–44. ust-idnr.: 10.1007/s00415-015-7927-9
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
5. Kerasnoudis A, Pitarokoili K, Behrendt V, Gold R, Yoon MS. Multifokale motorische Neuropathie: korrelation von Nervenultraschall, elektrophysiologischen und klinischen Befunden. In: J Peripher Nerv Syst. (2014) 19:165–74. doi: 10.1111/jns5.12067
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
6. Beekman R, van den Berg LH, Franssen H, Visser LH, van Asseldonk JT, Wokke JH. Die Sonographie zeigt ausgedehnte Nervenvergrößerungen bei multifokaler motorischer Neuropathie. Neurologie. (2005) 65:305–7. doi: 10.1212/01.wnl.0000169179.67764.30
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
7. Olney RK, Lewis RA, Putnam TD, Campellone JV Jr. Konsenskriterien für die Diagnose der multifokalen motorischen Neuropathie. Muskelnerv. (2003) 27:117–21. doi: 10.1002/mus.10317
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
8. Niu J, Cui L, Liu M. Multiple-Sites-Sonographie peripherer Nerven bei der Unterscheidung von Charcot-Marie-Tooth-Typ 1A von chronisch entzündlicher demyelinisierender Polyradikuloneuropathie. Front Neurol. (2017) 8:181. doi: 10.3389/fneur.2017.00181
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
9. Pitarokoili K, Gold R, Yoon MS. Nervenultraschall bei multifokaler motorischer Neuropathie ohne Leitungsblock. Muskelnerv. (2015) 52:294–9. doi: 10.1002/mus.24583
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
10. Hartig F, Ross M, Dammeier NM, Fedtke N, Heiling B, Axer H, et al. Nervenultraschall sagt das Ansprechen der Behandlung bei chronisch entzündlicher demyelinisierender Polyradikuloneuropathie voraus – ein prospektives Follow-up. In: Neurotherapeutics. (2018) 15:439–51. ust-idnr.: 10.1007/s13311-018-0609-4
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
11. Tsukamoto H., Granata G., Coraci D., Paolasso I., Padua L. Ultraschall und neurophysiologische Korrelation bei häufiger fibulärer Nervenleitungsblockade am Fibularkopf. In: Clin Neurophysiol. (2014) 125:1491–5. Ursprungsbezeichnung: 10.1016/j.clinph.2013.11.041
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
12. Harschnitz O., Jongbloed BA, Franssen H., Straver DC, van der Pol WL, van den Berg LH. MMN: from immunological cross-talk to conduction block. J Clin Immunol. (2014) 34(Suppl 1):S112–9. doi: 10.1007/s10875-014-0026-3
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Franssen H. The node of Ranvier in multifocal motor neuropathy. J Clin Immunol. (2014) 34(Suppl 1):S105–11. doi: 10.1007/s10875-014-0023-6
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Taylor BV, Dyck PJ, Engelstad J, Gruener G, Grant I, Dyck PJ. Multifocal motor neuropathy: pathologische Veränderungen an der Stelle des Leitungsblocks. In: J Neuropathol Exp Neurol. (2004) 63:129–37. doi: 10.1093/jnen/63.2.129
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
15. Hartig F, Dammeier NM, Auffenberg E, Rattay TW, Winter N, et al. Ein Blick in die Nervenmorphologie der Nervenfaszikel bei gesunden Kontrollen und Patienten mit Polyneuropathie. In: Clin Neurophysiol. (2017) 128:2521–6. Ursprungsbezeichnung: 10.1016/j.clinph.2017.08.022
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
16. Haakma W, Jongbloed BA, Froeling M, Goedee HS, Bos C, Leemans A, et al. Die MRT zeigt eine Verdickung und veränderte Diffusion der medianen und ulnaren Nerven bei multifokaler motorischer Neuropathie. In: Eur Radiol. (2017) 27:2216–24. ust-idnr.: 10.1007/s00330-016-4575-0
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
17. Kaji R, Oka N, Tsuji T, Mezaki T, Nishio T, Akiguchi I, et al. Pathologische Befunde an der Stelle der Leitungsblockade bei multifokaler motorischer Neuropathie. Ann Neurol. (1993) 33:152–8. doi: 10.1002/Jahr.410330204
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
18. Gallardo E, Noto Y, Simon NG. Ultraschall in der Diagnose der peripheren Neuropathie: Struktur trifft Funktion in der neuromuskulären Klinik. J Neurol Neurochirurgie Psychiatrie. (2015) 86:1066–74. doi: 10.1136/jnnp-2014-309599
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar