Grenzen in der Psychologie
Einführung
Studien zur Farbpräferenz von Kindern haben eine lange Geschichte. Praktisch alle von ihnen haben typischerweise sich entwickelnde (TD) Kinder untersucht. Wegweisende Studien zu diesem Thema (Bornstein, 1975; Zentner, 2001) sowie eine relativ neue (aber bekannteste) Studie (Franklin et al., 2008a) berichteten, dass Jungen und Mädchen im Vorschulalter Rot allen anderen Farben vorziehen. Eine ähnliche Präferenz für Rot wurde für Säuglinge berichtet (Franklin et al., 2010). Obwohl andere Studien Beweise für eine Präferenz für Blau bei Neugeborenen vorgelegt haben (Teller et al., 2005; Zemach et al., 2007) besteht sicherlich ein allgemeiner Konsens darüber, dass TD-Kinder Primärfarben (wie Rot und Blau) anstelle von Sekundärfarben (wie Rosa und Orange) bevorzugen. Als mögliche funktionelle Bedeutung einer solchen Farbpräferenz gilt zudem die Notwendigkeit, subtile Veränderungen der Hautfarbe anderer Personen aufgrund ihrer emotionalen Zustände (z., ein wütendes Gesicht ist rötlich und ein trauriges Gesicht ist blau) wurde argumentiert (Changizi et al., 2006). Eine solche Argumentation geht offenbar davon aus, dass die Präferenz von TD-Kindern für Primärfarben eine prädispositionelle ist.
In Bezug auf Kinder mit Autismus-Spektrum-Störung (ASD), neurologische Entwicklungsstörungen mit ungewöhnlicher sensorischer Verarbeitung, legen einige anekdotische Beweise von Eltern, Betreuern, Lehrern von Personen mit ASD und Personen mit ASD selbst nahe, dass Kinder mit dieser Störung Farbe anders wahrnehmen können als TD-Kinder (Franklin et al., 2008b). Insbesondere die Farbbesessenheit mit Grün wurde reichlich dokumentiert (Higashida, 2013; Silberman, 2015; Masataka, in press). In einem Fall verwendete beispielsweise ein 11-jähriger Junge mit ASD mehr als 3 Jahre lang einen grünen Strohhalm zum Stimmen (Silberman, 2015). Scheinbar seltsame Farbwahrnehmung wurde auch in experimentellen Studien mit Kindern mit ASD berichtet. Zum Beispiel Brian et al. (2003) fanden unerwartet einen erleichternden Effekt durch farbige Stimuli bei der Untersuchung von Hemmmechanismen bei Teilnehmern mit ASD, während ein solcher Effekt bei neurotypischen Kontrollen nicht beobachtet wurde. Die Autoren argumentierten, dass bei ASD Reizmerkmale wie Farbe zu leicht kodiert werden können und somit leichter erkannt werden, als dies typischerweise der Fall ist. Anschließend wurde ein ähnlicher Effekt in Bezug auf die Cueing-Aufgabe gefunden, bei der ungültige Farbhinweise zu höheren Kosten für Teilnehmer mit ASD führten als für neurotypische Kontrollen (Greenway und Plaisted, 2005). Diese Studien fanden durchweg eine Verbesserung der Aufgabenleistung durch farbige Materialien bei diesen Kindern.
Andere Studien (Ludlow et al., 2006, 2008, 2012) fanden in klinischen Umgebungen einen Wahrnehmungsvorteil durch die Verwendung von Farbfiltern bei einem großen Anteil von Personen mit ASD. Die Overlays wurden entwickelt, um Chromatizität systematisch und umfassend zu testen, so dass, wenn es eine Farbe gab, die vorteilhaft war, es eine verfügbare Überlagerung oder Kombination von Überlagerungen gab, die eine enge Annäherung an diese Farbe bereitstellten. Eine andere Studie hingegen versuchte, die kategoriale Farbwahrnehmung zwischen Kindern mit ASD und TD-Kindern zu vergleichen (Franklin et al., 2008b) und berichteten, dass sich die Stärke der kategorialen Farbwahrnehmung zwischen ASD- und TD-Kindern nicht unterschied.
Zusammengenommen haben uns die obigen Ergebnisse zu der Hypothese geführt, dass der grundlegende Mechanismus, der der Wahrnehmungskategorisierung von Farben zugrunde liegt, sich zwischen Menschen mit ASD und ohne ASD nicht unterscheiden würde, die erhöhte Empfindlichkeit gegenüber sensorischer Stimulation im Allgemeinen, die für ASD charakteristisch ist (Markram und Markram, 2010) würde die Farbwahrnehmung von Menschen mit dieser Störung beeinflussen, und dies würde zu einer Abneigung gegen bestimmte Farben führen, die normalerweise von neurotypischen Menschen bevorzugt werden. Die aktuelle Studie wurde entwickelt, um diese Möglichkeit unter Verwendung der gleichen Stimuli wie in der vorherigen Pionierarbeit zu untersuchen, unter der Annahme, dass ASD-Kinder Wahrnehmungsfarbkategorien besitzen, die denen bei TD-Kindern entsprechen.
Materialien und Methoden
Diese Untersuchung wurde nach den in der Erklärung von Helsinki zum Ausdruck gebrachten Grundsätzen durchgeführt. Alle experimentellen Protokolle stimmten mit dem Leitfaden für Experimente mit Menschen überein und wurden von der institutionellen Ethikkommission des Primatenforschungsinstituts der Universität Kyoto genehmigt (# 2011-150). Die Autoren erhielten eine schriftliche Einverständniserklärung von den Eltern aller an der Studie beteiligten Teilnehmer.
Teilnehmer
In der aktuellen Studie wurde eine Gruppe von 29 Kindern mit ASD im Alter von 4 bis 17 Jahren (M = 8,8; SD = 3,0) und 38 TD-Kindern im Alter von 4 bis 17 Jahren (M = 9,8; SD = 4,0) untersucht. Sie waren alle männlich. Es gab keinen signifikanten Unterschied zwischen dem Durchschnittsalter jeder Teilnehmergruppe . Alle Teilnehmer waren Franzosen, Rechtshänder, naïve hinsichtlich des Zwecks dieser Studie und hatten normales oder korrigiertes Sehvermögen. Sie hatten keine Schwierigkeiten bei der Farberkennung.
Neunundzwanzig Kinder mit ASD wurden für die aktuelle Studie rekrutiert. Basierend auf der direkten klinischen Beobachtung jedes Kindes durch einen unabhängigen Kinderpsychiater wurde eine Diagnose von Autismus gemäß ICD-10 (Weltgesundheitsorganisation, 1994) sowie DSM-IV (American Psychiatric Association, 1994) gestellt. Auf der Grundlage dieser Kriterien wurde jeder Teilnehmer in der Gruppe der Kinder mit ASD entweder als F84.0, F84.9 oder F84.8 diagnostiziert. Darüber hinaus wurden solche Diagnosen auch durch das bestätigt Autism Diagnostic Interview-Revised (ADI-R), ein umfangreiches, halbstrukturiertes Elterninterview (Lord et al., 1994), die von einem unabhängigen Psychiater durchgeführt wurde. Der ADI-R liefert Informationen über das Vorhandensein verbaler Sprachkenntnisse, definiert als tägliche, funktionale und umfassende Verwendung spontaner Phrasen mit mindestens drei Wörtern und gelegentlich einem Verb. Alle Teilnehmer ASD Kinder wurden gefunden, um verbale Sprache auszudrücken. Alle TD-Kinder wurden über das Board of Education in einer kleinen Stadt in Frankreich rekrutiert. Alle besuchten normale Klassen, die ihrem chronologischen Alter entsprachen. Keiner der in die Gruppen der TD-Kinder einbezogenen Teilnehmer erfüllte ein diagnostisches Kriterium für Autismus oder eine andere weit verbreitete Entwicklungsstörung.
Um eine mögliche Entwicklungsänderung der Farbpräferenz zu untersuchen, wurde jedes der ASD-Kinder und die TD-Kinder in eine von drei Altersgruppen eingeteilt: eine Altersgruppe bestand aus Kindern im Alter von 4 bis 7 Jahren (9 ASD-Kinder und 13 TD-Kinder), eine Gruppe bestand aus Kindern im Alter von 8 bis 10 Jahren (9 ASD-Kinder und 17 TD-Kinder) und die verbleibende Gruppe bestand aus Kindern im Alter von 11 bis 17 Jahren (11 ASD-Kinder und 8 TD-Kinder). Da die ANOVA-Annahmen (Varianzanalyse) sicherlich erfüllt sind, sollte eine solche Aufteilung der gesamten Teilnehmergruppe kohärent sein, um mögliche Änderungen innerhalb einer Entwicklungsperspektive zu untersuchen.
Die in der aktuellen Studie verwendeten Materialien bestanden aus sechs 35 cm × 50 cm großen Kartonrechtecken in den Farben rot, gelb, Pink, Blau, grün oder braun. Sie waren im Wesentlichen die gleichen wie die Materialien, die in der vorherigen Studie verwendet wurden (Zentner, 2001), so dass wir unsere hier erzielten Ergebnisse mit denen vergleichen konnten, die dort berichtet wurden. Farbton, Leuchtdichte und Chroma jedes Farbstimulus, der gemäß dem Munsell-System der Farbnotation spezifiziert wurde, waren wie folgt: rot, 7.5R, 4, 14; gelb, 10Y, 8.5, 12; rosa, 7.5PR, 6, 10; grün, 2.5G, 3, 8; blau, 10B, 7, 8; braun, 10R, 3, 10.
Das Testprotokoll war auch das gleiche wie in der vorherigen Studie (Zentner, 2001). Die Teilnehmer wurden einzeln in einem ruhigen Raum unter Tageslichtbedingungen getestet. Alle sechs Pappen wurden dem Teilnehmer präsentiert, der auf einem Stuhl saß und gebeten wurde, die Farbe auszuwählen, die er mochte. Ihr bevorzugter Rang unter den Kartons wurde durch Forced-Choice-Paarvergleichsverfahren gemessen. Jedes Mal, wenn der Teilnehmer die Farbe auswählte, wurde eine Präferenz für diese Farbe aufgezeichnet. Für die statistische Analyse wurde der Präferenzwert für die Farbe berechnet, indem sein Präferenzrang von der Nummer der Stimulusfarbe subtrahiert wurde (6).
Ergebnisse
Die Gesamtergebnisse des Experiments sind in Abbildung 1 zusammengefasst, die den mittleren Gesamtrang der sechs Farben in der Gruppe der TD-Kinder und der ASD-Kinder zeigt. Wenn die gesammelten Daten unter Verwendung einer 2 (ASD / TD, TEILNEHMER) × 3 (Altersgruppen, ALTER) ANOVA für jede der sechs Farben analysiert wurden, war einer der beiden Haupteffekte (TEILNEHMER) statistisch signifikant für Gelb, F (1,61) = 49,60, p = 0.000, np2 = 0,284 und für Grün, F(1,61) = 5,03, p = 0,029, np2 = 0,114. Der andere Haupteffekt (AGE) war weder für Gelb, F(2,61) = 0,84, p = 0,44, np2 = 0,028, noch für Grün, F(2,61) = 1,50, p = 0,23, np2 = 0,53 signifikant. Die Interaktion zwischen TEILNEHMER und ALTER war nicht signifikant für gelb, F(2,61) = 0,25, p = 0,78, np2 = 0,08, oder für grün, F(2,61) = 0,28, p = 0,76, np2 = 0,09, entweder.
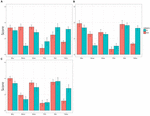
ABBILDUNG 1. Mittlere Präferenzwerte (Fehlerbalken: SDs) von sechs Farben bei Kindern mit Autismus-Spektrum-Störung (ASD) und bei sich typischerweise entwickelnden (TD) Kindern. A) 4- bis 7-Jährige, B) 8- bis 10-Jährige und C) 11- bis 17-Jährige.
Für die Farbe Braun waren sowohl der Haupteffekt, der TEILNEHMER als auch die Interaktion zwischen TEILNEHMER und ALTER signifikant, F (1,61) = 33,06, p = 0,0000, np2 = 0,35 für TEILNEHMER und F (2,61) = 4,11, p = 0,021, np2 = 0,119 für TEILNEHMER × ALTER. Der andere Haupteffekt war jedoch nicht signifikant, F (1,61) = 1,89, p = 0,16, np2 = 0,062. Nachfolgende Analysen einfacher Haupteffekte (Bonferroni-Korrektur) ergaben, dass der mittlere Rang der Präferenz für Braun bei 11- bis 17-jährigen Kindern mit ASD kleiner war als bei 4- bis 7-jährigen Kindern mit ASD, p = 0,001, sowie bei 8- bis 10-jährigen Kindern mit ASD, p = 0,03. Der mittlere Rang der Präferenz von 4- bis 7-jährigen Kindern mit ASD unterschied sich nicht von dem von 11- bis 17-jährigen Kindern mit ASD, p = 0,31.
Im Gegensatz dazu war weder einer der beiden Haupteffekte noch die Wechselwirkung zwischen ihnen für Rot signifikant, F(1,61) = 0,70, p = 0,41, np2 = 0.012 für TEILNEHMER, F (2,61) = 1,77, p = 0,18, np2 = 0,068 für ALTER, F (2,61) = 0,98, p = 0,38, np2 = 0,081 für TEILNEHMER × ALTER, für blau, F (1,61) = 3,39, p = 0,08, np2 = 0,046 für TEILNEHMER, F (2,61) = 1,25, p = 0,29 , np2 = 0,040 für ALTER, F (2,61) = 0,09, p = 0,91, np2 = 0,003 für TEILNEHMER × ALTER und für Rosa, F (1,61) = 1,90, p = 0,17, np2 = 0,028 für TEILNEHMER, F (2,61) = 0,51, p = 0,61, np2 = 0,040 für ALTER, F (2,61) = 0,41, p = 0,66, np2 = 0,003 für das ALTER des TEILNEHMERS.
In Bezug auf TD-Kinder stimmen die Ergebnisse der aktuellen Studie mit den zuvor berichteten überein (Zentner, 2001; Franklin et al., 2010). Rot war die am meisten bevorzugte Farbe. Blau war nah dran, und dann folgte Gelb. Die am wenigsten bevorzugte Farbe war braun. Wie in einer aktuellen Studie berichtet, wurde Pink auch von Jungen gemieden (LoBue und DeLoache, 2011). Solche Befunde wurden auch bei Kindern mit ASD bestätigt. Ihre Präferenz für Gelb war jedoch niedrig, und die für Grün sowie die für Braun war umgekehrt erhöht.
Da die hier vorgestellten Farbkategorien eingeschränkt waren, erscheint es schwierig, aus diesen Ergebnissen einen eindeutigen Schluss zu ziehen. Angesichts der relativ kleinen Stichprobengröße in jeder der drei Altersgruppen könnte das Versäumnis, einen Unterschied in den Präferenzwerten zwischen TD-Kindern und Kindern mit ASD in Bezug auf Rot, Blau und Pink zu finden, auf einen Decken- / Bodeneffekt zurückzuführen sein. Abgesehen von diesem Problem sollte jedoch beachtet werden, dass Kinder mit ASD sicherlich Gelb meiden und umgekehrt Grün und Braun bevorzugen. Diese Ergebnisse sind sicherlich diejenigen, die von unserer oben skizzierten Hypothese vorhergesagt wurden. Darüber hinaus steht ihre Präferenz für Grün im Einklang mit anekdotischen Beweisen, die bisher berichtet wurden (Higashida, 2013; Silberman, 2015; Masataka, in press).
Um diese Ergebnisse zu erklären, sollte die Tatsache, dass die gelbe Farbe den höchsten Luminanzwert unter den getesteten Farben hatte, nicht ignoriert werden. Die beobachtete Abneigung gegen diese Farbe könnte die Hyperempfindlichkeit von Kindern mit ASD gegenüber der Luminanz widerspiegeln. Es besteht auch ein allgemeiner Konsens darüber, dass Gelb die ermüdendste Farbe ist (Kernell, 2016). Es ist bekannt, dass unsere Augen mit drei verschiedenen Arten von Zapfenzellen für die Farbwahrnehmung versehen sind, L, M und S, die der Wahrnehmung von rotem, grünem bzw. blauem Licht entsprechen. Wenn Gelb wahrgenommen wird, müssen jedoch sowohl L als auch M beteiligt sein. Die Wahrnehmung von Gelb sollte daher die sensorisch am stärksten belastete Wahrnehmung jeder Art von Farbe sein. Seine Wahrnehmung ist für TD-Kinder erträglich, könnte aber für Kinder mit ASD, deren Empfindlichkeit gegenüber sensorischer Stimulation erhöht ist, überlastet sein.
Es wird oft berichtet, dass Kinder mit ASD überempfindlich auf taktile, auditive und visuelle Eingaben reagieren. Im auditorischen Bereich zeigen sie eine verbesserte Unterscheidung zwischen auditorischen Reizen, eine genauere lokale Zielerkennung von auditorischen Reizen und eine verminderte globale Interferenz mit der auditorischen Verarbeitung (Takahashi et al., 2014). Im visuellen Bereich weisen sie verbesserte visuelle Unterscheidungsfähigkeiten, eine schnellere Zielerkennung bei der Suche nach Merkmalen und konjunktiven Visuals, eine genauere lokale Zielerkennung usw. auf (Markram und Markram, 2010). Die aktuelle Studie legt die Möglichkeit nahe, dass ein solches Phänomen auch im Bereich der Farbwahrnehmung auftritt. Die Farbe Gelb als Sinnesreiz, die für TD-Kinder normal ist, kann für Kinder mit ASD schwer zu ertragen sein.
In jüngster Zeit wurden sowohl die für ASD charakteristische Hyperempfindung als auch die für ASD charakteristische Hyperaufmerksamkeit neurologisch im Hinblick auf eine zugrunde liegende neuronale Unterkonnektivität zwischen kortikalen Bereichen bei dieser Störung erklärt (Just et al., 2004), die die Integration oder Kommunikation zwischen kortikalen Regionen, die an der Verarbeitung visueller Bilder sowie an der Sprache beteiligt sind, negativ beeinflussen oder verlangsamen könnten. Diese Erklärung führt viele der weit verbreiteten Anomalien in der psychologischen Funktion bei ASD auf eine Beeinträchtigung der Koordination und Kommunikation zwischen wichtigen Gehirnverarbeitungszentren zurück. Eine der wichtigsten Vorhersagen, die auf dieser Erklärung beruhen, ist, dass jede Facette der psychologischen und neurologischen Funktion, die von der Koordination oder Integration von Gehirnregionen abhängt, anfällig für Störungen bei ASD ist. Neurologisch gesehen besagt eine allgemein akzeptierte grundlegende Darstellung der Farbverarbeitung, dass das Farbsehen in der Netzhaut beginnt, dass dann parvozelluläre und koniozelluläre Zellen im lateralen genikulären Kern für die Chromatizität und magnozelluläre Zellen für die Luminanz kodieren und somit unterschiedliche Wege zum visuellen Kortex bereitstellen, wo verschiedene farbselektive Neuronen gefunden werden (Kernell, 2016). Das Muster der Ergebnisse in der aktuellen Studie könnte sich aus der Störung eines oder mehrerer dieser verschiedenen biologischen und neurologischen Prozesse ergeben. Weitere Studien sind erforderlich, um dies zu untersuchen.
Eine Person, die unter Reizüberflutung leidet, wird natürlich einen so starken Reiz wie aversiv vermeiden. Eine solche Vermeidung könnte sich als die beobachtete atypische Farbpräferenz in der aktuellen Studie manifestieren. Die Tatsache, dass die robuste Vermeidung von Braun nur bei Kindern mit ASD unter 11 Jahren beobachtet wurde, könnte auf die Möglichkeit hindeuten, dass die Hypersensitivität während dieser Entwicklungsphase bei dieser Störung am intensivsten ist. Anscheinend ist dies auch das Problem, das in naher Zukunft untersucht werden soll.
Autorenbeiträge
NM entwarf die Studie. MG hat die Daten gesammelt. NM analysierte die Daten und entwarf das Manuskript. Beide lasen den Entwurf und stimmten ihm zu.
Finanzierung
Die Studie wurde durch einen Grant-in-Aid (JSPS”25285201) unterstützt.
Interessenkonflikterklärung
Die Autoren erklären, dass die Forschung in Abwesenheit von kommerziellen oder finanziellen Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Danksagung
Die Autoren danken Ronan Jubin und Nathalie Lavenne-Collot für die Unterstützung bei der Rekrutierung, Mayuko Iriguchi und Hiroki Koda für die Unterstützung bei der Durchführung des Experiments und Elizabeth Nakajima für das Korrekturlesen des englischen Manuskripts.
Amerikanische Psychiatrische Vereinigung (1994). Diagnostisches und statistisches Handbuch für psychische Störungen. Washington, DC: Amerikanische Psychiatrische Vereinigung, 1-609.
Google Scholar
Bornstein, M. H. (1975). Qualitäten des Farbsehens in der Kindheit. In: J. Exp. Kind Psychol. 19, 401–419. doi: 10.1016/0022-0965(75)90070-3
CrossRef Volltext / Google Scholar
Brian, J. A., Tipper, S. P., Weaver, B. und Bryson, S. E. (2003). Hemmmechanismen bei Autismus-Spektrum-Störungen: typische selektive Hemmung des Ortes im Vergleich zur erleichterten Wahrnehmungsverarbeitung. J. Kinderpsychol. Psychiatrie 44, 552-560. doi: 10.1111/1469-7610.00144
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Changizi, MA, Zhang, Q. und Shimojo, S. (2006). Nackte Haut, Blut und die Evolution des Farbsehens von Primaten. Biol. Lett. 2, 217–221. ursprungsbezeichnung: 10.1098/rsbl.2006.0440
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Franklin, A., Bevis, L., Ling, Y. und Hurbert, A. (2010). Biologische Komponenten der Farbpräferenz im Säuglingsalter. Dev. Sci. 21, 346–354. doi: 10.1111/j.1467-7687.2009.00884.x
PubMed Zusammenfassung / CrossRef Volltext
Franklin, A., Pitchford, N., Hart, L., Davies, I. R., Clausse, S. und Jenings, S. (2008a). Hervorhebung der Primär- und Sekundärfarbe im Säuglingsalter. Br. J. Dev. Psychol. 26, 471–483. doi: 10.1348/026151007X256672
Querverweis Volltext / Google Scholar
Franklin, A., Snowdon, P., Burley, R., Notman, L. und Alder, E. (2008b). Farbwahrnehmung bei Kindern mit Autismus. J. Autismus Dev. Unordnung. 18, 1837–1847. doi: 10.1007/s10803-008-0574-6
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Greenway, R. und Plaisted, K. (2005). Die Top-Down-Aufmerksamkeitsmodulation bei autistischen Spektrumstörungen ist reizspezifisch. Psychol. Sci. 16, 987–994. doi: 10.1111/j.1467-9280.2005.01648.x
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Higashida, N. (2013). Der Grund, warum ich springe: Die innere Stimme eines dreizehnjährigen Jungen mit Autismus. New York, NY: Random House, 1-129.
Just, M. A., Cherkassky, V. L., Keller, T. A. und Minshew, N. J. (2004). Kortikale Aktivierung, Synchronisation während des Satzverständnisses bei hochfunktionierendem Autismus: Hinweise auf Unterkonnektivität. Gehirn 127, 1811-1821. doi: 10.1093/gehirn /awh199
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Kernell, D. (2016). Farbe und Farbsehen: Eine einführende Umfrage. Cambridge: Cambridge University Press, 1-345.
Google Scholar
LoBue, V. und DeLoache, J. (2011). Pretty in pink: Die frühe Entwicklung geschlechtsstereotypischer Farbpräferenzen. Br. J. Dev. Pshychol. 29, 656–667. Ursprungsbezeichnung: 10.1111/j.2044-835X.2011.02027.x
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Herr, C., Rutter, M., und Le Couteur, A. (1994). Autismus-Diagnoseinterview-überarbeitet: Eine überarbeitete Version eines Diagnoseinterviews für Betreuer von Personen mit möglichen weit verbreiteten Entwicklungsstörungen. J. Autismus Dev. Unordnung. 24, 659–685. doi: 10.1007/BF02172145
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Ludlow, AK, Taylor-Whiffen, E. und Wilkins, AJ (2008). Farbige Overlays verbessern die visuelle Wahrnehmungsleistung bei Kindern mit Autismus-Spektrum-Störungen. Res. Autismus Spectr. Unordnung. 2, 498–515. doi: 10.1016/j.rasd.2007.10.001
Querverweis Volltext / Google Scholar
Ludlow, AK, Taylor-Whiffen, E. und Wilkins, AJ (2012). Farbfilter verbessern die visuelle Wahrnehmung sozialer Signale bei Kindern mit Autismus-Spektrum-Störungen. In: ISRN Neurol. 2012: 298098. doi: 10.5402/2012/298098
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Ludlow, AK, Wilkins, AJ und Heaton, P. (2006). Die Wirkung von farbigen Overlays auf die Lesefähigkeit bei Kindern mit Autismus. J. Autismus Dev. Unordnung. 36, 507–516. doi: 10.1007/s10803-006-0090-5
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Markram, K. und Markram, H. (2010). Die intensive Welttheorie – Eine vereinheitlichende Theorie der Neurobiologie des Autismus. Front. Summen. Neurowissenschaften. 4:224. ursprungsbezeichnung: 10.3389/fnhum.2010.00224
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Masataka, N. (im Druck). Implikationen der Idee der Neurodiversität für das Verständnis der Ursprünge von Entwicklungsstörungen. Physik Leben Rev.
Silberman, S. (2015). NeuroTribes: Das Erbe des Autismus und die Zukunft der Neurodiversität. New York, NY: Avery, 1-534.
Google Scholar
Takahashi, H., Nakahachi, T., Komatsu, S., Ogino, K., Iida, Y. und Kamio, Y. (2014). Hyperreaktivität auf schwache akustische Reize und verlängerte akustische Schrecklatenz bei Kindern mit Autismus-Spektrum-Störungen. Mol. Mose 5: 23, Nw. doi: 10.1186/2040-2392-5-23
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Teller, D. Y., Civan, A. und Bronson-Castain, K. (2005). Die spontanen Farbpräferenzen von Säuglingen sind nicht auf Helligkeitsschwankungen wie bei Erwachsenen zurückzuführen. Visuelle Neurowissenschaften. 21, 397–401. doi: 10.1017/S0952523804213360
Querverweis Volltext / Google Scholar
Weltgesundheitsorganisation (1994). Das zusammengesetzte internationale diagnostische Interview, Version 1.1. Genf: Weltgesundheitsorganisation, 1-632.
Google Scholar
Zemach, I., Chang, S. und Teller, DY (2007). Infant Color Vision: Vorhersage der spontanen Farbpräferenzen von Säuglingen. Vision Res. 47, 1368-1381. Ursprungsbezeichnung: 10.1016/j.visres.2006.09.024
PubMed Abstract | CrossRef Full Text | Google Scholar