17.3: komplex ionok képződése
a komplex ionok képződésének hatása az Oldhatóságra
mi történik a gyengén oldódó só oldhatóságával, ha egy stabil komplex iont képező ligandumot adunk az oldathoz? Az egyik ilyen példa a hagyományos fekete-fehér fényképezésben fordul elő. Emlékezzünk arra, hogy a fekete-fehér fényképészeti film agbr fényérzékeny mikrokristályokat vagy AgBr és más ezüsthalogenidek keverékeit tartalmazza. Az AgBr egy takarékosan oldódó só, amelynek Ksp – je 5,35 kb 10-13, 25 Kb. Amikor a fényképezőgép redőnye kinyílik, a fényképezett tárgy fénye eltalálja a film néhány kristályát, és fotokémiai reakciót indít el, amely az AgBr-t fekete Ag fémdé alakítja. A jól formált, stabil negatív képek szürke tónusokban jelennek meg, ami megfelel az átalakított AgBr szemcsék számának, a legtöbb fénynek kitett területek pedig a legsötétebbek. A kép rögzítése és annak megakadályozása érdekében, hogy több AgBr kristály Ag fémdé alakuljon át a film feldolgozása során, a filmen lévő nem reagált AgBr-t komplexációs reakcióval távolítják el, hogy feloldják a gyengén oldódó sót.
az ezüst-bromid oldódásának reakciója a következő:
\
val vel
\
az egyensúly messze balra fekszik, és az Ag+ és a Br− ionok egyensúlyi koncentrációja nagyon alacsony (7,31 60-7 m). Ennek eredményeként a reakció nélküli AgBr eltávolítása akár egyetlen Filmtekercsből tiszta vízzel több tízezer liter vizet és sok időt igényelne. A Le Chatelier elve azonban azt mondja nekünk, hogy az egyik termék eltávolításával jobbra tudjuk vezetni a reakciót, ami több AgBr feloldódását okozza. A bromid-iont kémiailag nehéz eltávolítani, de az ezüstion különféle stabil kétkoordinátás komplexeket képez semleges ligandumokkal, például ammóniával, vagy anionos ligandumokkal, például cianiddal vagy tioszulfáttal (S2O32 -). A fényképészeti feldolgozás során az AgBr feleslegét nátrium-tioszulfát koncentrált oldatával oldjuk fel.
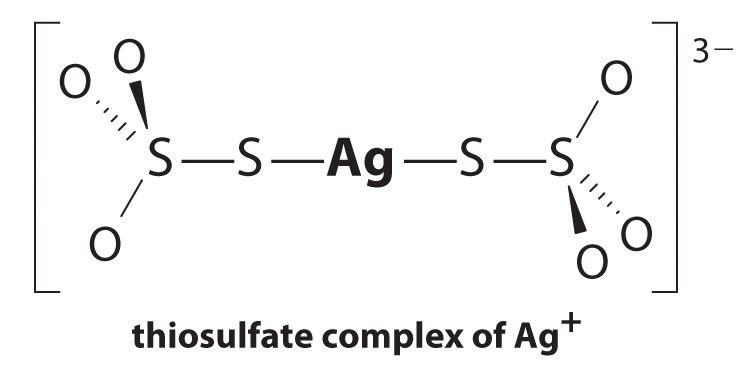
az Ag+ tioszulfáttal való reakciója a következő:
\^{3−}_{(aq)} \ címke{17.3.5a}\]
a
\
az egyensúlyi állandó nagysága azt jelzi, hogy az oldatban szinte az összes Ag+ iont a tioszulfát azonnal komplexálja 3−formává. Láthatjuk a tioszulfát hatását az AgBr oldhatóságára a megfelelő reakciók leírásával és összeadásával:
\\ \mathrm{Ag^+(aq)}+\mathrm{2s_2o_3^{2 -} (aq)}\rightleftharpons\mathrm{^{3 -} (aq)}\hspace{3mm}K_\textrm f&=2.9\alkalom10^{13}
\\ \mathrm{AgBr(s)}+\mathrm{2S_2O_3^{2-}(aq)}\rightleftharpoons\mathrm{^{3-}(aq)}+\mathrm{Br^-(aq)}\hspace{3mm}K&=K_{\textrm{sp}}K_{\textrm f}=15 \ end{align} \ címke{17.3.6}\)
összehasonlítva a K-t a Ksp-vel azt mutatja, hogy a komplex ion képződése hozzávetőlegesen növeli az AgBr oldhatóságát 3 kb 1013. Az oldhatóság drámai növekedése az alacsony költséggel és az alacsony toxicitással együtt megmagyarázza, hogy a nátrium-tioszulfátot szinte általánosan használják a fekete-fehér film előállításához. Kívánt esetben az ezüst kinyerhető a tioszulfát-oldatból a különböző módszerek bármelyikével, és újrahasznosítható.
ha egy komplex ionnak nagy a Kf-je, akkor a komplex ion képződése drámai módon növelheti a gyengén oldódó sók oldhatóságát.
példa \(\PageIndex{2}\)
a közös ionhatás miatt arra számíthatunk, hogy egy olyan só, mint az AgCl, sokkal kevésbé oldódik a KCL koncentrált oldatában, mint vízben. Egy ilyen feltételezés azonban helytelen lenne, mert figyelmen kívül hagyja azt a tényt, hogy az ezüstion hajlamos kétkoordinátás komplexet alkotni kloridionokkal (AgCl2 -). Számítsa ki az AgCl oldhatóságát minden helyzetben:
- tiszta vízben
- 1,0 M KCl oldatban, figyelmen kívül hagyva bármely komplex ionok képződését
- ugyanaz az oldat, mint a (B) részben, kivéve a komplex ionok képződését, feltételezve, hogy AgCl2-az egyetlen Ag + komplex, amely szignifikáns koncentrációban képződik
25 Ca-N, Ksp = 1,77 10-10 AgCl és Kf = 1.1 605 az AgCl2 esetében−.
adott: AgCl Ksp, AgCl2-Kf és KCl koncentráció
kért: AgCl oldhatósága vízben és KCL oldatban komplex ionok képződésével és anélkül
stratégia:
- írja be az oldhatósági termék kifejezését az AgCl-re, és számítsa ki az Ag+ és a CL− koncentrációját vízben.
- számítsuk ki az Ag+ koncentrációját a KCl oldatban.
- írjon kiegyensúlyozott kémiai egyenleteket az AgCl oldódásához és az AgCl2− komplex kialakulásához. Adjuk hozzá a két egyenletet, és számítsuk ki az egyensúlyi állandót a teljes egyensúlyra.
- írja be a teljes reakció egyensúlyi állandó kifejezését. Oldja meg a komplex ion koncentrációját.
megoldás
- A Ha hagyjuk, hogy x egyenlő legyen az AgCl oldhatóságával, akkor egyensúlyban = = x M. ezt az értéket helyettesítve az oldhatósági termék kifejezésével,
így az AgCl tiszta vízben való oldhatósága 25 KB-nál 1,33 kb 10-5 M.
- B Ha x egyenlő az AgCl oldhatóságával a KCl oldatban, akkor egyensúlyi állapotban = x M és = (1,0 + x) M. ezeket az értékeket helyettesítjük az oldhatósági termék kifejezésével, és feltételezzük, hogy x << 1.0,
ha a közös ionhatás lenne az egyetlen fontos tényező, akkor azt jósolnánk, hogy az AgCl körülbelül öt nagyságrenddel kevésbé oldódik 1,0 M KCl oldatban, mint vízben.
- C a komplex ionok képződésének hatásainak figyelembevételéhez először meg kell írnunk az egyensúlyi egyenleteket mind a komplex ionok oldódására, mind képződésére. A Ksp-nek és a Kf-nek megfelelő egyenletek összeadásával olyan egyenletet kapunk, amely leírja az AgCl feloldódását egy KCl-megoldásban. A reakció egyensúlyi állandója tehát a KSP és a Kf szorzata:
\\ \mathrm{Ag^+(aq)}+ \ mathrm{2cl^{ – }} \ rightleftharpons \ mathrm {^{ – }} \ hspace{3mm}K_ \ textrm f& =1.1 \ times10^{5}
\\ \mathrm{AgCl(s)}+\mathrm{Cl^{-}}\rightleftharpoons\mathrm{^{-}}\hspace{3mm}K&=K_{\textrm{sp}}K_{\textrm f}=1,9 \ times10^{-5} \ end{align}\)
D ha hagyjuk, hogy x egyenlő legyen az AgCl oldhatóságával a KCl oldatban, akkor egyensúlyi = x és = 1,0 − x. ezeket a mennyiségeket a nettó reakció egyensúlyi állandó kifejezésével helyettesítjük, és feltételezzük, hogy x << 1.0,
vagyis az AgCl feloldódik 1,0 M KCl− ben, hogy az AgCl2-komplex ion 1,9 kb 10-5 M-es oldatát hozza létre. Így azt jósoljuk, hogy az AgCl körülbelül ugyanolyan oldhatósággal rendelkezik 1,0 M KCl oldatban, mint tiszta vízben, ami 105-ször nagyobb, mint a közös ionhatás alapján jósolt. (Valójában az AgCl mért oldhatósága 1,0 M KCl-ben majdnem 10-szer nagyobb, mint a tiszta vízben, nagyrészt más kloridtartalmú komplexek képződésének köszönhetően.)
gyakorlat \(\PageIndex{2}\)
Számítsa ki a higany(II) – jodid (HgI2) oldhatóságát minden helyzetben:
- tiszta víz
- a NaI 3,0 M-es oldata, feltételezve, hogy a 2− az egyetlen Hg-tartalmú faj, amely jelentős mennyiségben van jelen
Ksp = 2,9 60-29 (HgI2) és Kf = 6,8 1029 (2−).
Válasz
- 1.9 × 10-10 M
- 1.4 M
komplexképző szerek, molekulák vagy ionok, amelyek oldható fémkomplexek kialakításával növelik a fémsók oldhatóságát, a mosószerek általános alkotóelemei. A szappanok fő alkotóelemei a hosszú szénláncú karbonsavak, amelyek Ca2+ és Mg2+ oldhatatlan sókat képeznek, amelyek nagy koncentrációban vannak jelen a “kemény” vízben. Ezeknek a sóknak a kicsapódása fürdőkádgyűrűt eredményez, és szürke árnyalatot ad a ruházatnak. Komplexképző anyag, például pirofoszfát (O3POPO34− vagy P2O74−) vagy trifoszfát (P3O105−) hozzáadása a mosószerekhez megakadályozza a magnézium – és kalciumsók kicsapódását, mivel a komplexionképződés egyensúlyi állandója nagy:
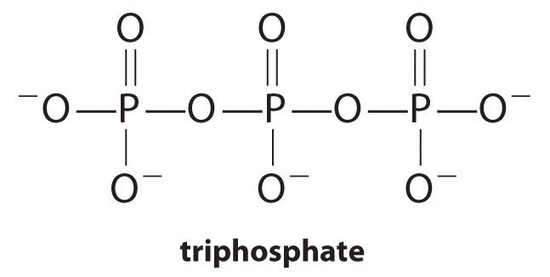
a foszfátok azonban környezeti károkat okozhatnak azáltal, hogy elősegítik az eutrofizálódást, az algák túlzott mennyiségének növekedését a víztestben, ami végül az oldott oxigén szintjének jelentős csökkenéséhez vezethet, amely megöli a halakat és más vízi szervezeteket. Következésképpen az Egyesült Államok számos állama betiltotta a foszfáttartalmú mosószerek használatát, Franciaország pedig 2007-től betiltotta azok használatát. A” foszfátmentes ” mosószerek különféle komplexképző szereket tartalmaznak, például ecetsav-származékokat vagy más karbonsavakat. A foszfátpótlók fejlesztése intenzív kutatás területe.
a kereskedelmi vízlágyítók komplexképző anyagot is használnak a kemény víz kezelésére úgy, hogy a vizet ioncserélő gyantákon, amelyek komplex nátriumsók. Amikor a víz átfolyik a gyantán, a nátriumion feloldódik, és az oldhatatlan sók kicsapódnak a gyanta felületére. Az így kezelt víz sósabb ízű a Na + jelenléte miatt, de kevesebb oldott ásványi anyagot tartalmaz.
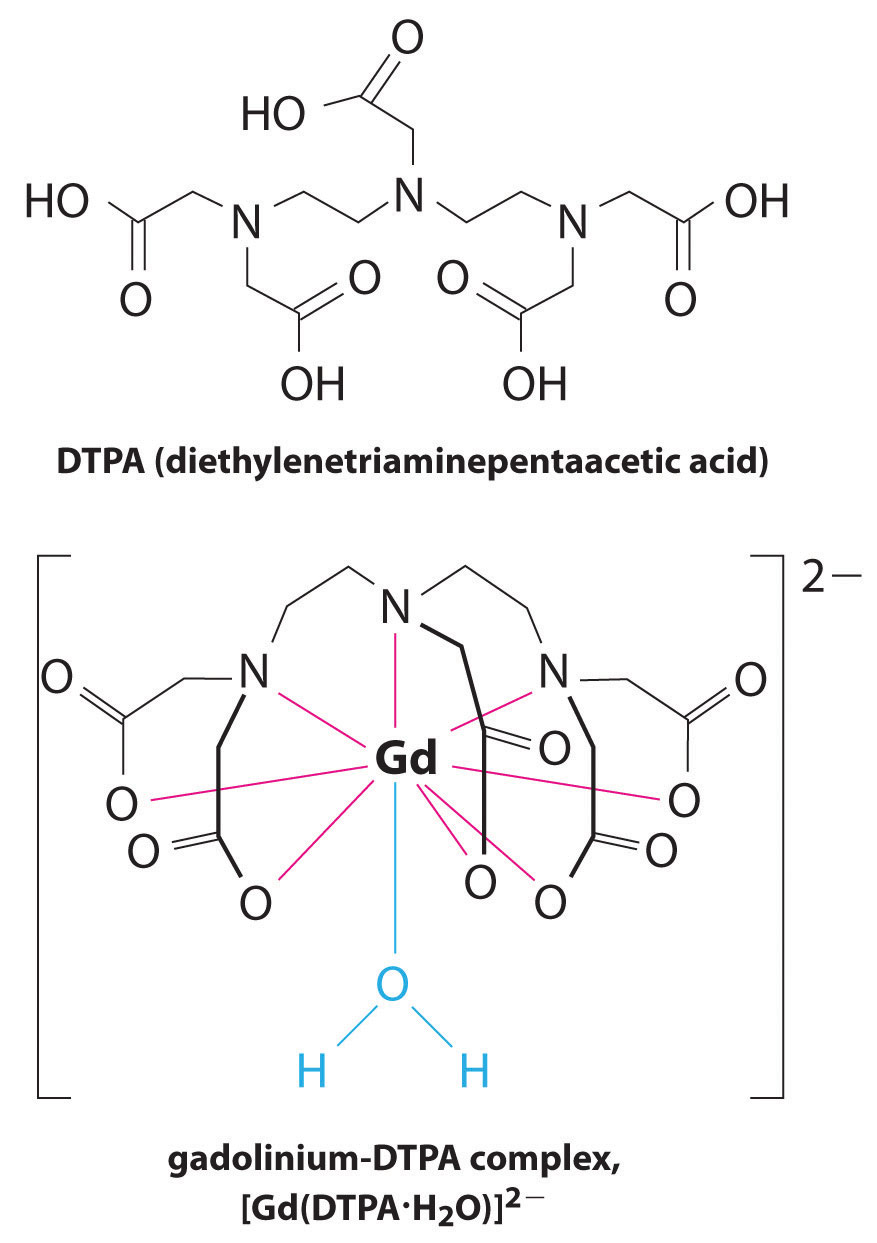
a komplexképző szerek másik alkalmazása megtalálható az orvostudományban. A röntgensugarakkal ellentétben a mágneses rezonancia képalkotás (MRI) viszonylag jó képeket adhat a lágy szövetekről, például a belső szervekről. Az MRI a vízben lévő hidrogénatomok 1H magjának mágneses tulajdonságain alapul, amely a lágy szövetek Egyik fő alkotóeleme. Mivel a víz tulajdonságai nem nagyon függenek attól, hogy a sejt belsejében vagy a vérben van-e, nehéz részletes képeket készíteni ezekről a jó kontrasztú szövetekről. A probléma megoldására a tudósok kifejlesztettek egy fémkomplexum-osztályt, amelyet “MRI kontrasztanyagoknak” neveznek.”Az MRI kontrasztanyag beadása a betegbe szelektíven befolyásolja a víz mágneses tulajdonságait a normál szövetek sejtjeiben, a daganatokban vagy az erekben, és lehetővé teszi az orvosok számára, hogy ezeket külön-külön “lássák” (\(\pageindex{2}\) ábra). Az alkalmazás egyik legfontosabb fémionja a Gd3+, amely hét párosítatlan elektronnal erősen paramágneses. Mivel a Gd3+(AQ) meglehetősen mérgező, nagyon stabil komplexként kell beadni, amely nem disszociál a szervezetben, és a vesén keresztül sértetlenül ürülhet ki. A gadolíniumhoz használt komplexképző szerek olyan ligandumok, mint a DTPA5− (Dietilén-triamin-pentaecetsav), amelyek teljesen protonált formáját itt mutatjuk be.
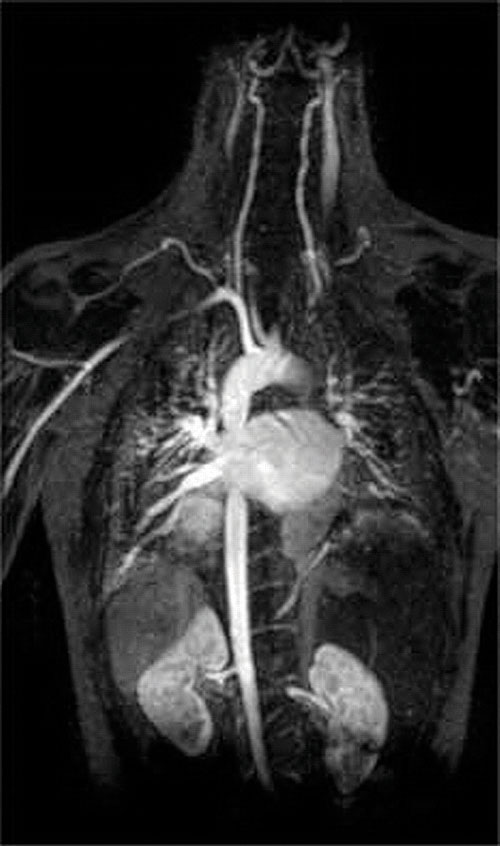
ábra \(\PageIndex{2}\): a szív, az artériák és a vénák MRI képe. Amikor egy pácienst paramágneses fém kationnal injektálnak egy stabil komplex formájában, amely MRI kontrasztanyagként ismert, a sejtekben lévő víz mágneses tulajdonságai megváltoznak. Mivel a különböző típusú sejtek különböző környezetei eltérően reagálnak, az orvos részletes képeket kaphat a lágy szövetekről.