2.3: szén-monoxid és backbonding
Általános tulajdonságok
a CO egy dative, L típusú ligandum, amely nem befolyásolja a fémközpont oxidációs állapotát kötéskor, de két egységgel növeli a teljes elektronszámot. Nemrégiben láttuk, hogy a karbonil ligandumban valóban két kötési kölcsönhatás játszik szerepet: a ligandum-fém n ~ d ~ d kölcsönhatás és a fém-ligandum DN ~ * kölcsönhatás. Ez utóbbi kölcsönhatást backbondingnak nevezzük, mert a fém az elektronsűrűséget visszaadja a ligandumnak. Hogy emlékeztessem magam a backbonding létezésére, szeretem a jobb oldali rezonancia struktúrát használni, amikor csak lehetséges; azonban, fontos megjegyezni, hogy a CO-t L-típusú ligandumként kezeljük, függetlenül attól, hogy milyen rezonancia formát rajzolunk.

orbitális kölcsönhatások M=C = O.
CO egy erős (vagy bázis-bázis) és egy jó (vagy acid-acid) (bázis-bázis). A ligált CO tulajdonságai mélyen függenek a fémközpont identitásától. Pontosabban, a fémközpont elektronikus tulajdonságai diktálják a backbonding fontosságát a fém karbonil komplexekben. A legtöbb nyersen, több elektronban gazdag fém központok jobban backbonding CO. Miért fontos megállapítani a backbonding erejét?
az infravörös spektroszkópiát híresen alkalmazták a backbonding ötletének empirikus alátámasztására. Az alábbi táblázat néhány fém karbonil komplexet “periodikus” sorrendben rendez, és megadja a C=O nyújtási módnak megfelelő frekvenciát. Vegye figyelembe, hogy kivétel nélkül minden komplex CO nyújtási frekvenciája alacsonyabb, mint a szabad COÉ. A Backbonding a hibás! A komplex szén–monoxidban a C-O kötés sorrendje (szinte mindig) alacsonyabb, mint a szabad CO.

C = O nyújtási frekvenciák fém-karbonil komplexekben. Valami nem stimmel itt?
a fenti ábra a frekvencia egyértelmű növekedését (a C–O kötés sorrendjének növekedését) ábrázolja, amikor balról jobbra haladunk a periódusos rendszeren. Ez a megállapítás furcsának tűnhet, ha figyelembe vesszük, hogy a semleges fémben a D elektronok száma növekszik, amikor balról jobbra haladunk. Nem kellene-e a több d-elektronnal rendelkező fémközpontoknak jobban visszailleszkedniük (és “elektronban gazdagabbnak”lenniük)? Mi folyik itt? Emlékezzünk az orbitális energia időszakos tendenciájára. Ahogy balról jobbra haladunk, a d orbitális energiák csökkennek, és a DN és a főpályák energiái elválnak egymástól. Ennek eredményeként a backbonding orbitális kölcsönhatás rosszabbodik (ne feledje, hogy az erős orbitális kölcsönhatások jól illeszkedő orbitális energiákat igényelnek), ahogy az elektronegatívabb késői átmeneti fémek felé haladunk! Analógiát vonhatunk le a szerves kémiából származó enaminokkal és enol-éterekkel. Az enol-éterek elektronegatívabb oxigénatomja rosszabb elektrondonor, mint az enamin nitrogénatomja.

a backbonding fontossága a fém elektronegativitásától és elektronsűrűségétől függ.
természetesen a fémközépponton lévő más ligandumok backbondinghoz való hozzájárulását sem szabad elfelejteni. Logikusan az elektron-adományozó ligandumok általában erősebbé teszik a hátkötést (jobb elektrondonorrá teszik a fémet), míg az elektron-visszavonó ligandumok rontják a hátkötést. Elektronban gazdag foszfin ligandumok hozzáadása például egy fémközponthoz csökkenti a CO nyújtási frekvenciát a jobb backbonding miatt.
a karbonil ligandumok híresen képesek áthidalni több fémközpontot. Az áthidalt karbonil komplexekben a kötés lehet “hagyományos” vagy delokalizált, a komplex szerkezetétől és az áthidaló módtól függően. Az áthidaló módok sokfélesége a CO ligandumon jelen lévő különböző elektrondonorokból és akceptorokból (és a delokalizált kötés lehetőségéből) ered. Az ismert áthidalási módokat az alábbi ábra mutatja.
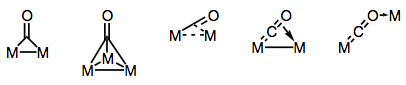
hidak építése karbonil ligandumokkal!