7.4: Complex III
Complex III elfogadja elektronok mind komplex I és komplex II. az elektronok érkezik formájában ubiquinol, UQH2, amely szállít két elektron és két proton és átalakul vissza ubiquinon, UQ. Az ubiquinon ezután visszatér az I. vagy II. komplexbe, hogy több elektront gyűjtsön.
- a III.komplex az I. és II. komplexből érkező elektronok rendeltetési helye.
- a Complex III a lefelé irányuló elektronátvitel során felszabaduló energiát használja fel, hogy több protont pumpáljon át a belső mitokondriális membránon.
- a membránon átívelő protongradienst az ATP képződésének vezetésére használják az V Komplexnél.
- a III komplex ezután elküldi elektronjait a IV komplexbe.
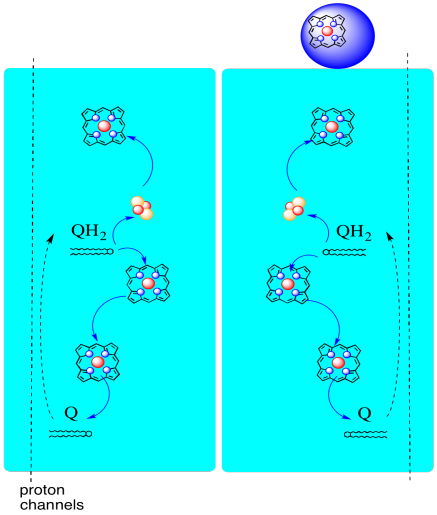
az elektronok útja a III komplexen keresztül az alábbiakban látható. Vegye figyelembe, hogy a komplex dimer szerkezet, két ekvivalens úttal: az egyik a bal oldalon, a másik a jobb oldalon látható. Az elektronokat az uqh2-ből, az ubiquinolból szállítják a kép közepén, felfelé haladva a tetején lévő mobil citokróm c-be. A második elektron útvonal lehetővé teszi az utazást lefelé a képen, egy másik molekula felé ubiquinon, amely újrahasznosítja az elektronokat egy hurokban.
- komplex III szokatlan, eltérő elektron utat tartalmaz.
- egy elektron továbbhalad a citokróm c felé.
- a második elektron végül egy másik ubiquinolba kerül.
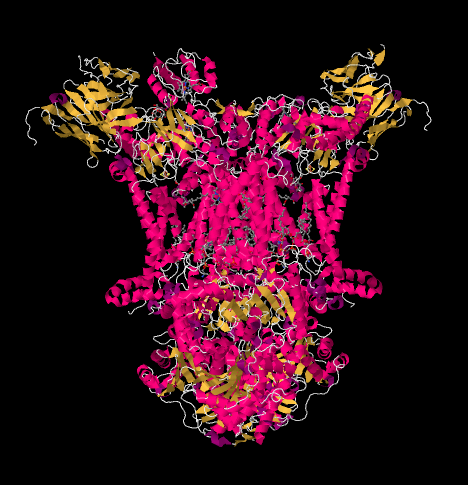
komplex Röntgenszerkezetét az alábbiakban rajzfilm formában mutatjuk be. A belső mitokondriális membrán metszi a komplex felső középső részét. Az alábbi komplex projektek többsége a mátrixba (a kép alja, ebben az orientációban), bár jelentős mennyiség is kinyúlik az intermembrán térbe.
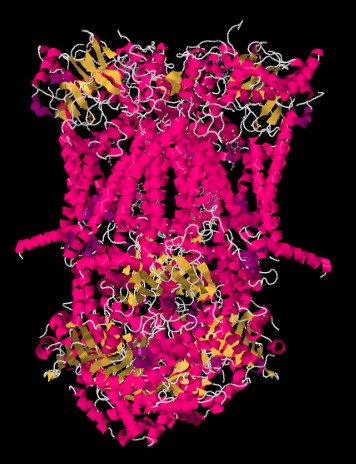
komplex III folytatja az elektrontranszport láncot, az elektronokat nagyobb redukciós potenciálra (és alacsonyabb szabad energiára) küldi, és a molekuláris oxigénnel való találkozás felé a IV komplexben. A protonokat a mitokondriális mátrixból is pumpálják, a belső mitokondriális membránon keresztül az intermembrán térbe. Ugyanabban az időben, egy második elektron út a komplexbe jutó elektronok felének hatékony újrahasznosítását eredményezi, növelve a III. komplexbe érkező elektrononként pumpált protonok számát.
- felvetődött, hogy az elektron-újrahasznosító hurok mechanizmust biztosít arra, hogy több protont húzzon fel a mátrixból.
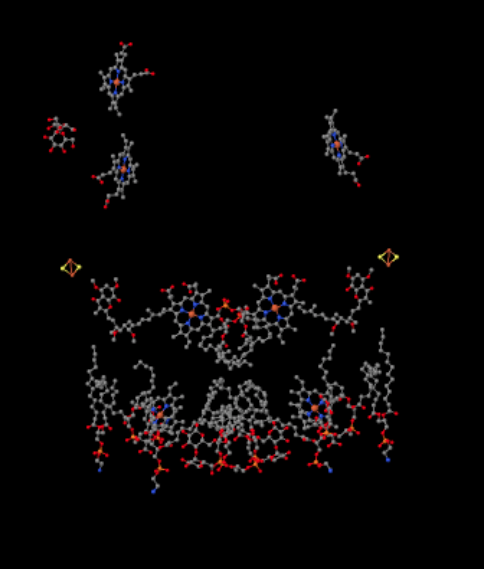
láthatjuk ezt a szokatlan elrendezést, ha figyelmen kívül hagyjuk a fehérjéket, hogy felfedjük a ligandumokat. A komplexum világosabban dimernek tekinthető; a kép bal fele pontosan ugyanaz, mint a jobb, bár ellentétes módon tükröződik. Az elektronok a mobil hordozón, az ubiquinolon keresztül jutnak be a komplexbe, amely a kép jobb és bal oldalán látható, körülbelül félúton; láthatja a gyűrűtés egy lánc lóg rajta.
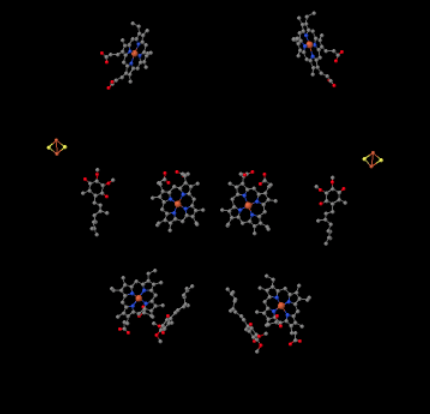
amikor az UQH2 a III.komplexhez kötődik, az egyik elektron egy FeS klaszterbe kerül, míg a második egy vas hem központba, az úgynevezett hem BL-be kerül. A Fes klaszter közvetlenül az ubiquinol felett és a kép szélén látható. A hem BL a kép közepe felé mutat.
bár a bemutatott röntgenképen nem látható, ez a FeS klaszter különbözik a korábban látottaktól. Ezt különböző aminosav oldalláncokkal tartják a helyükön. Ezt nem lehet látni a képen, mert az egész fehérje kimaradt, azokkal az aminosavakkal együtt, amelyek kötődnek a klaszterhez. Míg a legtöbb Fes-klasztert kizárólag ciszteinek tartják a helyükön, ezt a klasztert az egyik oldalon két ciszteiens, a másikon két hisztidine tartja a helyén. Ezt a sajátos Fes-klasztert Rieske-klaszternek hívják.
a Rieske-klaszterek azért fontosak, mert “nagy potenciállal rendelkező FeS-klaszterek”. Ez azt jelenti, hogy kivételesen pozitív redukciós potenciállal rendelkeznek a többi FeS klaszterhez képest. A fehérje bármely ligandumának redukciós potenciálja nagymértékben függ a környezetétől, ezért a legtöbb esetben az értékek széles skálája létezik. Ez igaz a vas kén klaszterekre; a normál redukciós potenciálok -1,0 V-tól körülbelül +0,05 V-ig terjednek.a Rieske-klaszterek potenciálja körülbelül 0V-tól körülbelül 0,4 V-ig terjed.
a FeS-klaszterből az elektron egy másik vas-hem-központba kerül egy membránhoz kötött egységben, az úgynevezett citokróm c1-ben. A citokróm c1 a kép tetején látható. Mivel ez a kép ugyanúgy orientálódik, mint a légzőkomplexum többi Röntgenszerkezete, láthatjuk, hogy ez az elektron felkerül az intermembrán tér felé. Végül ez az elektron átkerül egy másik hembe, de ez a hem egy kicsi, mobil fehérjéhez kötődik, az úgynevezett citokróm c. a citokróm c egy másik mobil elektronhordozó. Továbbviszi az elektront a komplex IV-be. kicsit később visszatérünk a citokróm c-be.
mielőtt rátérnénk, hová megy a másik elektron? A hem BL-től a második elektron átkerül egy másik vasporfirin komplexbe, a hem BH-ba. Ez a kép alja felé van, tehát ez az elektron valójában visszakerül a mátrix felé. Várakozás a hem BL mellett, azonban, van egy másik ubiquinon, UQ. Az elektronra vár. Valójában kettőre vár, majd elhagyja a dokkját, és visszatér az ubiquinol (UQH2) kötőhelyre, hogy újra leadja az elektronokat.
miért zavarja? Miért nem küldi el az elektronokat az első alkalommal? Úgy tűnik, valamilyen okból újrahasznosítják őket. Úgy gondolják, hogy ez az eltérítés lehetővé teszi további protonok pumpálását a mitokondriális membránon. Amikor a második ubiquinon két elektron elfogadásával ubiquinollá redukálódik, további két protont is felvesz az alábbi mátrixból. Ezek a protonok végül átjutnak az intermembrán tér felé, amikor az ubiquinol ismét oxidálódik. Ezt az újrahasznosítást és néhány extra proton kipréselését a protongradiens növelése érdekében Q huroknak nevezzük.
a Q-hurok előnye a következő ábrán látható. Az ábrán a III. komplex bemenetei pirossal, a kimenetek kékkel, az újrahasznosított elemek pedig zöld színnel jelennek meg. Ha egy ubiquinol egyszerűen leadja elektronjait és protonjait, és megtörténik, akkor ubiquinolonként két protont szállítanak. Ez egy proton kimenet elektrononként, ami bemenet volt.
egy második ubiquinol pontosan ugyanezt tenné. Négy proton kimenet lenne a kezdetben bemenő négy elektron számára. Ez még mindig egy proton kimenet elektrononként, ami bemenet volt.
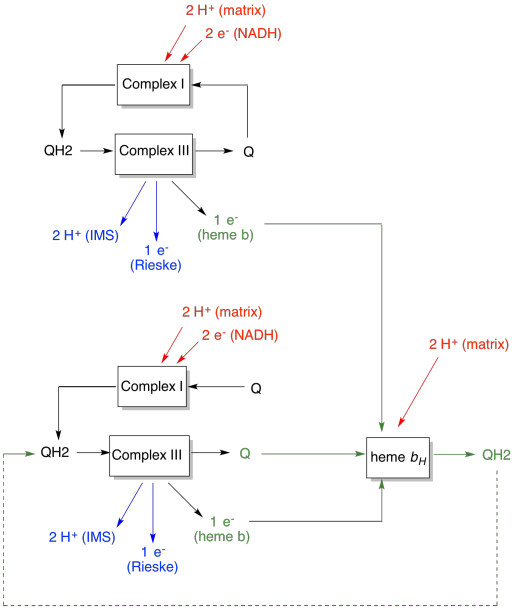
Ha ehelyett minden alkalommal egy elektront újrahasznosítanak, akkor minden második ubiquinol egy extra protonpár szállításához vezet. Ez azért van, mert az újrahasznosított elektronok felvételekor az ubiquinonnak vissza kellett utaznia a membrán mátrix oldalára, és fel kellett vennie még két protont. Összességében ez azt jelenti, hogy hat protont szállítanak négy elektron bemenetére, vagy 1,5 proton kimenetet elektronbemenetenként. Mivel a protongradiens generálja az ATP-t, akkor a bejövő elektrononként pumpált protonok számának növelésével a hatékonyság növekszik.
- a Q-hurok növeli a rendszerbe elektrononként pumpált protonok számát.
most térjünk vissza a kimenő elektronhordozóhoz, a citokróm c-hez, amely az elektronokat a komplex IV-be továbbítja. Az alábbi képen egy másik Röntgenkristályszerkezetből a komplexet ciklokróm c dokkolással találtuk meg a kötési helyen. A citokróm c egy rózsaszín gömb alakú fehérje, amely a kép tetején található, a dimer bal oldalán, ahogy itt nézzük. Az intermembrán tér szélén ül, ami vizes közeg. Ellentétben az ubiquinonnal, amely végigcsúszik a membrán lipid kettős rétegén, a citokróm c gördül, csúszik vagy úszik a tetején a rendeltetési helyére.
ugyanez a nézet az alábbiakban látható a fehérje nélkül. Az alsó része a kép elég zsúfolt lipidek, és van egy cukor lógott a bal felső, de jobb a legtetején láthatjuk a vas porfirin, amely fészkelt belül a citokróm c.
a ciklokróm C Röntgenszerkezetének közelebbi vizsgálata az alábbiakban viszonylag egyszerű képet mutat a vizsgált komplexekhez képest. Van egy pár hélix, egy pár lap, néhány hurok, és az a vas porfirin vagy hem újra. Néhány szulfátion lebeg a közelben, valamint néhány glicerin molekula, amelyek valószínűleg a fehérje tisztítása vagy kristályosítása során kerülnek be. Vegye figyelembe, hogy a hem a fehérje szélén található. Ez a hely megkönnyítheti az elektron átvitelét a III komplexből, vagy a IV komplexbe.
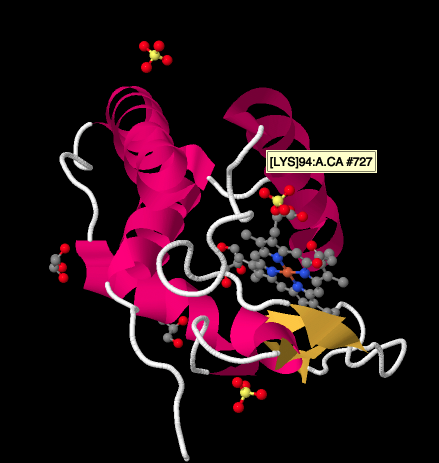
- a citokróm c a III komplexen áthaladó elektronok végső rendeltetési helye.
- a citokróm c mobil, egyelektronos hordozó.
- a citokróm c valójában egy kicsi, hidrofil fehérje.
- a citokróm c a mitokondriális membrán felett található, az intermembrán tér szélén.
mi tartja vissza a ciklokróm c-t attól, hogy az intermembrán térbe vándoroljon? Ha így tenne, megszakítaná az elektronok hatékony áramlását. Lehetséges, hogy a citokróm c oda-vissza mozog a III.és a IV. komplex között egy “kormányzásnak”nevezett mechanizmuson keresztül. Kormányzáskor a hordozót egy út mentén vezetik kiegészítő töltések útján. Például, ha a membrán negatív töltésű a membrán felületén lévő poláris csoportok miatt, akkor a citokróm C felületén lévő pozitív töltések korlátozhatják annak mozgását a membrán felületére. Ez önmagában csökkentené mobilitását három dimenzióból (bárhol az intermembrán térben) két dimenzióba (bárhol a membrán felületén). Lehetséges, hogy további kölcsönhatások még tovább csökkentik mobilitását a két komplex közötti egydimenziós pályára.
- a kiegészítő töltéseken alapuló kormányzás megakadályozza, hogy a citokróm c elveszjen az intermembrán térben.
gyakorlat \(\PageIndex{1}\)
javasoljon lehetséges aminosavmaradványokat a citokróm C felületén, amelyek segíthetnek a negatív töltésű membrán felületén maradni.
válasz
az arginin és a lizin pozitív töltésű semleges pH-n.
gyakorlat \(\PageIndex{2}\)
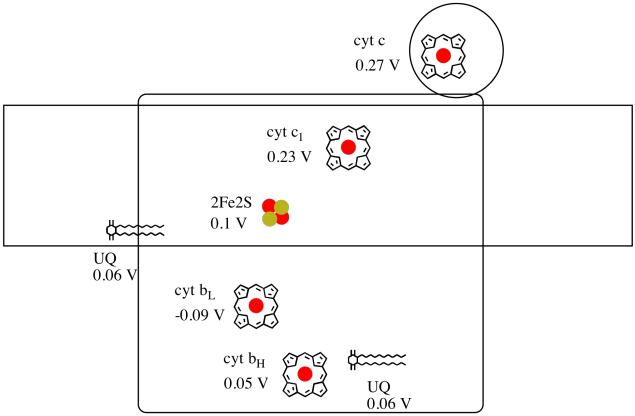
nehéz mérni az egyes helyek redukciós potenciálját egy fehérjén belül. A kutatók azonban képesek voltak megbecsülni ezeket az értékeket az EPR spektrumok különböző körülmények közötti mérésével. Feltételezve az alábbi redukciós potenciált, rajzoljon egy reakció előrehaladási diagramot egy elektron transzportjára egészen a kezdeti ubiquinon donortól egészen a citokróm c-ig.
 válasz
válasz
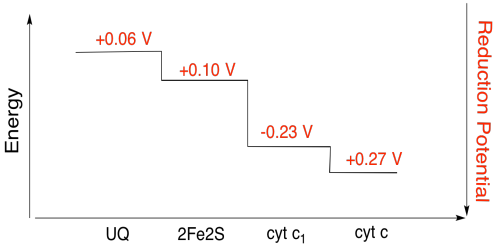
gyakorlat \(\PageIndex{3}\)
a fenti ábra értékeinek felhasználásával számítsa ki az energiaváltozást, amikor egy elektron átkerül a 2fe2s klaszterből a citokróm c1-be.
Válasz
Feltételezve, hogy a csökkentési potenciálok vannak:
2Fe2S(ox) + e- → 2Fe2S(piros) Eored = 0.10 V
cyt c1(ox) + e- → cyt c1(piros) Eored = 0.230 V
Akkor a potenciális különbség a reakció, ΔEo = 0.23 – (0.10) V = 0.13 V.
A Faraday kapcsolatban ΔG = – n F ΔEo ad
ΔG = – 1 x 96,485 J a V-1 mol-1 x 0.13 V = 12,543 J mol-1 = 12.5 kJ mol-1
gyakorlat \(\PageIndex{4}\)
az egyik zavaró dolog ebben a komplexumban az, hogy az elektron újrahasznosítási hurokban az elektrontranszfer úgy tűnik, hogy a kezdeti ubiquinonról a végső ubiquinonra megy, általános hajtóerő nélkül. A redukciós potenciálok azonban nagyon érzékenyek a környezetre. Mutassa meg, hogy a közeli argininmaradványok hogyan tehetik pozitívabbá az ubiquinon redukciós potenciálját.
válasz
a pozitív argininmaradékok hidrogénkötés útján részleges pozitív töltést biztosítanának az ubiquinon számára; ennek eredményeként az ubiquinon pozitívabb redukciós potenciállal rendelkezik.
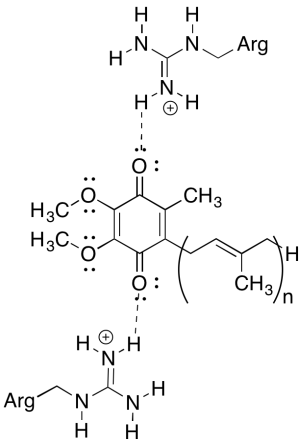
lásd a fókusz oldalt a komplex III felépítéséről a Biochemistry Online oldalon.
X – ray kristály szerkezete komplex III származó: Gao, X., Wen, X., Esser, L., Quinn, B., Yu, L., Yu, C.-A., Xia, D. szerkezeti alapja a kinon redukció a BC1 komplex: összehasonlító elemzése kristályszerkezetek mitokondriális citokróm bc1 kötött szubsztrát és inhibitorok a Qi helyén. Biokémia 2003, 4, 9067-9080. (1NTZ)
a III.komplex röntgenkristályszerkezete kötött citokróm c-vel: Solmaz, Sr, Hunte, C. A III. komplex szerkezete kötött citokróm c-vel csökkentett állapotban és az elektrontranszfer minimális maginterfészének meghatározása. J. Biol. Kémia. 2008, 283, 17542-17549. (3CXH)
a citokróm c röntgensugaras kristályszerkezete: Enguita, F. J., Pohl, E., Turner, D. L., Santos, H., Carrondo, M. A. A protontranszfer útvonal szerkezeti bizonyítéka a citokróm C hem redukciójával párosulva” Methylophilus methylotrophus. J. Biol. Inorgot. Kémia. 2006 11, 189. (1OAE)
forrás
Chris P Schaller, Ph. D., (Szent Benedek Főiskola / Szent János Egyetem)