Citrát antikoaguláció a CRRT alatt akut vesekárosodás esetén
- akut vesekárosodás
- az AKI – vesepótló terápiák kezelése
- hemodialízis, hemofiltráció és hemodiafiltráció
- az RRT megkezdése és időzítése aki – intermittáló versus folyamatos RRT esetén
- antikoaguláció folyamatos vesepótló terápia (CRRT) alatt
- citrát – antikoaguláns hatásának mechanizmusa és CRRT-ben való alkalmazása
- potenciális anyagcserezavarok citrát-antikoaguláns CRRT alatt
- citrát-antikoaguláns CRRT-t kapó betegek biokémiai monitorozása
akut vesekárosodás
akut vesekárosodás (AKI), számos lehetséges okú klinikai szindróma, egyszerűen a vesefunkció hirtelen csökkenése órák vagy napok alatt, amelyet a szérum kreatinin-koncentráció közelmúltbeli növekedése és/vagy a vizeletmennyiség csökkenése bizonyít .
különbözik a krónikus vesebetegségtől (CKD), amelyben a vesefunkció csökkenése lassan, de visszafordíthatatlanul progresszív, hónapok és évek alatt következik be. AKI természetesen előfordulhat a mögöttes CKD-ben szenvedőknél, és az AKI diagnózisa a CKD esetleges diagnózisának normálnál nagyobb kockázatával jár .
nemzetközileg elfogadott irányelvek szerint az AKI diagnosztizálható, ha:
• a szérum kreatinin 0,3 mg/dL-rel (26,5 km/L) emelkedik 48 órán belül; vagy
• a szérum kreatinin 50% – kal vagy annál nagyobb mértékben emelkedett az elmúlt 7 napban; vagy
• a vizelet térfogata
AKI magában foglalja a vesefunkció enyhe csökkenéséből eredő súlyosság teljes spektrumát (1.szakasz AKI) veseelégtelenség (3. szakasz aki). A stádium a szérum kreatinin mérésétől függ, vizeletkiviteli adatokkal vagy anélkül (I. táblázat)
|
Színpad |
szérum kreatinin |
vizelet kimenet |
|
1 |
1.5-1.9 kiindulási érték |
6-12 órán keresztül |
|
2 |
2.0-2.A kiindulási érték 9-szerese |
⩾ 12 órák |
|
3 |
3.0 kiindulási érték |
24 óra esetén |
I. táblázat: az AKI súlyosságának három szakasza (ref 1)
az AKI okait hagyományosan három címsorba sorolják: prerenális; vese (belső); és posztrenális, hangsúlyozva azt a tényt, hogy AKI specifikus vese etiológiával rendelkezik, de a vesén kívüli elsődleges problémából is származhat.
bármely olyan állapot, amely csökkenti a vese véráramlását (vese perfúzió), a prerenális AKI lehetséges oka; ezek a feltételek a következők: hányás, hasmenés, vérzés, égési sérülések vagy szeptikus sokk okozta hypovolemia; és csökkent szívteljesítmény például szívelégtelenség és májelégtelenség (cirrhosis) miatt. A belső AKI fő oka a vese tubuláris nekrózisa, amely vese ischaemia vagy nephrotoxikus gyógyszerek/toxinok lenyelése következtében alakul ki.
a szepszis, az aki leggyakoribb oka a kritikus betegeknél, részben a vese tubuláris nekrózisához hasonló rosszul meghatározott belső vesekárosodásnak köszönhető . Végül, a posztrenális AKI minden olyan állapotból származik, amely akadályozza a vizelet áramlását a vese felé; ezek közé tartozik: vesekő (kalkulus); prosztata betegség (tumor/hipertrófia); húgyhólyag diszfunkció; és húgycső szűkület.
az AKI – vesepótló terápiák kezelése
az AKI-ra nincs specifikus kezelés, és a kezelés nagyrészt támogató, a kiváltó okra irányuló kezeléssel. A nefrotoxikus gyógyszerek megvonása, a folyadék újraélesztése, valamint az elektrolit-és sav-bázis zavarok korrekciója mind része ennek az általános támogató kezelésnek . Szükség lehet vazopresszor vagy inotrop gyógyszerek beadására a normál vérnyomás és a szívteljesítmény helyreállításához.
a cikk középpontjában álló vesepótló terápia (RRT) a súlyos AKI-ban szenvedő betegek végső kezelését jelenti, amely nem reagál a konzervatív támogató kezelésre. Az AKI-ban szenvedő ICU-betegek körülbelül 23% – A (azaz az összes ICU-beteg körülbelül 13% – a) KAP RRT-t .
a vesepótló terápia (RRT) a vesefunkció helyettesítésére irányuló összes kezelés általános kifejezése. A donor vese transzplantációja a végstádiumú vesebetegségben szenvedőknek tekinthető a végső RRT – nek, de a kifejezés gyakrabban azoknak a terápiáknak van fenntartva, amelyek a vese vérszűrését és homeosztatikus funkcióit dialízissel helyettesítik, egy olyan folyamat, amely félig áteresztő membránt használ vérszűrőként. A dialitikus RRT két széles típusa áll rendelkezésre az AKI (és ami a CKD végstádiumát illeti) kezelésére: peritoneális dialízis és hemodialízis.
ezzel szemben a hemodialízis magában foglalja a vér szűrését a testen kívüli gépben (testen kívüli). A vért a szűrőbe/dializátorba pumpálják, ahol a salakanyagokat és a felesleges folyadékot eltávolítják, majd visszajuttatják a testbe. Ez az extrakorporális áramkör (a dialízis gép és annak összekötő csövei a beteghez és vissza) prokoaguláns környezet.
hemodialízis, hemofiltráció és hemodiafiltráció
a Modern dialízis gépeknek lehetőségük van a hemofiltrációra (HF) és a hemodialízisre (HD), lehetővé téve három különböző dialitikus módszer lehetőségét az AKI kezelésére: hemodialízis (HD); hemofiltráció (HF); és hemodiafiltráció (HDF).
mindhárom modalitás középpontjában a félig áteresztő membrán található, amely vérszűrőt képez. Ahogy a betegből szivattyúzott vér folyik a membrán egyik oldalán, a felesleges víz és az oldott hulladékok áthaladnak a membránon. A szűrletet vagy a szennyvizet hulladékba pumpálják, amikor a szűrt vért visszajuttatják a betegbe.
a hemodialízis (HD) folyamata olyan dialízis folyadék használatát foglalja magában, amely folyamatosan áramlik a vér ellenáramával a membrán másik oldalán. A dialízis folyadék összetétele és áramlási sebessége állandó koncentrációs gradienst biztosít a félig áteresztő membránon az oldott véranyagokhoz képest. Ezek a koncentrációgradiensek viszont megkönnyítik az oldott molekulák szabályozott diffúzióját a membránon.
olyan oldott anyagok esetében, mint a karbamid és a kreatinin, amelyeket el kell távolítani a vérből, a koncentrációgradiens olyan, hogy a diffúzió iránya a vérből a dialízis folyadékba kerül, míg az oldott anyagok, például a bikarbonát esetében, amelyeket gyakran hozzá kell adni a vérhez a súlyos AKI-val járó acidózis kijavításához, a vérhez viszonyított magas bikarbonát-koncentrációjú dialízis folyadék biztosítja, hogy a diffúzió ellentétes irányban legyen, a dialízis folyadéktól a vérig. A dialízis folyadék összetételének és áramlási sebességének beállítása így lehetővé teszi a betegspecifikus metabolikus korrekciót.
a Folyadékfelesleg gyakran az AKI jellemzője, amelyet a hemodialízis során korrigálnak. Ezt ultraszűréssel érik el, amely a félig áteresztő membránon átívelő hidrosztatikus nyomásgradienstől függ. A membrán véroldalán lévő relatív pozitív hidrosztatikus nyomás hatékonyan “tolja” a vizet a vérből a dialízis folyadékba.
ez az ultraszűrés megkönnyíti az oldott anyagmolekulák átjutását is, amelyeket az ultraszűrés során vízzel együtt az oldott anyag konvekciójának (vagy oldószerhúzásának) nevezett mechanizmus húz. Az oldott anyag diffúziójának, az oldott anyag konvekciójának és az ultraszűrésnek a kombinált hatása a hemodialízis során annak biztosítására irányul, hogy a folyadék térfogata és összetétele mind az extracelluláris, mind az intracelluláris rekeszben a lehető legközelebb álljon ahhoz, ami a normálisan működő vesékkel rendelkezők körében érvényes.
a Hemodiafiltráció (HDF) a HF és a HD kombinációja. Lehetővé teszi a kis molekulatömegű oldott anyagok optimális clearance-ét a dializáló folyadékba történő diffúzióval, kombinálva a nagy molekulatömegű oldott anyagok optimális clearance-ével konvekcióval és ultraszűréssel. A HF – hez hasonlóan a HDF folyamatos pótló folyadékot igényel; a HD-hez hasonlóan a HDF dialízis folyadékot igényel.
az RRT megkezdése és időzítése aki – intermittáló versus folyamatos RRT esetén
minden vesepótló kezelés (PD, HD, HF és HDF) szakaszosan (azaz jellemzően 3-4 órás munkamenetben) vagy folyamatosan, amíg a vesefunkció helyre nem áll. A végstádiumú veseelégtelenségben szenvedő betegeknél, akik élethosszig tartó (krónikus) RRT-t igényelnek, a kezelés kizárólag időszakos hemodialízis (IHD), szinte mindig négy óránként, hetente háromszor .
az AKI-ban szenvedő betegeknek csak ideiglenesen van szükségük az RRT-re a vesefunkció támogatására az AKI-t kiváltó kritikus/akut betegség megoldása során. Az AKI-ban szenvedő betegek körében az RRT átlagos időtartama körülbelül 13 nap , bár bizonyos esetekben csak néhány napig lehet szükség, vagy több hétig meghosszabbítható.
a hagyományos (abszolút) indikátorok az RRT megkezdésére AKI-ban a következők:
• hiperkalémia (plazma kálium > 6,0-6,5 mmol/L)
• súlyos urémia (plazma karbamid > 30 mmol/L)
• urémiás encephalopathia jelei
• acidózis (pH • akut tüdőödéma
előnyös lehet a kezelés megkezdése előtt, mielőtt az AKI ezen szélsőséges hatásai nyilvánvalóak lennének, az RRT elindításának (és leállításának) optimális időzítése azonban jelenleg nem egyértelmű, és folyamatban lévő kutatások tárgyát képezi . Jelenleg nem állnak rendelkezésre megbízható adatok egy adott típusú RRT alátámasztására az AKI számára, következésképpen minden típusú RRT-t alkalmaztak.
a jelenlegi irányelvek azonban azt a konszenzust tükrözik , hogy a modalitástól függetlenül az RRT-t folyamatosan kell szállítani, nem pedig szakaszosan a legkritikusabban beteg (hemodinamikailag instabil) betegek. A legújabb felmérések azt mutatják, hogy manapság a folyamatos vesepótló terápiákat (CRRTs) sokkal gyakrabban alkalmazzák, mint az aki időszakos terápiáit, és hogy a leggyakrabban használt CRRT a folyamatos vénás vénás hemofiltráció (CVVHF), amelyet folyamatos vénás vénás hemodiafiltráció (CVVHDF) követ.
antikoaguláció folyamatos vesepótló terápia (CRRT) alatt
a CRRT, az összes többi vesepótló terápiával együtt, kivéve a peritoneális dialízist, magában foglalja a vér pumpálását egy nem fiziológiás, testen kívüli áramkörön keresztül. A vér velejáró tulajdonsága, hogy koaguláljon (alvadjon) nemfiziológiai felületekkel érintkezve meghatározza, hogy a “vérrögmentes” beteg testen kívüli körének fenntartása érdekében a vért antikoagulálni kell.
a CRRT-nek különösen szüksége van antikoagulációra, összehasonlítva az időszakos módozatokkal, a hosszan tartó kezelési ülések és a viszonylag lassú sebesség miatt, amellyel a vért pumpálják az áramkörön keresztül . Ezenkívül a CRRT-t igénylő betegek vére gyakran már relatív prokoaguláns állapotban van a mögöttes kritikus betegség (például szepszis) vagy trauma miatt .
sok éven át a heparin, akár frakcionálatlan heparin (UF), akár alacsony molekulatömegű heparin (LMWH) volt az egyetlen antikoaguláns, amelyet dialízises eljárásokban alkalmaztak, beleértve a CRRT-t is. A heparint továbbra is használják; olcsó és általában biztonságos antikoaguláns az RRT-t igénylő betegek többsége számára.
azonban a szisztémás heparin antikoaguláció, amelyet nem lehet elkerülni, elkerülhetetlenül magában hordozza a vérzés fokozott kockázatát, így a heparin antikoaguláció dialitikus eljárások során abszolút ellenjavallt azok számára, akik jelenleg vérzik, vagy a normálnál nagyobb a vérzés kockázata.
ezenkívül a heparin kis részben (
a heparin használatával kapcsolatos lehetséges vérzés és HIT-II kockázatok rávilágítottak arra, hogy alternatív antikoagulánsra van szükség néhány RRT-t igénylő betegnél. A citrát ilyen alternatívát nyújtott. A dialízis kör regionális citrát antikoagulációja , amelyet először sikeresen alkalmaztak az 1980-as évek elején, eredetileg a betegek azon kis hányada számára volt fenntartva, akik számára a heparin ellenjavallt. Ez megváltozott a heparin-antikoagulált CRRT-t citráttal antikoagulált CRRT-vel összehasonlító randomizált, kontrollált vizsgálatok eredményeivel; ezek kimutatták, hogy a citrát mind hatékonyabb, mind biztonságosabb antikoaguláns, mint a heparin .
a citrát következésképpen az elmúlt években megjelent antikoagulánsként minden aki számára crrt-t igénylő beteg. Az intenzív osztályok szerte a világon arról számolnak be, hogy a heparinról a regionális citrát antikoagulációra váltanak a CRRT-re . Egyes hatóságok még a citrát alkalmazását is javasolják heparin antikoaguláció helyett intermittáló (krónikus) hemodialízis (IHD) esetén.
citrát – antikoaguláns hatásának mechanizmusa és CRRT-ben való alkalmazása
a citrát, amelyet a transzfúzió céljából adományozott vér antikoagulálására/megőrzésére használnak több mint egy évszázada , megakadályozza a vér alvadását a vérplazmában keringő ionizált kalcium (ICA) megkötésére (kelát). Ez az iCa szükséges kofaktor mind a thrombocyta aggregációhoz, mind az intrinsic és extrinsic koagulációs utak számos kulcsfontosságú lépéséhez, amelyek felelősek a fibrin termeléséért, és ezáltal a fibrin vérrögképződéséért.
a véralvadást a plazma iCa-koncentrációjának 0, 35 mmol/L-re történő csökkentésével lehet megelőzni (normál ref tartomány: 1, 15-1, 30 mmol/L). Ezt a nem fiziológiás, súlyosan hipokalcémiás állapotot úgy érik el, hogy a plazma citrát koncentrációját körülbelül 3 mmol/L-re emelik (normál plazma citrát koncentráció ~0,1 mmol/L ).
bár vannak különbségek részletesen felvázolta Morabito et al, a citrát antikoaguláció minden protokollja a CRRT során magában foglalja a citráttartalmú oldat (általában trinátrium-citrát vagy sav-citrát-dextróz (ACD) oldat) folyamatos infúzióját az előszűrő / dialízis vonalhoz, közel ahhoz a helyhez, ahol elhagyja a beteget, akár külön oldatként, akár predilúciós helyettesítő folyadékkal kombinálva. Ennek az infúziónak az áramlási sebességét úgy állítjuk be, hogy a vér citrátkoncentrációja ~3 mmol/L, ezáltal a plazma ICA körülbelül 0,35 mmol/l legyen.
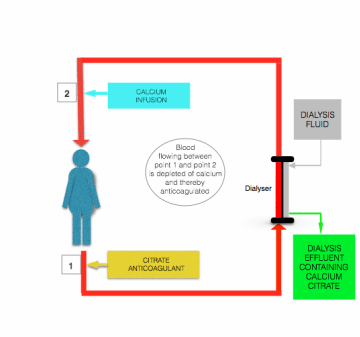
a citrát infúzió által kiváltott hipokalcémiát korrigálják, mielőtt a vér visszatérne a betegbe, kalciumtartalmú oldat (kalcium-klorid vagy kalcium-glükonát) infúziójával a posztszűrő vonalba, közel ahhoz a helyhez, ahol belép a betegbe (lásd a fenti ábrát).
a citrát antikoaguláció fő biztonsági előnye a heparinnal szemben antikoaguláció az, hogy az antikoaguláció az extrakorporális áramkörre korlátozódik. Ezt az úgynevezett “regionális antikoagulációt” azért érik el, mert az infúzióban lévő citrát nagy részét eltávolítják (akár citrát anionok, akár kalcium-citrát kelát formájában) a vérből a szűrőn/dializátoron való áthaladás során .
a posztszűrő vérben megmaradt citrát a szisztémás keringésben hígul, és az oxigénfüggő Krebs-ciklus révén gyorsan szén-dioxiddá és vízzé metabolizálódik a szöveti sejtek (elsősorban a májsejtek) mitokondriumában.
a citrát metabolizmusa a bikarbonát termelésével jár: minden metabolizált 1 mmol citrát esetében 3 mmol bikarbonát keletkezik. A citrát gyors clearance-e (a citrát felezési ideje a vérben általában körülbelül 5 perc ) ezen, elsősorban hepatikus úton általában biztosítja a szisztémás antikoaguláció hiányát a CRRT alatt, és ezáltal nincs további vérzésveszély.
potenciális anyagcserezavarok citrát-antikoaguláns CRRT alatt
a citrát-antikoaguláns CRRT teljes körű alkalmazásához való látszólagos vonakodás minden AKI-beteg esetében a közelmúltig a kezelést kapó betegeknél előforduló sav-bázis és elektrolit zavarokkal kapcsolatos aggályoknak tulajdonítható .
a következő elektrolit-és sav-bázis zavarokról számoltak be citrát antikoaguláns CRRT-t kapó betegeknél :
• hypocalcaemia/hypercalcaemia
• hypomagnesia/hypermagnesia
• hyponatremia/hypernatremia
• metabolikus alkalosis
* metabolikus acidosis
ezek a zavarok számos okból felmerülhetnek, de a citrát felhalmozódása a perifériás keringésben (citrát toxicitás) központi szerepet játszhat a legtöbb ilyen zavarban. Az okok, amelyek miatt a citrát felhalmozódhat a CRRT során, a következők:
• a membrán áteresztőképességének fokozatos csökkenése dialízis során, aminek következtében csökkent a citrát szűrése és ezzel egyidejűleg a citrát szisztémás keringésbe jutásának növekedése
• működési hiba – a testen kívüli körbe történő citrát infúzió véletlen megnövekedett sebessége és a citrát szisztémás keringésbe jutásának egyidejű növekedése
• vérkészítmény transzfúzió – a vértermékekben jelen lévő citrát tartósítószer növeli a crrt-ből eredő szisztémás keringésben a citrátterhelést 5501>az októl függetlenül, a citrát felhalmozódása a perifériás keringésben a keringő ionizált kalcium citrát kelátképződését eredményezheti, ennek következtében csökken a plazma ionizált kalciumkoncentrációja (hipokalcémia). Ha kellően súlyos hypocalcaemia okozhat szívritmuszavar, végül, szívmegállás .
bár a plazma ionizált kalcium csökken a citrát felhalmozódása (toxicitás) során, az összes kalcium növekszik (hiperkalcémiára utal), mivel a citráthoz kötött kalcium benne van a mért összes kalciumban. A teljes és az ionizált kalcium arányának növekedése (általában 2,0) > 2-re.Az 1-et a citrát toxicitásának legmegbízhatóbb jelének találták rutinszerűen rendelkezésre álló plazma-citrát becslés hiányában .
a citrát antikoagulációval járó megnövekedett plazma nátrium (hipernatremia) kockázata a CRRT-ben alkalmazott egyes citrátoldatok magas nátriumtartalmának (hipertonicitásának) köszönhető. Például a trinátrium-citrát 4% – os oldata, amelyet egyes protokollokban használnak, nátriumot tartalmaz 420 mmol/l koncentrációban .
a hypomagnesia (csökkent szérum magnézium) kockázata a citrát antikoaguláció során azt a tényt tükrözi, hogy a kalciummal együtt a magnézium kétértékű ion, amely a (kelát) citráthoz is kötődhet. Ha a citrát kelátképző hatása miatti magnéziumveszteségeket a dialízis/pótló folyadékok magnéziuma nem kompenzálja teljes mértékben, hypomagnesia léphet fel .
citrát-antikoaguláns CRRT-t kapó betegek biokémiai monitorozása
az intenzív osztályon elhelyezett vérgáz-analizátor segítségével végzett Point-of-care vizsgálat lehetővé teszi a legtöbb paraméter (ionizált kalcium, pH, bikarbonát, bázisfelesleg, nátrium és Laktát) gyors és kényelmes mérését, de a szérum összes kalcium és magnézium becslése általában nem áll rendelkezésre ezeken a platformokon, és a mintákat a laboratóriumba kell küldeni ezekre a mérésekre.
két újabb tanulmány bizonyítja, hogy egyes vérgáz-analizátorok nem megbízhatóak az ionizált kalcium mérésében a rendkívül alacsony, nem fiziológiai koncentrációkban (~0.3 mmol/L) jelen van a posztszűrő vérben, bár nem kétséges, hogy képesek-e pontosan mérni a plazma ionizált kalciumot a szisztémás keringésben (ahol a koncentráció sokkal magasabb).
|
mért paraméter |
megfigyelési intervallum |
célértékek vagy kb. referencia tartományok |
a mérés célja |
korrekciós intézkedés, ha a célon kívül esik |
|
Postfilter ionizált kalcium (iCa) koncentráció, azaz a postfilter portból vett vér. |
a citrát adagjának változtatását követő 1 órán belül, majd 4-6 óránként |
0.25-0.35 mmol / L |
|
a citrát adagjának módosítása: növelje, ha az iCa > 0, 35, csökkentse, ha az iCa |
|
szisztémás ionizált kalcium (Ica), azaz a betegtől vett vér |
alapvonal (indítás előtt), majd 1 órával az Indítás után, majd legalább 4-6 óránként |
1.15-1.30 mmol / L |
|
a kalcium infúziós sebességének beállítása; ICA esetén növelni kell 1.30 |
|
szisztémás összkalcium (TotCa), azaz. betegből vett vér (TotCa = ICA + albuminhoz kötött kalcium + citráthoz kötött kalcium) |
legalább 12-24 óránként (egyidejűleg kell lennie a szisztémás ionizált kalcium becslésével) |
csak a totCa:ICA arány meghatározásához szükséges (lásd alább) |
||
|
az összes ionizált kalcium aránya (TotCa:iCa) |
legalább 12-24 óránként |
a citrát felhalmozódásának/toxicitásának kimutatására, amelyet néha “citrátzárnak ” neveznek” |
az Opciók a következők:
|
|
|
artériás vérgáz analízis
|
alapvonal (indítás előtt). a kezdéstől számított 1 órán belül, majd legalább 4-6 óránként. |
pH 7,35-7,45 bicarb 23-28 mmol/L BE–2-+3 mmol / L |
sav-bázis zavarok kimutatására: metabolikus alkalózis metabolikus acidózis |
a metabolikus alkalózis esetén a lehetőségek a következők:
|
|
szérum nátrium |
naponta egyszer |
135-145 mmol / L |
a hypernatremia/hyponatremia kimutatására |
ritka előfordulás-ellenőrizze a helyes dialízist/helyettesítő folyadékot |
|
szérum laktát |
kiindulási (indítás előtt), majd a klinikai igények szerint |
a citrátmérgezés kockázatának kitett személyek azonosítása |
fontolja meg a TotCa: iCa arány mellett a citrát toxicitás kockázatát |
|
|
szérum magnézium |
legalább naponta egyszer |
a hypomagnesia kimutatására |
korrekció magnézium infúzióval |
táblázat: biokémiai monitorozás citrát-antikoagulált CRRT alatt (Ref 24)