Dr. Chittaranjan Das
laboratóriumunk fő célja a deubiquitináló enzimek (deubiquitinázok vagy DUBs) funkcionális szerepének megértése a sejtutakban, különösen azokban, amelyek a neurodegenerációban (a neuronok fokozatos elvesztése), például az Alzheimer-kór (AD) és a Parkinson-kór (PD) szerepet játszanak. A biológiai folyamatok széles skáláját szabályozza a fehérjék reverzibilis, poszttranszlációs módosítása az ubiquitin kovalens kötődésével, egy erősen konzervált 76-maradék eukarióta polipeptid. Az ubiquitináció úgy tekinthető, mint egy jelző kaszkád kezdő eseménye (ubiquitin jelzés), amelyet végül az ubiquitin címke hidrolitikus eltávolításával fejeznek be. Az emberi genom felmérése körülbelül 90 Dub jelenlétét tárja fel, ami arra utal, hogy sokféle biokémiai úton vesznek részt. A DUBs tanulmányozásának megközelítése számos olyan eszköz együttes alkalmazásán alapul, amelyek magukban foglalják a kis molekulájú próbák kémiai szintézisét, a Röntgenkristályográfiát és a tömegspektrometrián alapuló proteomikát.
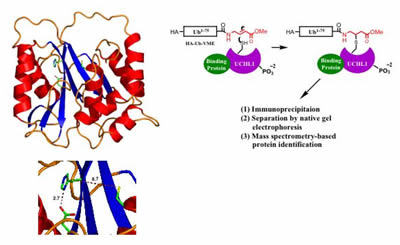
az Uchl1 Röntgenkristályográfiával meghatározott szerkezete azt sugallja, hogy az enzim két állapotot fogadhat el, egy inaktív állapotot (amelyben a katalitikus maradékok rosszul vannak beállítva, a bal oldalon látható) és egy feltételezett aktív állapotot – amelyben a maradékokat a fehérje ismeretlen kofaktorokkal való kölcsönhatása hozza összhangba. Javasolt módszer az UCHL1 kofaktorainak azonosítására egészsejtes kivonatokból történő aktivitásalapú tisztítással (jobbra).
jelenleg a neuronális DUB ubiquitin C-terminális hidroláz L1 (UCHL1) normális működését vizsgáljuk – egy PD-vel társult,idegsejt-specifikus fehérje ismeretlen fiziológiai funkció. Az ebbe az irányba tett erőfeszítéseink célja az UCHL1 sejtáteresztő kis molekulájú inhibitorainak kifejlesztése, amelyek felhasználhatók a funkciójának (mind a normál, mind a betegséggel összefüggő) vizsgálatára, kötő partnereinek meghatározása affinitás alapú tisztítással egészsejtes kivonatokból, valamint annak molekuláris alapjának meghatározása, hogy ennek az enzimnek a természetben előforduló változata-amelyben a 18.pozícióban lévő Ser-t Tyr helyettesíti (az úgynevezett S18Y polimorf)-védelmet nyújt a Parkinson – kór (PD) ellen. Az UCHL1 mellett más kapcsolódó enzimek szerkezeti és mechanisztikus vizsgálatát is végezzük, amelyekről úgy gondolják, hogy részt vesznek az alapvető biokémiai folyamatokban, mint például a DNS-javítás, a hiszton módosítása és a plazmamembrán fehérjék endocitózisa.
Oktatás
- Ph. D., Indiai Tudományos Intézet, 2001
- posztdoktori munkatárs, Harvard Medical School és Brandeis Egyetem, 2006
elismerések
- Senior Research Fellowship, University Grants Commission, India , 1996
kiadványok
publikációk listája