határok a neurológiában
Bevezetés
a Neuroacanthocytosis a ritka szindrómák csoportjának kiemelt kifejezése, amelyeket neurológiai tünetek jellemeznek tüskés deformált vörösvértestekkel kombinálva (acanthocyták). Ez a jelentés a Chorea-acanthocytosisra (ChAc) összpontosít , amely egy árva betegség, amelynek becslések szerint 1000 érintett egyén világszerte autoszomális-recesszív mutációk által okozott a vps13a (vacuolar protein válogatás 13 homolog a) gén a 9q kromoszómán (1). A betegség progresszív lefolyású, a megnövekedett halálozás okai lehetnek csökkent motoros funkciók, amelyek korrelálnak a kockázati állapotokkal, például a dysphagia, de hirtelen váratlan haláleseteket is leírtak (2, 3). Eddig nincs okozati kezelés.
az acanthocytosis és a mozgászavarok gyanús együttélését először az 1970-es években jelentették Levine és Critchley (4, 5), és azóta elfogadták a betegség kiemelkedő jellemzőjeként. Esettanulmányunkkal azonban a Chac ritka klinikai fenotípusát írjuk le, amelyből hiányzik a nyilvánvaló mozgási rendellenességek, ami a klinikai bemutatók szélesebb változatosságára utal. A diagnosztikai eszközöknek meg kell felelniük ezeknek a kihívásoknak a helyes diagnózis megállapításához, itt a molekuláris neuroimaging-et javasoljuk kulcsfontosságú módszerként.
esettanulmány
a férfi indexű beteg először 25 éves korában jelentkezett két nem provokált bilaterális tónusos klónusos görcsrohammal. Nem volt kórtörténete. Az agyi MRI vizsgálat és az EEG ebben a korban normális volt, és a beteg vonakodása és ritka eseményei miatt nem kezdték meg a kezelést. A betegnek azonban folyamatos rohamai voltak, amelyek most részleges epilepsziaként jelentkeztek. Leírta a hirtelen szédülés visszatérő érzéseit, amelyeket vertiginous auraként diagnosztizáltak. Ezenkívül diszkognitív rohamai voltak, amelyekben vagy (a) nem reagált és török imákat mondott, (b) szóbeli automatizmusokat, vagy (c) a kezekkel babrált és hangokat adott ki—mindez részben tónusos klónusos rohamokká fejlődött. A Video-EEG most helyi tüske-hullám komplexeket mutatott mind a jobb, mind a bal temporális lebenyben. A roham szemiológiájának megfelelően a bilaterális temporális lebeny epilepszia diagnózisát és a levetiracetámmal történő gyógyszeres kezelést megkezdték.
31 éves korában a rohamok nem voltak teljesen elnyomva, a temporális lebeny epilepszia további diagnosztikájának részeként a beteg FDG-PET-N esett át (1.ábra), amely kétoldalú meziotemporális hipometabolizmust mutatott, összhangban a meziotemporális roham eredetével. Volt azonban egy markáns, rendkívül szokatlan striatális hipometabolizmus is, amely felvetette a neurodegeneratív mozgászavar gyanúját. Ennek következtében kiterjedt nyomon követési értékelés indult (lásd: 2.ábra). FP-CIT-SPECT-et végeztünk, amely a striatális dopamin transzporter elérhetőségének mérsékelten kétoldalú elvesztését eredményezte, összhangban a nigrostriatális integritás csökkenésével (1.ábra). A nagy felbontású MRI most bemutatta a nucleus caudatus kétoldalú atrófiáját (3.ábra). A neurológiai vizsgálat diszkrét kötött járási mintázatot és hypomimiát mutatott, de az extrapiramidális motoros rendszer más vonzalmát nem mutatta, és nem voltak olyan bulbáris tünetek, mint a táplálkozási dystonia. Az alsó végtagok alacsony reflexállapotán kívül, amelynél az idegvezetési vizsgálatok megerősítették a szenzomotoros axonális polyneuropathiát, a neurológiai vizsgálat normális volt. A neuropszichológiai tünetek közé tartoztak a szorongásos rendellenesség aspektusai, és a beteg rövid távú memóriavesztéssel kapcsolatos nehézségekről számolt be. A neuropszichológiai vizsgálatok azonban nem erősítették meg a nyilvánvaló mnestic meghibásodást, hanem inkább egy nem specifikus figyelemelterelést, amelyet az akkori elégtelen rohamok elnyomása is fokozhatott. A laboratóriumi vizsgálatok negatívak voltak bármilyen tünetekkel járó epilepsziára (pl., autoimmun-encephalitis antitestek, antineuronális antitestek). A cerebrospinális folyadék nem mutatott gyulladás jeleit, de mérsékelt fehérje növekedést mutatott (765 mg/l). A biogén aminok elemzése a cerebrospinális folyadékban a glutamin emelkedését tárta fel, amelyet a közelmúltbeli rohamokkal társítottunk. A perifériás vérben az acanthocyták 0,4% – át találták. A Wilson-kór szerológiai vizsgálata negatív volt. Észrevehető volt a kreatin-kináz tartós emelkedése (tartomány: 1000-3000 U/l), ami a mitokondriális rendellenesség feltételezett diagnózisához vezetett. További vizsgálatokhoz ischaemiás Laktát tesztet végeztünk, amely normális eredményeket mutatott. Az M. gastrocnemicus izombiopsziáját elvégezték, de a mitokondriális funkció és a légzési lánc elemzése normális volt.
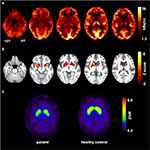
1. ábra. Molekuláris képalkotó vizsgálatok eredményei. A transaxiális FDG-PET képek (A) nemcsak enyhe kétoldalú meziotemporális hipometabolizmust mutattak (összhangban a meziotemporális roham eredetével), hanem egy markáns striatális hipometabolizmust is, amelyet rendkívül szignifikánsnak találtak az egészséges kontrollokhoz képest . Egy további FP-CIT-SPECT vizsgálat (C) a striatális dopamin transzporterek mérsékelt elvesztését is feltárta, a nigrostriatális integritás csökkenésének tanúja (összehasonlításra egy életkornak megfelelő egészséges kontroll látható; DVR, eloszlási térfogat arány).

2. ábra. Az index beteg klinikai és diagnosztikai folyamata.
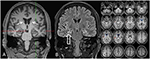
3. ábra. Az MRI diszkrét kétoldali caudate fej atrófiát és egy kisebb és hiperintenzív jobb oldali hippocampust mutat, ami a jobb oldali hippocampus sclerosisra utal . A bal hippocampus kissé hiperintenzív, de nem atrofikus. A bilaterális caudate fej atrófiáját CVR elemzéssel erősítik meg, amelyben a kék színek csökkent szürke, a piros színek pedig megnövelték a cerebrospinális folyadék térfogatát (C).
a családtörténet feltárta a szülei (első unokatestvérek) rokonságát, akiknek maguknak nem volt jelentős kórtörténete. Hat testvére közül kettő (20-30 éves kor között) szintén általános rohamokban szenvedett (lásd a 4.ábrát). A testvérei orvosi feljegyzései nem álltak rendelkezésünkre.
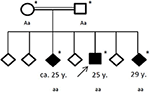
4. ábra. Az érintett család származása, az első epilepsziás roham életkorával években (y). Nyíl: index szabadalom. Csillag: genetikai vizsgálat. Aa, heterozigóta; aa, homozigóta c.4326 T>A (p.Tyr1442*).
az örökletes neurodegeneratív mozgászavar hipotézise alapján a beteget és családját genetikai vizsgálatra irányították. Az Exome szekvenálás homozigóta újszerű csonkoló mutációt tárt fel c. 4326 T>A (p.Tyr1442*) a Chac génben VPS13A a három érintett testvérnél. A vér szerinti szülőket egyaránt heterozigóta módon mutatták ki. Az exome szekvenálás során más variánst vagy mutációt nem azonosítottak.
valójában egy 33 éves korban végzett nyomon követés során az indexes betegnek még mindig csak marginális extrapiramidális tünetei voltak, és egyik nővérénél sem volt jelen. Most már csak a jobb felső végtag alapozása alatt enyhe merevség benyomását keltette,a felső végtagok enyhe bradikinéziája. Levetiracetámmal és lakozamiddal végzett kezelés alatt a beteg rohammentes volt.
Vita
a jelen esetben bemutatjuk, hogy a ChAc klinikailag megnyilvánulhat temporális lebeny epilepsziával, amelynek nincs jelentős motoros tünete a vps13a gén új megfelelő mutációja miatt.
a betegség lefolyását jellemzően progresszív mozgászavar (beleértve a Koreát, a dystoniát, a parkinsonizmust), kognitív és pszichiátriai változások és myopathiás tünetek jellemzik, az acanthocytosis és a hyperCKemia szerológiai markereivel. A rohamokat korábban a ChAc (6) tüneteként jegyezték fel, de a mozgási rendellenességeket továbbra is a legfontosabb tünetnek tekintik. Bizonyíték merül fel arra, hogy az epilepszia, pontosabban a temporális lebenyből származó epilepszia a ChAc alulbecsült fenotípusa lehet. Peluso és munkatársai. a miénkhez hasonló betegről számoltak be, aki még 46 éves korában sem mutatott mozgási rendellenességeket, miközben a bazális ganglionok érintettségére utaló neuroimaging eredményeket mutatott be (7). Ennek megfelelően Scheid et al. három, mesialis temporális lebeny epilepsziában és szklerózisban szenvedő beteget (MRI vizsgálatok alapján) írtak le domináns tünetként, és Chac-ot diagnosztizáltak náluk (8). Továbbá, Mente et al. nemrégiben egy Chac-beteg boncolási eredményei, akik nemcsak a bazális ganglionok atrófiáját, hanem a hippokampusz szklerózisát is megmutatták (9). Esetünkkel összhangban a hippokampusz kétoldalú érintettsége általános megállapításnak tűnik (10, 11). A rohamok és a szklerózis közötti pontos kapcsolat azonban még mindig a tyúk vagy a tojás kérdése. A Korein korreláló szerepe a hippokampusz szerkezeti fejlődésében még nem teljesen ismert. Érdekes módon egy egérmodellben a Chac szerkezeti változását figyelték meg, mivel a GABA (A) receptor Gamma 2 hippokampális fehérje expressziója és a horgonyzó fehérje Korein megnövekedett (12).
a klinikai rutinban ez a fenotípus továbbra is kihívást jelenthet a helyes diagnózis megtalálásában. Az első döntő utalás a neurodegeneratív betegség felé a betegünkben a striatális glükóz metabolizmusának kiemelkedő csökkenése, valamint a nigrostriatális integritás mérsékelt csökkenése volt az FDG-PET és az FP-CIT-SPECT esetében. A funkcionális képalkotó eredmények kis gyűjteménye az esetsorozat leírása alapján azt mutatja, hogy az anyagcsere és a dopaminerg diszfunkció változásai többnyire a caudate nucleusban és a putamenben fordulnak elő (13). Az agyi MRI feltárta a nucleus caudatus atrófiáját a betegség folyamán, amelyet a Chac-ban tipikus megállapításnak írtak le (14). Ennek megfelelően a különálló neurológiai jellemzők általában a chorea, a táplálkozási dystonia, az orofaciolingualis diszkinéziák és a tics, valamint a bazális ganglionok egyéb tünetei, mint például a parkinsonizmus és a dystonia (3). Csábító feltételezni, hogy a betegünkben megfigyelt striatális változások még mindig a tünetek (azaz prodromális képalkotási eredmények) küszöbértéke alatt voltak, amelyek végül a betegség előrehaladtával fordulhatnak elő. Ezért ösztönözzük a strukturális és molekuláris képalkotást, mint érzékeny diagnosztikai eszközt ebben a ritka betegségben.
a ChAc-ban vannak leírások az 5-50% közötti acantocita számról (3), de van néhány esettanulmány, amely bizonyítja, hogy az acanthocyták csak a betegség késői szakaszában jelentkezhetnek (15), nagyon alacsonyak lehetnek, vagy akár teljesen hiányozhatnak (16). Ezért az acanthocytákat nem szabad kötelezőnek tekinteni a diagnózis felállításához. Ezenkívül az epilepszia késleltetheti a diagnózist, mivel elrejti a ChAc egyéb tipikus tüneteit. Különösen az olyan pszichiátriai tünetek, mint a személyiségváltozások és a kognitív romlás, amelyek nagyon gyakoriak, félreértelmezhetők, és a kábítószerrel kapcsolatos mellékhatásoknak (azaz a levetiracetámnak) vagy a görcsrohamoknak tulajdoníthatók. Másodlagos hyperCKemia általános tónusos klónusos rohamok után figyelhető meg, és a tartós emelkedés figyelmen kívül hagyható.
esetünk kiemeli az exome szekvenálás döntő előnyeit a helyes diagnózis megállapításához, különösen ritka betegségek esetén vagy ha a tünetek homályosak. Az emlős VPS13 (a–D) gének családja egyre nagyobb érdeklődést mutat, és mutációkat azonosítottak más neurológiai betegségekben, például autoszomális recesszív Parkinson-kórban vagy autoszomális recesszív spinocerebelláris ataxiában (17). A vps13d recesszív mutációi gyermekkori mozgási rendellenességeket okoznak (18). A Chac mögöttes patofiziológiája még nem teljesen megfejtett, de kimutatták, hogy a VPS13A kódolja a fehérje koreint, amely mindenütt expresszálódik az agyban és számos más szövetben (19). Tanulmányok azt mutatják, hogy részt vesz a jelátviteli útvonalakon, amelyek szabályozzák a citoszkeletális architektúrát, az exocitózist és a sejtek túlélését (20). Egy másik mutáció, amelyről leírták, hogy roham által dominált fenotípussal rendelkezik 9 Chac-ban szenvedő betegnél, a C.2343del mutáció a VPS13A génben (21). Ésszerű feltételezni, hogy ugyanazon gén specifikus mutációi a Korein bizonyos aberrációját eredményezik, amely egyedi fenotípust okoz, például az agy különböző területeinek befolyásolásával. Az alapul szolgáló patofiziológia azonban még mindig csak spekulatív, és az okozati mutációk további dokumentálása érdekes lesz. Itt megmutatjuk, hogy a csonka mutáció c.4326 T>A (p.Tyr1442*), amelyet korábban nem írtak le, hasonló fenotípust eredményez, domináns epilepsziával az összes érintett családtagban.
Záró megjegyzések
az epilepszia (különösen a bilaterális temporális lebeny epilepszia) valószínűleg a Chac domináns fenotípusa. Ezért gondosan el kell végezni további vörös zászlók (például hiperckémia, családtörténet, polyneuropathia) keresését. Gyanús esetekben acanthocytákat kell keresni a vérben és az agy MRI-jében, mivel ezek az eszközök széles körben rendelkezésre állnak. Kétség esetén a diagnosztikát ki kell egészíteni az FDG-PET és/vagy az FP-CIT-SPECT módszerrel, mivel ezek érzékenyek a striatális érintettség kimutatására. Autoszomális recesszív epilepsziákban, amelyek indikatív eredményeket mutatnak egy neurodegeneratív betegségre, a vps13a egyetlen géntesztet vagy a Chorein Western blot-ot kell használni a helyes diagnózis megállapításához. Ez utóbbit más neurodegeneratív rendellenességekben is figyelembe kell venni, genetikailag meghatározott etiológia nélkül.
etikai nyilatkozat
írásbeli tájékoztatáson alapuló beleegyezést kaptak a betegtől a vizsgálatban való részvételhez. Írásbeli tájékozott beleegyezést kaptak a betegtől az esetjelentés közzétételéhez.
szerzői hozzájárulások
JW, MR és SK részt vett a betegek kezelésében. JW írta a kézirat első vázlatát. Az LF, A Hu és a PM számadatokat készített. Minden szerző hozzájárult a kézirat felülvizsgálatához, elolvasta és jóváhagyta a benyújtott verziót.
összeférhetetlenségi nyilatkozat
HU a Veobrain Gmbh részvényese, a Freiburgi Egyetemi Orvosi Központ spin-offja.
a fennmaradó szerzők kijelentik, hogy a kutatást olyan kereskedelmi vagy pénzügyi kapcsolatok hiányában végezték, amelyek potenciális összeférhetetlenségnek tekinthetők.
1. Walterfang M, Evans a, Leong Looi JC, Jung HH, Danek A, Walker RH, et al. A neuroacanthocytosis szindrómák neuropszichiátriája. Neurosci Biobehav Rev. (2011) 35:1275-83. doi: 10.1016 / j. neubiorev.2011.01.001
PubMed Absztrakt / CrossRef Teljes Szöveg / Google Tudós
2. Walker RH. Neuroacanthocytosis szindrómák kezelése. Tremor Egyéb Hyperkinet. Mov. (2015) 5:346. doi: 10.7916 / D8W66K48
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
3. Velayos Baeza A, Dobson-kő C, Rampoldi L, Bader B, Walker RH, Danek a, et al. Chorea-Acanthocytosis. GeneReviews 6. Seattle, WA: Washingtoni Egyetem (1993).
4. Critchley EM, Clark DB, Wikler A. Acanthocytosis és neurológiai rendellenesség Betalipoproteinemia nélkül. Arch Neurol. (1968) 18:134–40.
PubMed Absztrakt
5. Levine IM, Estes JW, Looney JM. Örökletes neurológiai betegség acanthocytosissal. Egy új szindróma. Arch Neurol. (1968) 19:403–9.
PubMed Absztrakt / Google Scholar
6. Hardie RJ, Pullon HW, Harding ae, Owen JS, Pires M, Daniels GL, et al. Neuroacanthocytosis. 19 eset klinikai, hematológiai és patológiai vizsgálata. Agy (1991) 114 (Pt 1a): 13-49.
PubMed Absztrakt / Google Scholar
7. Peluso S, Bilo L, Esposito M, Antenora A, Rosa ADR, Pappata S, et al. Chorea-acanthocytosis chorea nélkül: a klinikai fenotípus kiterjesztése. Parkinson Relat Disord. (2017) 41:124–6. doi: 10.2016 / j. parkreldis.2017.05.013
PubMed Absztrakt / CrossRef Teljes Szöveg / Google Scholar
8. Scheid R, Bader B, Ott DV, Merkenschlager a, Danak A. mesialis temporális lebeny epilepszia kialakulása chorea-acanthocytosisban. Neurológia (2009) 73:1419-22. doi: 10.1212 / WNL.0b013e3181bd80d4
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
9. Mente K, Kim SA, Grunseich C, Hefti MM, Crary JF, Danek A, et al. Hippokampusz szklerózis és mesialis temporális lebeny epilepszia chorea-acanthocytosisban: klinikai, patológiai és genetikai értékeléssel járó eset. Neuropatol Appl Neurobiol. (2017) 43:542–6. doi: 10.1111 / nagyi.12403
PubMed Absztrakt / CrossRef Teljes Szöveg / Google Tudós
10. Bader B, Vollmar C, Ackl N, Ebert A, La Foug Ca, Noachtar S, et al. Kétoldali temporális lebeny epilepszia intracranialis EEG-vel igazolt chorea-acanthocytosisban. Lefoglalás (2011) 20:340-2. doi: 10.1016 / j. lefoglalás.2010.12.007
PubMed Absztrakt / CrossRef Teljes Szöveg / Google Scholar
11. Marson AM, Bucciantini E, Gentile E, Geda C. Neuroacanthocytosis: klinikai, radiológiai és neurofiziológiai leletek egy olasz családban. Neurol Sci. (2003) 24:188–9. doi: 10.1007 / s10072-003-0123-1
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
12. Kurano Y, Nakamura M, Ichiba M, Matsuda M, Mizuno E, Kato M, et al. A koreinhiány a GEFIRIN és a GABA(A) receptor szabályozásához vezet. Biochem Biophys Res Commun. (2006) 351:438–42. doi: 10.1016 / j. bbrc.2006.10.070
PubMed Absztrakt / CrossRef Teljes Szöveg / Google Scholar
13. Ehrlich DJ, Walker RH. Funkcionális neuroimaging és chorea: szisztematikus áttekintés. J Clin MOV Disord. (2017) 4:8. doi: 10.1186 / s40734-017-0056-0
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
14. Connolly BS, Hazrati L-N, Lang AE. Neuropatológiai eredmények a chorea-acanthocytosisban: új betekintés a parkinsonizmus és a rohamok alapjául szolgáló mechanizmusokba. Acta Neuropathol. (2014) 127:613–5. doi: 10.1007 / s00401-013-1241-3
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
15. Sorrentino G, De Renzo A, Miniello S, Nori O, Bonavita V. Az acanthocyták késői megjelenése a chorea-acanthocytosis során. J Neurol Sci. (1999) 163:175–8.
PubMed Absztrakt / Google Scholar
16. Bayreuther C, Borg M, Ferrero-Vacher C, Chaussenot A, Lebrun C. Chor-acanthocytose acanthocyták nélkül. Revue Neurol. (2010) 166:100–3. doi: 10.1016 / j.neurol.2009.03.005
CrossRef Teljes Szöveg / Google Scholar
17. Lesage S, Drouet V, Majounie E, Deramecourt V, Jacoupy M, Nicolas A, et al. A vps13c funkció elvesztése autoszomális recesszív parkinsonizmusban mitokondriális diszfunkciót okoz és növeli a PINK1 / Parkin-függő mitofágiát. Am J Hum Genet. (2016) 98:500–13. doi: 10.1016 / j.2016.01.014
PubMed Absztrakt / CrossRef Teljes Szöveg / Google Scholar
18. Gauthier J, Meijer IA, Lessel D, Mencacci NE, Krainc D, Hempel M, et al. A >vps13d recesszív mutációi gyermekkori mozgási rendellenességeket okoznak. Ann Neurol. (2018) 83: Én6. doi: 10.1002 / ana.25204
PubMed Absztrakt / CrossRef Teljes Szöveg / Google Scholar
19. Kurano Y, Nakamura M, Ichiba M, Matsuda M, Mizuno E, Kato M, et al. A chorein in vivo eloszlása és lokalizációja. Biochem Biophys Res Commun. (2007) 353:431–5. doi: 10.1016 / j. bbrc.2006.12.059
PubMed Absztrakt / CrossRef Teljes Szöveg / Google Scholar
20. Lang F, Pelzl L, Sch = D), Hermann A, F = D), Sc = D), et al. Neuronok, eritrociták és azon túl -a chorein különböző funkciói. Neurosignals (2017) 25:117-26. doi: 10.1159/000485457
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
21. Benninger F, Afawi Z, Korczyn AD, Oliver KL, Pendziwiat M, Nakamura M, et al. A görcsrohamok a C.2343del VPS13A génmutációval járó chorea-acanthocytosisban jelentkező és kiemelkedő tünetként jelentkeznek. Epilepszia (2016) 57:549-56. doi: 10.1111 / epi.13318
PubMed Abstract | CrossRef Full Text | Google Scholar