határok az orvostudományban
- Bevezetés
- betegek és módszerek
- Betegválasztás a Surveillance, Epidemiology and End Results Database-ben
- statisztikai elemzés
- eredmények
- Betegjellemzők
- a T1 stádium fokozott kockázata a többi t stádiumhoz képest a szérum CEA emelkedés összefüggésében
- a preoperatív szérum CEA – emelkedés hatása a T-szakaszban
- Vita
- Data Availability Statement
- etikai nyilatkozat
- szerzői hozzájárulások
- összeférhetetlenség
- Köszönetnyilvánítás
Bevezetés
a végbélrák az egyik leggyakoribb rosszindulatú daganat világszerte (1). Az American Joint Committee on Cancer (AJCC) staging system szerint az elsődleges tumor anatómiai kiterjedése (T stádium) az egyik legfontosabb prognosztikai előrejelző. A végbélrák azonos t stádiumában szenvedő betegek azonban jelentősen eltérő klinikai eredményeket mutathatnak.
először 1965-ben jelentették, hogy a carcinoembryonic antigen (CEA) egy 180-200 kDa-s glikoprotein és az immunglobulin szupercsalád tagja (2). A CEA-t különféle szilárd daganatok választják ki, beleértve a vastagbélrák 90% – át (3). Mint az egyetlen legfontosabb és megbízható szérum prognosztikai biomarker a vastagbélrákban, az emelkedett preoperatív CEA-szint a colorectalis rák rosszabb prognózisával jár (4-9).
korábbi vizsgálatok kimutatták, hogy a CEA a rákos sejtek adhéziójával és a veleszületett immunitással társult a vastagbélrákban. Ezenkívül a CEA-ról azt is jelentették, hogy megkönnyíti a colorectalis rákos sejtek kötődését a metasztázis helyeihez és támogatja a tumor progresszióját (10-12).
hagyományosan a tumorsejtek távoli terjedését késői eseménynek tekintették, mégis számos korábbi tanulmány eredményei azt mutatták, hogy a metasztatikus potenciál megszerzése a tumor progressziójának nagyon korai szakaszában fordulhat elő (13-16). Wo et al. (17) arról számolt be, hogy a nyirokcsomó-pozitivitásban részt vevő nagyon kis daganatméret helyettesítheti az agresszív biológiát. Ezután azt gyanítjuk, hogy a nagyon korai stádiumú végbélrák szérum CEA emelkedéssel utalhat a metasztatikus potenciál korai megszerzésére, és megjósolhatja a végbélrák nagyon rossz túlélését.
tudomásunk szerint azonban kevés olyan vizsgálatról számoltak be, amelyek a T-stádium és a szérum CEA-szintek (C0 és C1) összefüggését vizsgálták a végbélrák prognózisának meghatározásában. Ezért elvégezzük ezt a nagy populáción alapuló vizsgálatot annak megvizsgálására, hogy a szérum CEA emelkedésének összefüggésében nagyon korai t stádium lehet-e a biológiailag agresszív betegség helyettesítője, és megjósolja a végbélrák rossz ok-specifikus túlélését (CSS). A nyirokcsomó-pozitivitás kutatásunkra gyakorolt hatásának kiküszöbölése érdekében kizártuk a csomópont-pozitív betegeket, és az elemzést az I–II.stádiumú betegekre összpontosítottuk.
betegek és módszerek
Betegválasztás a Surveillance, Epidemiology and End Results Database-ben
az USA-ban a rák előfordulására és túlélésére vonatkozó hiteles információforrásként, valamint a populáción alapuló információk átfogó forrásaként, beleértve a Surveillance, Epidemiology és End Results (Seer) részt vevő területeken előforduló újonnan diagnosztizált rákos eseteket, a SEER adatbázis az amerikai lakosság ~28% – át foglalja magában. A SEER adatbázis nem tartalmazott azonosítókat, és nyilvánosan elérhető volt a kutatók számára. A SEER * Stat egy olyan szoftver, amelyet a SEER program biztosít a beteginformációk online hozzáférés segítségével történő megszerzéséhez. Először a SEER*Stat szoftver (SEER*Stat 8.3.5) esetlistázási munkamenetét használták az összes beteggel kapcsolatos információ felsorolására, és az I-II.stádiumú (node-negatív) végbélrákkal diagnosztizált betegeket január 1, 2004 és December 31, 2015 között azonosították a SEER adatbázisból (1. ábra). A végbélrákos betegeket az ICD-O-3 helykódok C199 és C209, valamint a 3.viselkedési kód (NAACCR 522 és 523 pont) (9) alapján azonosították. Azért választottuk ezeket az éveket, mert a preoperatív szérum CEA információit 2004-től rögzítették, a SEER nyomon követése pedig 2015-ben fejeződött be.

1. ábra. A beteg kohorsz meghatározásainak folyamatábrája.
ezután azok, akik neoadjuváns sugárterápiát kaptak, a pozitív szövettani megerősítés hiánya, ismeretlen rassz, nem adenokarcinóma szövettan, vagy nem aktív nyomon követést kizárták vizsgálatunkból. A rendelkezésre álló preoperatív szérum CEA-szinttel rendelkező betegeket bevontuk vizsgálatunkba, és csoportosítottuk a “pozitív / emelkedett” és a ” negatív / normális; normál határokon belül”, mint C1 és C0 (C-fokozatú információ). A CEA határértékei nemdohányzóknál 2,5 ng/ml, dohányzóknál pedig 5 ng/ml voltak. Ezenkívül a következő betegklinikopatológiai változókat is lekértük a SEER adatbázisból: T stádium, faj, nem, tumor helye, életkor a diagnóziskor, a diagnózis éve, fokozat, szövettan.
statisztikai elemzés
ebben a vizsgálatban Pearson chi-squared tesztjét alkalmazták a SEER adatbázisból kinyert összes beteg klinikai patológiai változójának összehasonlítására a normál és az emelkedett preoperatív szérum CEA-szint között. Néhány többváltozós Cox arányos veszélymodellt építettek a végbélrák független prognosztikai változóinak azonosítására elemzéseinkben. A túlélési görbéket Kaplan-Meier módszerrel állítottuk elő, a görbék közötti különbségeket pedig log-rank teszttel elemeztük. A jelen vizsgálatban az elsődleges érdeklődés a CSS és a teljes túlélés (os) volt. A CSS-t a diagnózis időpontjától a rák-specifikus halál időpontjáig számítottuk. A végbélráknak tulajdonított haláleseteket eseményként, más okokból származó haláleseteket pedig cenzúrázott megfigyelésként kezelték a halál időpontjában. Annak meghatározására, hogy volt-e szignifikáns kölcsönhatás a preoperatív szérum CEA szint és a T stádium között a CSS előrejelzésében, meghatároztunk egy interakciós változót is (T stádium és szérum CEA szint). A kétoldalas P < 0, 05 statisztikailag szignifikánsnak tekinthető. A statisztikai elemzéseket elsősorban az SPSS 22-es verziójával végezték (IBM Corporation, Armonk, NY, USA).
eredmények
Betegjellemzők
összességében 19 184 beteget azonosítottak a SEER adatbázisából január 1, 2004 és December 31, 2015 között (1.ábra). Ezen betegek közül 13 007 (67,8%) beteget rendeltek a C0 stádiumba, és 6177 beteget (32,2%) a C1 stádiumba. Az AJCC staging system szerint 6077 beteg volt a T1 szakaszban, 4783 beteg a T2 szakaszban, 7021 a T3 szakaszban, 1303 pedig a T4 szakaszban. Összesen 2560 (13,3%) beteg halt meg végbélrákban a követési idő végén. A teljes kohorsz medián követési ideje 44 hónap volt (0-143 hónap). A betegek kiindulási jellemzőit az 1. táblázat foglalja össze.
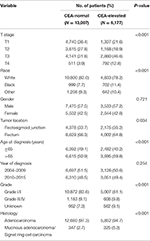
táblázat 1. Stádiumú végbélrák kiindulási jellemzőinek összehasonlítása a szérum carcinoembryonic antigén (CEA) szinttel.
a T1 stádium fokozott kockázata a többi t stádiumhoz képest a szérum CEA emelkedés összefüggésében
azt találták, hogy a C1 stádium nagyobb valószínűséggel korrelál a magasabb t stádiumú, fekete, rectosigmoid junction, idősebb kor, magasabb fokú és mucinos adenocarcinoma/Signet gyűrűs sejtes carcinoma (1.TÁBLÁZAT, P < 0,05). Amint azt a 2. táblázat mutatja, a többváltozós Cox-analízisben a faj, a nem, a tumor helye, a diagnóziskor, a diagnózis éve, a fokozat, a szövettan, a T stádium és a szérum CEA-szint szerepelt. Amikor többváltozós Cox analízist végeztünk, meggyőztük a következő klinikai patológiai jellemzőket, mint független prognosztikai tényezőket az I-II. stádiumú végbélrákban; ezek közé tartozott a faj, a nem, a tumor helye, a diagnózis korát, a tumor fokozatát, a T stádiumot és a szérum CEA-szintet, míg a T2,C0 és T1,C0 közötti kockázat nem volt statisztikai különbség (P = 0,925). Kimutatták, hogy a szérum CEA-emelkedés összefüggésében a T1 stádium a végbélrák-specifikus mortalitás váratlan magasabb kockázatát mutatta a T2 és T3 stádiumokhoz képest. A betegség T1 stádiumában a szérum CEA emelkedett szintje 227,6% – kal növelte a mortalitás kockázatát a szérum CEA normál szintjéhez képest.

2. táblázat. Az OK-specifikus túlélés (CSS) többváltozós Cox regressziós elemzése az I–II.stádiumú végbélrákban.
a Kaplan–Meier túlélési görbéket a 2., 3. ábra ábrázolja. Az 5 éves CSS Arány 92,2% volt a T1C0-ben, 75,2% a T1C1-ben, 93,1% a T2C0-ben, 86,7% a T2C1-ben, 84,6% a T3C0-ben, 76,3% a T3C1-ben, 62,9% a T4C0-ben és 43,6% a T4C1-ben (2.ábra, P < 0,001). Ezért a T1C1 hasonló 5 éves CSS arányt mutatott a T3C1-hez képest (75,2 vs.76,3%, P = 0,238). Ezenkívül a megállapítás még hangsúlyosabb volt az OS-ben. Az 5 éves OS arány 78,6% volt a T1C0-ben, 48,3% a T1C1-ben, 77,1% a T2C0-ben, 62,3% a T2C1-ben, 68,5% a T3C0-ben, 54,5% a T3C1-ben, 45,3% a T4C0-ben és 30,0% a T4C1-ben (3.ábra, P < 0,001). A T1C1 szignifikánsan alacsonyabb 5 éves CSS arányt mutatott a T3C1-hez képest (48,3 vs.54,5%, P < 0,001).
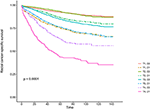
2. ábra. A T stádium Kaplan-Meier ok-specifikus túlélési (CSS) görbéi a szérum carcinoembryonic antigén (CEA) szinttel kombinálva.
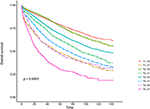
3. ábra. A T stádium Kaplan-Meier teljes túlélési (OS) görbéi a szérum carcinoembryonic antigen (CEA) szinttel kombinálva.
a preoperatív szérum CEA – emelkedés hatása a T-szakaszban
az erdőterületet a relatív hazárdok (hrs) bemutatására rajzoltuk, hogy összehasonlítsuk a normál és emelkedett CEA-csoportok CSS-jét a megfelelő T-stádiumokban (4.ábra). A szérum CEA normál szintjéhez képest a T2 stádiumban a szérum CEA emelkedett szintje a végbélrák-specifikus mortalitás 69,0%-kal megnövekedett kockázatával társult ; a T3 stádiumban a szérum CEA emelkedett szintje a végbélrák-specifikus mortalitás 67,2%-kal megnövekedett kockázatával társult (HR = 1,672, 95% CI = 1,486–1,882, P < 0,001); a T4 stádiumban a szérum CEA emelkedett szintje 81,3%-kal emelkedett a végbélrák-specifikus mortalitás kockázata (HR = 1,813, 95% CI = 1,485–2,213, p < 0,001); ezzel szemben azonban a T1 stádiumban a szérum CEA emelkedett szintje akár 211-ig is megjelent.6%-kal nőtt a végbélrák-specifikus mortalitás kockázata (HR = 3, 116, 95% CI = 2, 639–3, 679, P < 0, 001).
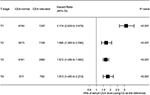
4. ábra. Az OK-specifikus túlélés (CSS) relatív hazárdja a szérum carcinoembryonic antigen (CEA) normál és emelkedett szintje között a T stádiumnak megfelelően.
Vita
arra törekedtünk, hogy megvizsgáljuk a T stádium és a szérum CEA szint összefüggését a végbélrák CSS meghatározásában. Feltételeztük, hogy a végbélrák nagyon korai T stádiumú (T1 stádium)és a szérum CEA emelkedés lehet az agresszív betegség biológiai helyettesítője, így rossz onkológiai eredményt jósol. ~20 000 betegnél diagnosztizálták az I–II.stádiumú végbélrákot a vizsgálatunkban.
ebben a vizsgálatban azt találták, hogy a szérum CEA emelkedés nagyobb valószínűséggel korrelál a magasabb T-stádiumú, fekete, rectosigmoid junction, idősebb korban, és magasabb fokú és mucinos adenocarcinoma/Signet gyűrűs sejtes carcinoma. A Kaplan-Meier túlélési elemzések azt mutatták, hogy a szérum CEA emelkedésével összefüggésben a T1 stádium 5 éves CSS aránya 75,2% volt, ami nem ért el statisztikai különbséget a T3 stádiumtól (76,3%). Ami a teljes túlélést illeti, a T1 stádium 5 éves OS aránya preoperatív szérum CEA emelkedéssel (48,3%) még alacsonyabb volt, mint a CEA emelkedésben részt vevő T3 stádium (54,5%), és nem ért el statisztikai különbséget a T4 stádiumtól (45.3%), ami azt jelenti, hogy a CEA emelkedett preoperatív szérumszintje azonosíthatja a T1 stádiumú végbélrák alcsoportját hasonló CSS-sel összehasonlítva egyes T3 stádiumú betegségekkel, hasonló OS-sel összehasonlítva néhány T4 stádiumú betegséggel.
az ismert végbélrák prognosztikai tényezőinek (rassz, nem, tumor helye, életkor a diagnózis idején, a diagnózis éve, fokozat és szövettan) kiigazítása után az általunk meghatározott interakciós változó (T stádium és szérum CEA szint) a végbélrák független prognosztikai tényezőjének bizonyult. A többváltozós Cox analízis azt mutatta, hogy a szérum CEA-emelkedés összefüggésében a T1 stádium váratlanul nagyobb kockázatot jelentett a végbélrák-specifikus mortalitásra, mint a T2 és T3 stádium. A betegség T1 stádiumában a szérum CEA emelkedett szintje 227,6% – kal növelte a mortalitás kockázatát a szérum CEA normál szintjéhez képest. Ezenkívül a faj, a nem, a tumor helye, a diagnózis korát és a tumor fokozatát az I–II.stádiumú végbélrák független prognosztikai tényezőiként is azonosították. A T1-en kívül azt találták, hogy a preoperatív szérum CEA emelkedés ~75%-kal magasabb a rektális-rák-specifikus mortalitás kockázata az adott T-stádiumban, mégis a szám jelentősen 211,6% – ra nőtt a T1-ben szakaszban.
2000-ben az AJCC colorectalis Munkacsoportja javasolta a CEA szérumszintjének (C stádium) felvételét a vastagbélrák hagyományos AJCC TNM stádiumrendszerébe (18). Ezenkívül az Amerikai Klinikai Onkológiai Társaság és az Európai tumormarkerek csoportja egyaránt támogatta a preoperatív szérum CEA szint prognosztikai eszközként történő felvételét vastagbélrák (19-21).
számos korábbi kutatás szerint a szérum CEA-szint erős prognosztikai szerepet játszik a vastagbélrákban (4-7, 22-26). 2011-ben Thirunavukarasu et al. (25) arról számoltak be, hogy a preoperatív szérum CEA-szint a vastagbélrák független prognosztikai biomarkere volt, és a prognózis rosszabb volt az alacsonyabb stádiumú, magas CEA-val rendelkező betegeknél, mint a magasabb stádiumú, alacsony CEA-val rendelkező betegeknél. Ebben a tanulmányban a magas CEA-t még olyan erősnek is tekintették, mint a csomópont-pozitivitás a vastagbélrák rossz onkológiai kimenetelének előrejelzésére.
mégis kevés tanulmány összpontosít a szérum CEA szint prognosztikai szerepének tisztázására végbélrák. 2016-ban Tarantino et al. (9, 27) elvégezte a két nagy populáción alapuló vizsgálatot, amelyek meggyőző bizonyítékot szolgáltattak arra, hogy a preoperatív szérum CEA emelkedett szintje erősen előrejelezte a rosszabb általános és rákspecifikus túlélést a végbélrákban. 2018-ban Liu et al. (8) kimutatták, hogy a preoperatív szérum CEA a végbélrák független prognosztikai tényezője volt, és az emelkedett szérum CEA–szint nyilvánvalóan rosszabb túlélést mutatott a normál szérum CEA-szinthez képest az I-IV.
bár a hagyományos azt mutatja, hogy a rák lépésről lépésre megszerzi a metasztatikus potenciált, amikor nagy méretűre nőnek (28), néhány korábbi tanulmány azonban azt mutatta, hogy a metasztatikus potenciál megszerzése a tumor progressziójának nagyon korai szakaszában fordulhat elő. Egy korábbi kutatás kimutatta a nagyon kis tumorméret rendkívül gyenge túlélését, amikor részt vesz a nyirokcsomó pozitivitásában (17). Ezenkívül kutatásunk eredményei azt mutatják, hogy a preoperatív szérum CEA szint emelkedése nagyon korai stádiumban (T1 stádium) a végbélrák nagyon rossz OS-vel és CSS-vel társul, és az agresszív biológia helyettesítője lehet. Hisszük, hogy mind a nyirokcsomó érintettségét, mind a szérum CEA emelkedését metasztatikus képesség megszerzésének tekintik. Tanulmányunk, kombinálva Wo et al. következetesen támogassa a fent említett elképzelést, miszerint a metasztatikus potenciál megszerzése nagyon korán előfordulhat a tumor progressziójában, így rossz onkológiai eredményekkel jár, és a kezdeti biológiai jellemző nagyobb valószínűséggel határozza meg a távoli metasztázis potenciálját a rák progressziója során, nem pedig a felhalmozódott metasztatikus képesség (29).
ezenkívül Vizsgálatunk eredményei klinikai jelentőséggel bírnak. Jelenleg az I. stádiumú végbélrákot radikális műtéti reszekcióval kezelik önmagában a viszonylag kedvező onkológiai eredmények miatt. A betegek körülbelül 10-15% – ánál azonban radikális reszekció után kialakul a daganat kiújulása (30, 31). Jelen tanulmányban véletlenül azonosítjuk a T1 stádiumú rektális rák alcsoportját, amelynek prognózisa nagyon rossz az I. stádiumú rektális rák többi részéhez képest, ami azt jelenti, hogy a T1 stádiumú rektális rák a preoperatív szérum CEA emelkedésének bevonásával nagyobb figyelmet kell fordítania az onkológusokra.
tanulmányunkban azonban két korlátozás van. Egyrészt ez a tanulmány nem tartalmazott néhány ismert prognosztikai tényezőt végbélrák elemzéseinkben, beleértve a mikroszatellit instabilitási állapotát és a posztoperatív szövődményeket, amelyek nem voltak elérhetők a SEER adatbázisból, és bizonyos mértékben torzításokat vezethetnek be. Nem tudjuk megadni a CEA tartományait és középértékeit mindkét csoportban. Másrészt a jelen tanulmány retrospektív volt, nem pedig prospektív adatokon alapult. Ezért eredményeinket továbbra is validálni kell más kohorszokban, különösen nagy prospektív klinikai vizsgálatokban.
összefoglalva, tanulmányunk azt mutatja, hogy a T1 stádiumú végbélrák, amikor részt vesz a preoperatív szérum CEA emelkedésben, biológiailag agresszív betegség helyettesítője lehet, és korrelál a kedvezőtlen OS-vel és CSS-vel. Ezenkívül a rektális rák ezen alcsoportja nagyobb klinikai figyelmet érdemel az onkológusok számára. Eredményeink, ha a jövőbeni adatbázis-vizsgálatokban validálják, új terápiás ötletet nyújtana a korai stádiumú végbélrák számára.
Data Availability Statement
az ehhez a tanulmányhoz létrehozott adatkészletek kérésre rendelkezésre állnak a megfelelő szerző számára.
etikai nyilatkozat
a vizsgálatban részt vevő betegeket a SEER adatbázisból azonosították, és az adatok felhasználásának jóváhagyását a SEER programhoz benyújtott kérelem útján szerezték meg. Az intézményi felülvizsgálati testület jóváhagyására nem volt szükség, mert a SEER adatbázis nyilvánosan elérhető.
szerzői hozzájárulások
az SW és a WG jelentős és közvetlen hozzájárulást nyújtott ehhez a tanulmányhoz, és jóváhagyta a benyújtást.
összeférhetetlenség
a szerzők kijelentik, hogy a kutatást olyan kereskedelmi vagy pénzügyi kapcsolatok hiányában végezték, amelyek potenciális összeférhetetlenségnek tekinthetők.
Köszönetnyilvánítás
ezt a munkát részben támogatta a Yancheng Orvostudományi és technológiai fejlesztési terve (YK2015075).
1. Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. globális rákstatisztika 2018: GLOBOCAN becslések az incidenciáról és a halálozásról világszerte 36 rák esetében 185 országban. CA rák J Clin. (2018) 68:394–424. doi: 10.3322 / caac.21492
PubMed Absztrakt / CrossRef Teljes Szöveg / Google Scholar
2. Arany P, Freedman így. Tumor-specifikus antigének kimutatása humán vastagbél-karcinómában immunológiai tolerancia és abszorpciós technikák alkalmazásával. J Exp Med. (1965) 121:439–62. doi: 10.1084/jem.121.3.439
PubMed Absztrakt / CrossRef Teljes Szöveg / Google Tudós
3. Goldstein MJ, Mitchell EP. Karcinoembrionális antigén a colorectalis carcinomában szenvedő betegek stádiumában és nyomon követésében. Rák Invest. (2005) 23:338–51. doi: 10.1081 / CNV-58878
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
4. Becerra AZ, Probst CP, Tejani ANYA, Aquina CT, González MG, Hensley b. j., et al. Az emelkedett preoperatív carcinoembryonic antigénszint prognosztikai szerepének értékelése vastagbélrákos betegeknél: a nemzeti rák adatbázis eredményei. Ann Surg Oncol. (2016) 23:1554–61. doi: 10.1245 / s10434-015-5014-1
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
5. Ogata Y, Murakami H, Sasatomi T, Ishibashi N, Mori S, Ushijima M, et al. Az emelkedett preoperatív szérum carcinoembrionic antigénszint hatékony indikátor lehet az adjuváns kemoterápiára a II.stádiumú vastagbélrák potenciálisan gyógyító reszekciója után. J Surg Oncol. (2010) 99:65–70. doi: 10.1002 / jso.21161
PubMed Absztrakt / CrossRef Teljes Szöveg / Google Scholar
6. Quah HM, Chou JF, Gonen M, Shia J, Schrag D, Landmann RG, et al. Stádiumú vastagbélrákban szenvedő betegek azonosítása adjuváns terápia céljából. Dis Vastagbél Végbél. (2008) 51:503–7. doi: 10.1007 / s10350-008-9246-z
PubMed absztrakt / CrossRef teljes szöveg / Google Scholar
7. Spindler BA, Bergquist JR, Thiels CA, Habermann EB, Kelley SR, Larson DW, et al. A CEA beépítése javítja a kockázati rétegződést a II. J Gastrointest Surg. (2017) 21:770-7. doi: 10.1007 / s11605-017-3391-4
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
8. Liu Q, Lian P, Luo D, Cai S, Li Q, Li X. Karcinoembrionális antigén kombinációja az Amerikai Rákellenes vegyes Bizottsággal a TNM stádiumrendszer rektális rákban: valós és nagy populáción alapuló vizsgálat. Az Onco Célba Veszi. (2018) 11:5827–34. doi: 10.2147 / OTT.S171433
PubMed Absztrakt / CrossRef Teljes Szöveg / Google Scholar
9. Tarantino I., Warschkow R., Schmied BM, G. O., Mieth M., Cerny T., et al. A CEA prediktív értéke a túléléshez az I. stádiumú végbélrákban: populáción alapuló hajlam pontszámmal egyeztetett elemzés. J Gastrointest Surg. (2016) 20:1213-22. doi: 10.1007/s11605-016-3137-8
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Beauchemin N, Arabzadeh A. Carcinoembryonic antigen-related cell adhesion molecules (CEACAMs) in cancer progression and metastasis. Cancer Metastasis Rev. (2013) 32:643–71. doi: 10.1007/s10555-013-9444-6
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Arabzadeh A, Chan C, Nouvion AL, Breton V, Benlolo S, DeMarte L, et al. Host-related carcinoembryonic antigen cell adhesion molecule 1 promotes metastasis of colorectal cancer. Onkogén. (2013) 32:849–60. doi: 10.1038 / onc.2012.112
PubMed Absztrakt / CrossRef Teljes Szöveg / Google Scholar
12. Cai Z, Xiao J, He X, Ke J, Zou Y, Chen Y, et al. A preoperatív carcinoembryonic antigén új prognosztikai jelentőségének elérése a daganatos reszekciót kapó vastagbélrákban: több mint pozitív és negatív. Rák Biomark. (2017) 19:161–8. doi: 10.3233 / CBM-160287
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
13. Engel J, Eckel R, Kerr J, Schmidt M, F stb. Az emlőrák metasztázisának folyamata. Eur J Rák. (2003) 39:1794–806. doi: 10.1016 / S0959-8049(03)00422-2
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
14. Hüsemann Y, Geigl JB, Schubert F, Musiani P, Meyer M, Burghart E, et al. A szisztémás terjedés az emlőrák korai lépése. Rákos Sejt. (2008) 13:58–68. doi: 10.1016 / j.ccr.2007.12.003
PubMed Absztrakt / CrossRef Teljes Szöveg / Google Scholar
15. Podsypanina K, Du YC, Jechlinger M, Beverly LJ, Hambardzumyan D, Varmus H. A nem átalakult egér emlőssejtek vetése és szaporítása a tüdőben. Tudomány. (2008) 321:1841–4. doi: 10.1126 / tudomány.1161621
PubMed Absztrakt / CrossRef Teljes Szöveg / Google Tudós
16. Schmidt-Kittler O, Ragg T, Daskalakis A, Granzow M, Ahr A, Blankenstein TJ, et al. A látens disszeminált sejtektől a nyílt metasztázisig: a szisztémás emlőrák progressziójának genetikai elemzése. Proc Natl Acad Sci USA. (2003) 100:7737–42. doi: 10.1073/pnas.1331931100
PubMed Absztrakt / CrossRef Teljes Szöveg / Google Tudós
17. Wo JY, Chen K, Neville BA, Lin NU, Punglia RS. A nagyon kis daganatméret hatása a rákspecifikus mortalitásra csomópont-pozitív emlőrákban. J Clin Oncol. (2012) 23:32–3. doi: 10.1016 / j. breastdis.2012.01.026
CrossRef Teljes Szöveg / Google Scholar
18. Compton C, Fenoglio-Preiser CM, Pettigrew N, Fielding LP. Amerikai Rák prognosztikai tényezők vegyes bizottsága konszenzus konferencia: colorectalis munkacsoport. Rák. (2015) 88:1739–57. doi: 10.1002/(SICI)1097-0142(20000401)88:7<1739::támogatás-CNCR30>3.0.CO;2-T
PubMed Absztrakt / CrossRef Teljes Szöveg / Google Tudós
19. Duffy MJ, van Dalen A, Haglund C, Hansson L, Holinski-Feder E, Klapdor R, et al. Tumor markerek a vastagbélrákban: Európai tumormarkerek csoportja (EGTM) irányelvek a klinikai alkalmazáshoz. Eur J Rák. (2007) 43:1348–60. doi: 10.1016 / j. ejca.2007.03.021
PubMed Absztrakt / CrossRef Teljes Szöveg / Google Scholar
20. Locker GY, Hamilton S, Harris J, Jessup JM, Kemeny N, Macdonald JS, et al. ASCO 2006 a tumor markerek gasztrointesztinális rákban történő alkalmazására vonatkozó ajánlások frissítése. J Clin Oncol. (2006) 24:5313–27. doi: 10.1200 / JCO.2006.08.2644
PubMed Absztrakt / CrossRef Teljes Szöveg / Google Scholar
21. Duffy MJ, Lamerz R, Haglund C, Nicolini A, Kalousov stb. Tumormarkerek colorectalis rákban, gyomorrákban és gastrointestinalis stromalis rákokban: European group on tumor markerek 2014 irányelvek frissítése. Int J Rák. (2014) 134:2513–22. doi: 10.1002 / ijc.28384
PubMed Absztrakt / CrossRef Teljes Szöveg / Google Tudós
22. Harrison LE, Guillem JG, Paty P, Cohen AM. A preoperatív karcinoembrionális antigén előrejelzi a csomópont-negatív vastagbélrákos betegek kimenetelét: 572 beteg többváltozós elemzése. J Am Coll Surg. (1997) 185:55-9. doi: 10.1016 / S1072-7515(97)00012-4
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
23. Huh JW, OH BR, Kim HR, Kim YJ. Preoperatív carcinoembryonic antigénszint, mint független prognosztikai tényező potenciálisan gyógyító vastagbélrákban. J Surg Oncol. (2010) 101:396–400. doi: 10.1002 / jso.21495
PubMed Absztrakt / CrossRef Teljes Szöveg / Google Scholar
24. Ozawa H, Kotake K, Hosaka M, Hirata A, Nakagawa Y, Fujita S, et al. A szérum carcinoembryonic antigénszintek beépítése a vastagbélrák prognosztikai csoportosítási rendszerébe. Int J Colorect Dis. (2017) 32:1–9. doi: 10.1007 / s00384-017-2772-1
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
25. Thirunavukarasu P, Sukumar S, Sathaiah M, Mahan M, Pragatheeshwar KD, Pingpank JF, et al. C-szakasz a vastagbélrákban: a carcinoembryonic antigen biomarker következményei a szakaszban, a prognózisban és a kezelésben. J Natl Rák Inst. (2011) 103:689–97. doi: 10.1093 / jnci / djr078
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
26. Margalit O, Mamtani R, Yang YX, Reiss KA, Golan T, Halpern N, et al. A karcinoembrionális antigénszintek prognosztikai értékének értékelése az I. és II. stádiumú vastagbélrákban. Eur J Rák. (2018) 94:1–5. doi: 10.1016 / j. ejca.2018.01.112
PubMed Absztrakt / CrossRef Teljes Szöveg / Google Tudós
27. Tarantino I., Warschkow R., Worni M., Merati-Kashani K., K. Kb, Schmied BM, et al. Az emelkedett preoperatív CEA rosszabb túléléssel jár az I-III. stádiumú végbélrákos betegeknél. Br J Rák. (2012) 107:266. doi: 10.1038 / bjc.2012.267
PubMed Absztrakt / CrossRef Teljes Szöveg / Google Scholar
28. Norton L, Massague J. a rák az önvetés betegsége? Nat Med. (2006) 12:875–8. doi: 10.1038 / nm0806-875
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
29. Yu KD, Jiang YZ, Chen S, Cao ZG, Wu J, Shen ZZ, et al. A nagy tumorméret hatása a rákspecifikus mortalitásra csomópont-negatív emlőrákban. Mayo Clin Proc. (2012) 87:1171–80. doi: 10.1016 / j.2012.07.023
PubMed Absztrakt / CrossRef Teljes Szöveg / Google Scholar
30. Blumberg D, Paty PB, Picon AI, Guillem JG, Klimstra DS, Minsky BD, et al. I. stádiumú végbélrák: a magas kockázatú betegek azonosítása. Surg. (1998) 186: 574-9; vita: 579-80. doi: 10.1016 / S1072-7515(98)00018-0
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
31. Gunderson LL, Sargent DJ, Tepper JE, Wolmark N, O ‘ Connell MJ, Begovic M, et al. A t és N stádium és a kezelés hatása a túlélésre és a relapszusra adjuváns végbélrákban: összesített elemzés. J Clin Oncol. (2004) 22:1785-96. doi: 10.1200 / JCO.2004.08.173
PubMed Absztrakt / CrossRef Teljes Szöveg / Google Scholar