kloridion – csatornák és transzporterek: a természet érdekességeitől és az emberi betegségek forrásától a kábítószer-célpontokig
feladva: 20 augusztus 2013 | |
korai az egyetemi oktatás, a hallgató bevezetésre kerül a különböző típusú integrált membrán fehérje: receptorok, adhéziós fehérjék, ioncsatornák, ion szivattyúk és ion transzporterek. Tanulmányaik során rájönnek, hogy diszkrét géncsaládok és fehérjeszerkezetek felelősek ezekért a különböző fehérjeosztályokért, és soha nincs ok arra gondolni, hogy bármilyen kétértelműség lehet egy adott fehérje megfelelő fehérjeosztályához való hozzárendelésében.
ez gyakorlatilag minden esetet kielégít az osztályteremtől a kutatólaboratóriumig, amíg figyelembe nem vesszük a klorid csatornákat. Tudjuk, hogy léteznek, fontosak és jó gyógyszer célpontok lehetnek számos betegség területén, de egészen a közelmúltig kissé megbélyegzettek és divatjamúltak maradtak a terápiák világában. A szelektív ligandumok hiánya egyáltalán nem segített. Az egyetlen kivétel ez alól a GABA volt-egy receptor, amely egy belső kloridcsatornához kapcsolódik, amely a gátló neurotranszmitter GABA kötődésekor nyílik meg. A benzodiazepinek azóta fokozzák ezt a receptort, hogy a Valium az 1960-as években elérhetővé vált, nyugtató és görcsoldó hatással. Ez egy fontos fogalmat vezet be: számos géncsalád és különböző fehérjetípus létezik, amelyek kloridcsatornákként írhatók le.
ez ellentétben áll azzal, amit a kationszelektív ioncsatornákról értünk, ahol a fehérje szerkezetében kevés a rugalmasság, amely a káliumra, nátriumra vagy kalciumra szelektív pórust képezhet; ezen ioncsatornák sokféleségét a pórustól eltérő fehérje domének variációi okozzák, amelyek befolyásolják a nyitó-záró viselkedést. Hogy igazságos legyek, úgy tűnik, hogy nincs sok fiziológiai oka annak, hogy egy anioncsatornának klorid-szelektivitást kell mutatnia, mivel kevés fiziológiai szerepe van más halogenidek vagy kis anionok membránszállításában; bármely anioncsatorna alapértelmezés szerint kloridcsatorna lesz fiziológiai szempontból. Másrészt a kálium -, nátrium-és kalciummembrán áramok mindegyike különböző alapvető szerepet játszik, és a szelektív membrán permeabilitás ezekre a kationokra döntő fontosságú a sejtműködés és valójában maga az élet szempontjából.
a GABA-a receptorok a cys-loop pentamer ligandum-kapuzott ioncsatorna családok tagjai, amelyek többféle gerjesztő és gátló neurotranszmitter-kapuzott csatornát tartalmaznak. A cisztás fibrózis transzmembrán szabályozó (CFTR) fehérje egy nukleotid által szabályozott kloridcsatorna. Az ATP-kötő kazetta (ABC) transzporter család tagja, és az egyetlen, amely úgy tűnik, hogy nem szállít szubsztrátot a membránon keresztül, hanem kloridcsatornaként működik. A feszültségfüggő kloridcsatornák CLC családja egy másik különálló géncsaládból származik, és általános szerkezete egyedülálló a membránfehérjék között. Ez a fehérjecsalád sok meglepetést hozott az elmúlt 30 évben, és ennek a családnak a tagjait itt fogják bemutatni, és azt is, hogy hogyan tekinthetők kábítószer-célpontoknak.
a kloridcsatorna Mező További izgalmas fejleményei merültek fel a kalcium-aktivált klorid (ClCa) csatornák alapjául szolgáló fehérjék molekuláris azonosítását követően. Funkcionálisan már egy ideje tudunk fiziológiai szerepükről, de a csatornafehérjék legújabb molekuláris azonosítása lehetővé tette molekuláris és farmakológiai eszközök kifejlesztését az aktivitásuk vizsgálatára és megváltoztatására. Ez a felülvizsgálat a clca-csatornák és a CLC-fehérjék megcélzásának farmakológiai potenciáljára összpontosít; funkciójukat és szubcelluláris lokalizációjukat az 1. ábra foglalja össze.
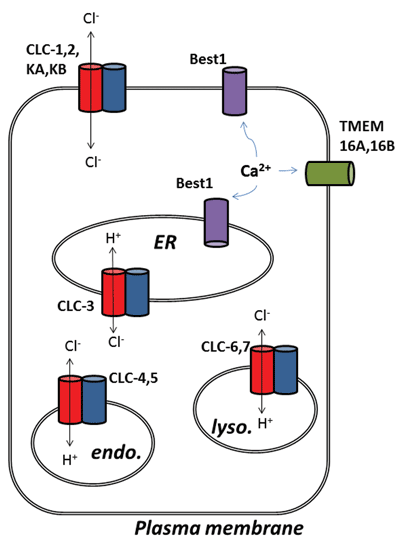
ábra 1
bevezetés a CLC fehérjékbe
ennek a fehérjecsaládnak a kilenc tagja a CLC-1-7, a CLC-KA és a KB. Az alapító tag, a CLC-1, a vázizom feszültségfüggő kloridcsatornája, amelyet az alábbiakban tárgyalunk. Számos funkcionális vizsgálatot végeztek a CLC-0 tiszteletbeli címmel rendelkező homológon, amelyet az Electroplax elektromos szervből izoláltak, amely lehetővé teszi a sugár számára, hogy elkábítsa vízi áldozatait. A CLC-0 lipid kétrétegekké történő feloldása és az egyes ioncsatornákon átáramló áramok elektrofiziológiai rögzítése érdekes tulajdonságot tárt fel. Általában, amikor egyetlen ioncsatornát tartalmazó kis membránfoltból áramot rögzítünk, az egyik két áram amplitúdó közötti ingadozást figyel meg: az egyik a zárt csatornát, a másik a nyitott csatornán átáramló áramot képviseli. Az ingadozások a nyitott és zárt kinetikus állapotok közötti átmenetet tükrözik. A CLC-0 esetében azonban nyilvánvaló volt, hogy az egy ioncsatornás fehérje két ekvivalens pórusból áll, amelyek egymástól függetlenül nyithatnak1. Ezt a csatornát ezért kettős csövűnek írták le (2.ábra). Így nem volt nagy meglepetés, hogy az enterális baktériumok homológjainak kristályszerkezete feltárta, hogy a fehérje komplex dimer, minden egyes alegységnek ionvezető útja van2 (2.ábra).
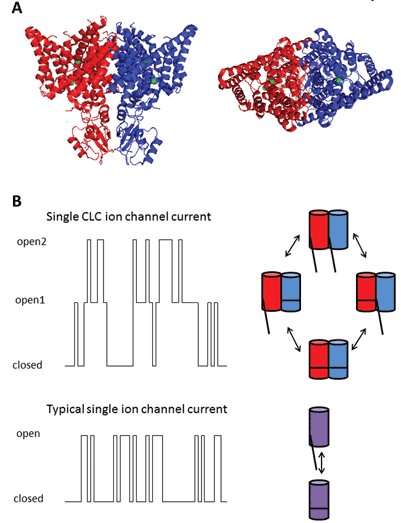
ábra 2
a második meglepetés akkor merült fel, amikor részletes funkcionális kísérleteket végeztek az E. coli CLC-ec1-jén. Ahelyett, hogy kloridcsatornaként működne, mint régen elveszett rokona gerinces vázizom, CLC-ec1 egy 2CL – / H+ csere transzporter, vagy antiporter, szigorú 2: 1 csere sztöchiometriával3. Ez a fehérje fontos az enterális baktériumok túléléséhez alacsony pH4-ben, és valószínűleg kihasználja a klorid gradienst, hogy a sejtek pH-ját elfogadható szinten tartsa. A prokarióta CLC-k ezért a patogén E. coli vagy szalmonella fertőzés kezelésére szolgáló inhibitorok célpontjai lehetnek4. Az ioncserélő viselkedés felfedezése természetesen további erőfeszítéseket ösztönzött annak meghatározására, hogy létezik-e ezen klorid-proton csere bármelyike emlős CLC–kben, feltételezve, hogy a CL – /H+ csere lehet az archetipikus CLC-K valódi funkciója, és a kloridcsatornákként azonosított csak kivételek lehetnek a szabály alól. Úgy tűnik, hogy ez a helyzet, mivel erős bizonyíték van arra, hogy a CLC-3–tól a CLC-7-ig 2CL-/H+ csere transzporterként működik, elsősorban az intracelluláris organellákban, míg a CLC-1, CLC-2, KA és KB valódi plazmamembrán-kloridot vezető ioncsatornák5-9. Mivel az archetipikus CLC tulajdonság a csere-transzport, amely a sejtes élet minden formájában megtalálható, a fehérjék utóbbi alosztálya, a jóhiszemű kloridcsatornák ezért törött kloridtranszportereknek tekinthetők, amelyek elvesztették a kloridtranszport összekapcsolását egy második szubsztrátion mozgásával.
CLC-1
a CLC család alapítója a vázizomzat feszültségfüggő kloridcsatornája, amely a membránpotenciál szabályozására és a membrán repolarizálására szolgál az akciós potenciálok után az izom ellazítására. A legtöbb szövetben azt várnánk, hogy a káliumcsatornák ezt a szerepet játsszák, amit a szív-és simaizomban, valamint más sejttípusokban a membrán ingerlékenységének szabályozásában. A keresztirányú tubulus rendszer a plazmamembrán (sarcolemma) kiterjesztése, amely behatol a kontraktilis szövetbe. Kritikus fontosságú az elektromos aktivitás gyors terjedése szempontjából az izomban, és gyors és ellenőrzött összehúzódást szervez. A kálium kiáramlása az izomsejtekből a T-tubulus zárt terébe megemelné az extracelluláris káliumkoncentrációt és összeomlaná ezt az iongradienst, ami hosszabb membrán depolarizációhoz vezetne. A kloridcsatornák domináns repolarizáló szerepet játszanak, ez megakadályozható. A CLC-1 funkciómutációinak elvesztése myotonia kialakulásához vezet emberben, kecskékben és egerekben (lásd a legutóbbi áttekintést10), és az izomrelaxáció károsodása jellemzi, összhangban a repolarizáló membránáram elvesztésével.
a vázizomra korlátozódó expresszióval a CLC-1 vonzó célpont lehet azoknak a gyógyszereknek, amelyek szabályozzák az izomösszehúzódást a CLC-1 funkció növelésével vagy csökkentésével, ezáltal csökkentve vagy növelve az izom ingerlékenységét. A CLC-1 funkciót növelő vegyületek képesek lehetnek a myotonia kezelésére, különösen azokban az esetekben, amikor kompenzálhatják a kloridcsatorna aktivitásának részleges elvesztését. A CLC-1 gátlása csökkentheti az izomösszehúzódás küszöbértékét, és hasznos lehet izomgyengeség vagy degeneratív betegségek, például izomdisztrófia esetén.
CLC-2
a befelé egyenirányító kloridcsatorna, a CLC-2, kissé elterjedt szöveti eloszlással rendelkezik. Megtalálható a központi neuronokban, ahol szabályozza az idegsejtek aktivitását11-13. Az asztrocitákban a sejtcsomópontok szubcelluláris célzását a GlialCAM-mal (MLC1) való kölcsönhatás szabályozza, amelyek mutációi megzavarják ezt a célzást és megalencephalicus leukoencephalopathiát okoznak14. A legújabb terápiás érdeklődés magában foglalja a CLC-2 expresszióját a bél nyálkahártyájában és a tüdő bronchioláiban, ahol szerepet játszik a bél és a tüdő váladékában. A lubiprostone-t, a székrekedés enyhítésére klinikailag alkalmazott gyógyszert javasolták a CLC-2 aktiválásával, de ez a hatás ellentmondásos. Míg ez a vegyület egyes vizsgálatokban aktiválja a CLC-2 csatornákat, másokban szabályozza a CLC-2 kereskedelmet és növeli a CFTR funkciót a prosztaglandin receptor aktivációján keresztül15,16. Azonban továbbra is elegendő bizonyíték van arra, hogy a légúti CLC-2 funkció növelése alternatív klorid utat biztosíthat cisztás fibrózisban17.
CLC-KA/KB
ezek a kloridcsatornák kifejezetten a vese epitheliájában expresszálódnak, és hozzájárulnak a sejtmembránok passzív kloridfluxusba való permeabilitásához. Kulcsszerepük van a nephron emelkedő végtagjában és disztális tubulusaiban, biztosítva a klorid reabszorpciójának bazolaterális útját az elsődleges vizeletből az apikális membránon keresztül történő szállítás után. A CLC-KB-t kódoló CLCKB gén egyike annak az öt génnek, amelyek a Bartter-szindróma alapját képezik. A CLC-KB funkcióvesztés mutációi hibás klorid reabszorpciót eredményeznek, így sópazarló rendellenességhez vezetnek, amely poliuriával jár. A CLC-KB mutációk által érintett egyének egyik fő jellemzője (Bartter III. A betegség súlyosabb formáját a BSND gén mutációi okozzák (Bartter ‘ S Type IV), amely a Barttin-t, egy kiegészítő fehérjét kódolja, amely fontos mind a CLC-KA, mind a KB plazmamembránhoz való kereskedelmében18. A rendellenesség ezen formája magában foglalja az érzékszervi süketséget is, amelyről azt gondolják, hogy mind a CLC-KA, mind a KB kereskedelme a belső fül hámmembránjaihoz vezet. Feltehetően a CLC-KA vagy a KB aktivitás elvesztése, de nem mindkettő tolerálható a hallórendszer által. Ez arra utal, hogy a CLC-KA-ra vagy a CLC-KB-ra szelektív inhibitorok, vagy mindkettő részleges gátlása új hurok diuretikumként működhet, amely csökkentheti a vérnyomást és kevés mellékhatással jár. Ez vezetett farmakológiájuk tanulmányozásához és új, alacsony mikromoláris affinitású inhibitor származékok kifejlesztéséhez19, amelyek patkányoknak adva diuretikus hatást fejtettek ki20. Másrészt a CLC-KB csatornákat aktiváló gyógyszerek fokozhatják a hibás csatornák maradék aktivitását Bartter III-as típusú betegeiben.
CLC-7
a 2CL–/H+ csere transzporter alosztályból a CLC-7 ígéretes célpont a gyógyszerhatás szempontjából, gátlása előnyös lehet csontritkulás esetén. Ez a jelzés még egyszer a CLC-7 funkcióvesztési mutációi által okozott emberi betegség megfigyeléseiből származik, amelyek osteropetrosist okoznak21. Ebben a rendellenességben az osteoclastok által okozott csont-átalakítás hiányos, amelyet a hibás sav-és enzimszekréció okoz. Ez sűrű csonthoz vezet,amely CLC-7 inhibitorral reprodukálva csökkentheti a csont feloldódását, ezért erősítheti az osteoporosisos betegek csontvázát22, 23. A proof-of-concept vizsgálatokban a savasodás farmakológiai gátlása24 vagy a CLC – 7 funkció megzavarása antibodies25 csökkentette a csontreszorpciót. A CLC-7 gátlás azonban nem lehet komplikációmentes, mivel humán és egér vizsgálatok arra utalnak, hogy a CLC-7 funkció hiánya a csökkent lizoszomális funkció miatt neuronális tárolási és degenerációs rendellenességekkel is összefügghet26.
funkcióvesztés emberi mutációk – a CFTR tanulságai
ezen a ponton érdemes egy rövid szünetet tartani annak megfontolására, hogy az új CLC-célzott gyógyszerek terápiás javallatainak egy része a spektrum különböző és ellentétes végén lévő rendellenességek kezelésére irányul, mint azok, amelyeket a hibás CLC funkció okoz. A fent leírtakon kívül a Dent I-kór egy X-hez kapcsolódó vesebetegség, amelyet a CLC-5 funkció elvesztése okoz (lásd 27 egy közelmúltbeli áttekintéshez). Mindegyik ritka öröklött rendellenesség, és a fő fehérjehiány vagy csökkent fehérjeaktivitást, vagy a célmembránra irányuló kereskedelmet foglal magában. Valójában sok egyedi mutáció ER-retenciót és a fehérje érésének hiányát okozza. Párhuzamot lehet tenni a cisztás fibrózissal, az érintett személyek többségével, akik rendelkeznek az ER-visszatartott KB 508 mutáció. A cisztás fibrózis kezelésének legújabb és rétegzett megközelítései a mutáns fehérje hajtogatásának (CF korrektorok) korrigálására és/vagy a plazmamembrán CFTR-klorid csatornák (CF potenciátorok) aktivitásának növelésére irányuló kettős ágú támadás eredménye. Siker mutatkozik a potenciátor osztályban28, amelyek hatékonyak olyan mutációkban szenvedő betegeknél, amelyek csökkentik a CFTR aktivitását a fehérje bioszintézisének vagy kereskedelmének elvesztése nélkül (pl. G551D), azonban a hajtogatási korrektorok hatékonysága (amelyre az esetek többségében szükség van) még meg kell állapítani29. Bár a CLC funkció elvesztésével járó betegségek mind ritka genetikai rendellenességek, egy nap képesek lehetünk myotonia, Bartter-szindróma, Dent-kór és osteopetrosis, valamint cisztás fibrózis kezelésére olyan gyógyszerekkel, amelyek korrigálják rendellenességük tényleges okát.
kalcium-aktivált klorid csatornák
végül megemlítjük a kalcium-aktivált klorid (ClCa) csatornákat, amelyeknek egyértelműen meghatározott fiziológiai szerepük van számos sejttípusban, molekuláris azonosításuk azonban néhány hamis és dadogott kezdést szenvedett. A történet négyféle fehérjét tartalmaz: a CLCA, a Bestrophin, a Tweety és a TMEM16 géncsalád tagjai. Rekombináns túlexpressziójuk minden esetben membránklorid áramok képződését eredményezte, amelyeket az intracelluláris kalciumkoncentráció emelése és változó mértékben a membrán depolarizáció stimulál. A CLCA útja akkor ért véget, amikor kiderült, hogy ez egy olyan fehérje, amely kiválasztódott, de valószínűleg a clca csatornák membrán expresszióját is szabályozta endogén az expressziós rendszerhez30. A Tweety és a Bestrophin fehérjék nem mutatják a főbb szövetekben vizsgált ClCa csatornák összes tulajdonságát,bár a Best1 felelősnek tűnik a clca egyik összetevőjéért az érzékszervi neuronokban31 és fontos szabályozója lehet a kalcium felszabadulásának az endoplazmatikus retikulumból32, 33. Három független tanulmány javasolta a tmem16a-t (más néven Ano1) jelöltként egy fő komponensre, ha nem teljes egészében, egy kalciummal aktivált kloridcsatornára34-36. Számos későbbi tanulmány, amelyet a molekuláris eszközök generálása elősegített, támogatta ezt. A tmem16a fontos a vaszkuláris simaizomban a membrán ingerlékenységének szabályozásában, a pulmonalis hypertonia állati modelljében szabályozva van, és a tónus csökkenthető a csatorna gátlásával37, 38. A szenzoros neuronokban a tmem16a összekapcsolja a gyulladásos mediátorok jelenlétét a membrán hiperexcitabilitásával, a TMEM16A gátlásnak pedig antinociceptív hatása van39. Az asztma állatmodelljeiben ennek a kloridcsatornának az expressziója fokozódik, és gátlása jótékony hatással lehet40. A bél Cajal intersticiális sejtjeiben is megtalálható, és csatorna funkció szükséges a simaizom ritmikus összehúzódásához a bél falában41. Ezenkívül a TMEM16A aktiváció alternatív utat biztosíthat az epitheliális klorid szekrécióhoz cisztás fibrózisban42. Bár még mindig van némi vita a tmem16 család többi tagjának pontos funkciójáról, a ClCa funkciót a TMEM16B-nek (Ano2) is tulajdonították, amelyről úgy gondolják,hogy a clca csatorna alapja a szagló szőrsejtekben43, 44. Az ioncsatorna ezen osztályának szerepe lehet a rákos sejtek biológiájában is, gátlása megakadályozhatja a sejtek proliferációját45-48.
Záró megjegyzések
ez az áttekintés rávilágított a kloridnak a fehérjéket vezető vagy transzportáló szerepére, valamint arra, hogy ezek diszfunkciója hogyan kapcsolódik az emberi rendellenességekhez vagy betegségszerű tünetekhez állatmodellekben. Súlyos hiány van olyan farmakológiai reagensekből, amelyek gátolják, aktiválják vagy javítják a kloridcsatornák és transzporterek membránkereskedelmét. Előrelépés történik olyan gyógyszerekkel, amelyek megfordítják a CFTR hibás működését cisztás fibrózisban, ami remélhetőleg olyan gyógyszereket eredményez, amelyek specifikusak az öröklött mutáció különböző típusaira. A tmem16a kalcium-aktivált kloridcsatornák42,49 inhibitorai és aktivátorai hasznos laboratóriumi eszközöknek bizonyulnak, és az új vegyületek hatékony gyógyszereket hozhatnak létre, különösen, ha szövetspecifikus hatásokat tudnak kifejteni. Az egyes CLC-kre specifikus molekulák valószínűleg a leginkább megfoghatatlanok. A feszültségtől függő CLC aktiváció szerkezeti alapjának megértése50 azonosíthatja azokat a fehérjedoméneket, amelyeket racionális szerkezet-alapú gyógyszertervezés céloz meg. Ezek az eszközök lehetővé teszik számunkra, hogy az itt áttekintett és bemutatott új terápiás ötleteket teszteljük.
szerző életrajz

Dr. Jon Lippiat a leicesteri Egyetemen doktorált a káliumcsatornák szerkezetéről, funkciójáról és farmakológiájáról. A hasnyálmirigy béta-sejt működését és a cukorbetegséget tanulmányozta az Oxfordi Egyetemen, mielőtt kinevezték a Leeds-i Egyetem Farmakológiai előadójává. Kutatásai során számos különböző típusú ioncsatorna és transzporter szerkezeti és fiziológiai tulajdonságait, valamint új farmakológiai reagensekkel történő potenciális célzását vizsgálja.
kiadás
kiadás 4 2013
kapcsolódó témák
Kloridcsatornák, kábítószer-célpontok, ioncsatornák