rokon antigén elkötelezettség parenchymás sejtek stimulálja CD8+ T-sejt proliferáció in situ
- rokon CD8+ T-sejtek találhatók LN és gyulladt szövet
- a CD8+ T-sejtek a gyulladás helyén tágulnak
- a rokon kölcsönhatás a szigetekkel elősegíti a terjeszkedést
- a rezidens leukocitákkal való rokon kölcsönhatás nem szükséges
- a parenchymás sejtekkel való rokon kölcsönhatás fontos
- a T-sejtek a gyulladás helyén szaporodnak
- a parenchymás sejtekkel való rokon kölcsönhatás vezet proliferáció
- az IL-2 fontosabb a gyulladás helyén
rokon CD8+ T-sejtek találhatók LN és gyulladt szövet
a kezdeti kísérletek (ábra. 1) létrehoztunk egy modellt, amelyben a CD8 T-sejt válaszok egy parenchymás antigénre, ovalbuminra (OVA) lehet elemezni. Az OT-I egerek transzgenikus TCR-t expresszálnak, amely közvetíti az MHC I. osztályú h-2kb molekulán bemutatott OVA257-264 peptid CD8+ T-sejt felismerését. A CD8 T-sejteket OT-i/CD45.1 egerekből dúsítottuk, CFSE festékkel jelölt, majd IV.útján adoptívan átvittük a B6 (CD45. 2+) gazda egerekbe. Az örökbefogadottan átvitt T-sejteket CD45.1 festéssel lehetett megkülönböztetni a gazdasejtektől (valamint az OT-I TCR CD8 és Va2 láncát), míg a CFSE-festék hígítást alkalmazták a proliferált sejtek azonosítására (például Fig. 1a, kiegészítő ábra. 1). A parenchimális antigént B6 oltással vezettük be.az OC-szigetek (az ilyen szigetek petesejteket fejeznek ki parenchymás oc-sejtekben a patkány inzulin promoter alatt, 1. Kiegészítő táblázat) az OT-I/CD45.1 T-sejteket már kapott gazdaszervezet-egerek vesekapszulája alatt. Mindhárom forrás (gazdaszervezet, T-sejt donor és szigetecske donor) B6 háttérrel rendelkezik, ezért expresszálja a H-2kb-t. Így, bár a petesejtek antigén expressziója csak az oltott CAC sejtekre korlátozódott, feltételeztük,hogy az LN alapozásához és talán a helyi T-sejt válaszokhoz szükség lenne a nem parenchymás APC, például DC-ből származó petesejtek bemutatására17, 18.

osztott OT-i sejtek (életképes CD45.1+CD8+ Va2 + gate) a vese LN és a graft elvezetésében 3 vagy 6 nappal a 400 B6 egyetlen graft beérkezése után.hosszú-szigetek. a) reprezentatív áramlási citometriás diagramok. Az osztatlan OT-i csúcs helyzetét a B6 sziget graft antigén nélküli kontrolljával határoztuk meg. (b) a megosztott OT-I teljes száma a vese LN-ben és a graftban, ahol minden pont egy egyedi egeret képvisel. Hét független kísérlet összesített adatai: n=8 graft-recipiens a 3.napon és n=14 graft-recipiens a 6. napon. Egy nap az 6 graft elveszett az áramlási citométer meghibásodása miatt. A vízszintes sávok eszközök, A P értékeket párosítatlan, Kétfarkú t-teszttel számítottuk ki Welch korrekciójával.
a CD8+ T-sejtek a gyulladás helyén tágulnak
amint az várható volt, először erős OT-I választ észleltek a vese Ln-ben, amely kiszívja a graft helyét, és ez az OVA antigén jelenlététől függött (ábra. 1a, b). A graft után 3 nappal megosztott OT-I kimutatható volt a B6-ot ürítő LNs-ben.ojtorján-szigeti oltványok (ábra. 1a) és bőséges volt (Fig. 1b, átlag=9,2 (104). Ezzel szemben 100-szor kevesebb megosztott OT-i sejtet lehetett kimutatni a B6-on belül.xhamova oltványok (ábra. 1a,b, átlag=6,6 602. A megosztott OT-i sejtek száma 300-szorosára nőtt a graft helyén a 3.naptól a 6. napig (ábra. 1b, átlag=6,6 102 fő a 3. napon-2,1 fő 105 fő a 6.napon, P<0,0001, párosítatlan Kétfarkú t-teszt Welch korrekciójával), míg az LN-ben nem volt növekedés (ábra. 1b). Az OT-I válasz a B6-ban.az ln-ben elszaporodó ot-i sejtek beszivárgásával magyarázható az OC graft. A CFSE profilok azonban különböztek a graft és az LN helyei között, mivel a graftok OT-i sejtjei nagyobb mértékben osztódtak, mint az LN sejtjei a 6.napon (ábra. 1a). Ennek a különbségnek legalább két lehetséges magyarázata van. Csak a sokszor megosztott sejtek szivárogtak be a graftba. Alternatív megoldásként a graftot elérő sejtek gyorsabban osztódnak, valószínűleg a rendelkezésre álló antigén bősége miatt. A graft abszolút sejtszámának növekedése az LN-hez képest a 6.napon arra késztetett minket, hogy megvizsgáljuk ezt az utóbbi magyarázatot.
a rokon kölcsönhatás a szigetekkel elősegíti a terjeszkedést
a rokon MHC lehetséges hozzájárulásának meghatározása a graftban a helyi terjeszkedéshez a bm1-ből származó szigeteket használtuk.multinova egerek (1. Kiegészítő táblázat). A bm1-ben.a H-2kbm1 molekula három h–2kb mutáció miatt nem képes bemutatni az OVA257-264 peptidet (ref. 19). A B6-ra adott válaszok összehasonlítása.6 és bm1.a 6clova – sziget oltványai azt mutatták, hogy a hasonló OT-i válaszok ellenére a leeresztő vese LN-ben az OT-I expanziója hatszorosára csökkent a bm1-ben.B6-hoz képest.6ova graftok (átlag=4.7 604-es számú, szemben a 2,6-os 105-ös számú, osztott OT-I-vel; P=0,0153 párosítatlan Kétfarkú t-teszt Welch-féle korrekcióval; ábra. 2a). Ez a kevésbé hatékony bővítése OT-i sejtek beszivárgó bm1.a ons azt javasolta, hogy az oltott szigetsejtekkel való rokon kölcsönhatások hozzájáruljanak a helyi T-sejt terjeszkedéshez.

az OT-I sejtek áramlási citometriás elemzése (életképes CD45.1+CD8+Va2+ kapu) 6 nappal a graft után. (A) összesen osztva OT-I a elvezetését vese LN és graft kézhezvételét követően egyetlen graft 400 B6.6ova vagy bm1.hosszú-szigetek. Adatok B6.az 6ovával oltott egerek az ábrán látható részhalmaza. 1b. minden pont egy egyedi egeret képvisel. Két független kísérlet összesített adatait mutatjuk be minden panelen: n=5 B6 címzett.6 bm1 recipiens.ojtott graftok. A vízszintes sávok eszközök, A P értékeket párosítatlan, Kétfarkú t-teszttel számítottuk ki Welch korrekciójával. (b) a bipoláris graft modell vázlata, amelyben 200 szigetecske oltványai ugyanazon vese ellentétes pólusain helyezkednek el, és közös elvezetésű vese LN-vel rendelkeznek. Összesen osztva OT-I A (c) B6.a kbko és a kbko.d) bipoláris graftok és D) B6.az azonos egérre vonatkozó adatokat szaggatott vonalakkal kapcsoljuk össze a (két független kísérletből származó n=5 recipiens egér mindegyik c és d) bipoláris graftok esetében: a P értékeket arányosan párosított t-teszttel számítottuk ki.
a H-2kbm1 alloantigen hozzájárulásának kiküszöbölése érdekében kbko-t hoztunk létre.a szigetecske béta-sejtjeiben petesejt antigént expresszáló, de alloantigént vagy H-2kb-t nem tartalmazó egerek (1.Kiegészítő táblázat). Ezután egy ‘bipoláris graft modellt’ használtunk a B6-ra adott válaszok összehasonlítására.a kbko és a kbko.a B6 gazdaegérben ugyanazon vese ellentétes pólusaira helyezett, graft-infiltráló T-sejtek ugyanazon LN-ben alapozott T-sejtekből származtak (ábra. 2b). 10-100-szor több T-sejt volt jelen a B6-ban.ha igen, akkor kbko.xhamova oltványok (ábra. 2c). Az osztott OT-i arányának felhasználásával a vese ellentétes pólusain az egyes egerekre számítva relatív válaszarányt (RRR) nyertünk. Az RRR azt jelezte, hogy a helyi T-sejt expanzió 26-szor nagyobb volt, amikor a graft sejtekkel való rokon kapcsolódás történt (RRR=26, 4 64, 1 A B6-ban.6ová: KbKO.xhamova graftok, P=0,0025, Arány páros t-teszt, ábra. 2c).
összehasonlítottuk a bipoláris B6-ra adott válaszokat is.ons és B6 (nincs antigén) graftok (ábra. 2d). Nagyon kevés OT-I kimutatható volt a B6 graftokban (ábra. 2d), és valószínűnek tartjuk, hogy ezek közül sok vérszennyeződésből származó OT-I keringett. Így az antigénhiányos graftok transzplantációjával járó nem specifikus gyulladás nem vezet hatékony T-sejt expanzióhoz a gyulladt szövetben. Ezzel szemben a B6-ra adott válasz.a 6-6-os oltványok ismét nagyon hatásosak voltak, és több mint 900-szor nagyobbak, mint a B6 oltványok (RRR=950 252 a B6 esetében.6 graftok, P<0,0001, páros arányú t-teszt, ábra. 2d).
ezek a kísérletek együttesen azt mutatták, hogy a CD8 T-sejt terjeszkedését a gyulladt célszövetben jelentősen elősegítette a helyi antigén bemutatása. Ez nem feltétlenül zárja ki a T-sejt terjeszkedéséhez való Egyéb hozzájárulásokat, például a gazda DC keresztbemutatásával a graftban. Mi csak aver, hogy rokon kölcsönhatás a T-sejtek és szigetsejtek eredményez jelentős T-sejt expanzió.
a rezidens leukocitákkal való rokon kölcsönhatás nem szükséges
a szigetek összetett sejtcsoportok, amelyek magukban foglalják a következők: sejtek, endothel sejtek és szigeti rezidens leukociták (IRL). Ezért legközelebb arra törekedtünk, hogy tisztázzuk, mely szigetsejtek mutatták be az antigént az infiltráló T-sejtekhez a T-sejt terjeszkedésének elősegítése érdekében. A legnyilvánvalóbb jelölt az IRL lenne. Ezeket a CD45 + sejteket különböző módon DC vagy makrofágokként definiálták, együtt expresszálják a CD11c-t és az F4/80-at, és kimutatták,hogy feldolgozzák és jelen vannak antigének20,21,22, 23. Ezért megvizsgáltuk a donor IRL szerepét a helyi CD8 T-sejt expanzió vezetésében. B6.az auclova egereket CD11c.DTR-re keresztezték.GFP egerek a CD11c.DTR előállításához.GFP.a diphtheria toxin (DT) injekcióval ablálhatóak azok az egerek, amelyeknek a diphtheria toxin (DT) injekciójával a diphtheria toxin (DT) cd11c+ sejtjei expresszálják a petesejteket.8. Először a CD11C.DTR-ből izolált FACS szigetekkel teszteltük.A DT-vel kezelt GFP egerekben a CD11c+ sejtek kimerültek (ábra. 3a,b). A kezeletlen kontroll egerekben a CD11c+ IRL-t a CD45 és CD11c festéssel, valamint a GFP riporter expressziójával azonosították, és a DT kezelés egyértelműen kimerítette őket (ábra. 3a, b, P=0,0002, párosítatlan Kétfarkú t-teszt Welch korrekciójával). Azt is megerősítették, hogy a CD11c+IRL együtt kifejezett F4/80 és H-2 Kb MHC class I (kiegészítő ábra. 2a), következésképpen az F4/80+ sejtek is kimerültek a DT-vel kezelt egerek szigeteiből (kiegészítő ábra. 2b). CD11c. DTR.GFP.a kezeletlen és a DT-vel kezelt egerekből izolált ons-szigeteket ugyanazon vese ellentétes pólusaira oltották be. A megosztott OT-I szám hasonló volt a graftok között, jelezve, hogy az IRL kimerülése nem volt hatással a CD8+ T-sejt expanzióra a graft helyén (ábra. 3c). Annak megerősítésére, hogy az IRL nem volt fontos a helyi CD8 T-sejt expanzió szempontjából, elvégeztünk egy második kísérletsorozatot. KbKO.az a tény, hogy a H-2kb expresszió nem volt jelen az összes sejtben, vagy szelektíven visszaállt IRL-re (ábra), azt a kbko vagy B6 csontvelővel (BM) oldották fel. 3d). Az ilyen szigetek összehasonlítása a bipoláris graft modellben az OT-I sejtek terjeszkedésének hasonló szintjét mutatta mindkét graftban (ábra. 3e). Ezért az IRL nem a helyi CD8 T-sejt terjeszkedésének fő mozgatórugója.

áramlási citometriás elemzés, amely a CD11c+ IRL kimerülését mutatja A CD11c.DTR-ben.DT-vel kezelt GFP egerek: a) reprezentatív ábrák, amelyek a kezeletlen kontroll egerekből származó Szigetecskékben a CD11c+IRL-t mutatják, és ezek kimerülése az egyetlen DT-kezelést követő napon, valamint b) A CD11c+IRL felsorolása kezeletlen és DT-vel kezelt egerekben. Minden egyes pont egy egyedi szigetecske-készítményt jelent, amely 1-8 egérből álló egyesített szigetecskéket, n=5 kezeletlen szigetecske-készítményt és 6 DT-vel kezelt szigetecske-készítményt tartalmaz négy független kísérletből. P érték párosítatlan, Kétfarkú t-teszttel, Welch-korrekcióval számítva. (c) teljes megosztott OT-I 6 nappal a cd11c.DTR-ből nyert szigetek bipoláris graftja után.GFP.DT-vel kezelt vagy kezeletlen (n=6 recipiens egér két független kísérletből). Ugyanazon egér adatait szaggatott vonalak kötik össze; p értékek arányosan párosítva T-teszt. D) A Kbko-val vagy B6 BM-mel feloldott kbko egerek CD11c+IRL-jén H-2kb expresszió hiányát vagy jelenlétét mutató reprezentatív ábrák. Életképes sejteken pregálva. (e) teljes osztott OT-I 6 nappal a kiméra egerekből nyert szigetek bipoláris graftja után (n=3 recipiens egér egyetlen kísérletből). Ugyanazon egér adatait szaggatott vonalak kötik össze; P értékek arányosan párosított t-teszttel számítva.
a parenchymás sejtekkel való rokon kölcsönhatás fontos
B6.A rip-Kb egerek transzgenikusan expresszálják a H-2kb-t a patkány inzulin promoter24 kontrollja alatt. Átkelve ezeket az egereket a KbKO-ba.mi kbko-t hoztunk létre.6ova.ha a H-2kb expresszió csak a főcella (1.Kiegészítő táblázat). A H-2KB expresszióját a sejteket a szigetek FACS elemzésével igazolták (ábra. 4a). Szigetsejt hematopoietikus sejteken (CD45+) és endothel sejteken (CD31+) kapuztunk, és kimutatták, hogy a H-2kb nem expresszálódik ezeken a sejteken egyik KbKO-ban sem.oc vagy kbko.6ova.a B6 egerek erős expressziójához képest (ábra. 4a). A fennmaradó CD45-CD31-sejtek autofluoreszcens pozitívak és endokrin sejtekben dúsulnak. A KbKO szigeteinek FACS elemzése.6ova.az adapterek h-2KB expressziót mutattak a dúsított autofluoreszcens populációban a B6-szigeteken tapasztaltakhoz hasonló szinten (ábra. 4a). A bipoláris graft modell összehasonlítása azt mutatta, hogy az OT-I expanziója 14-szer nagyobb volt, ha rokon antigént expresszáltunk a kb sejtek (RRR=14,0 kb 4,1 a KbKO esetében.6ova.kb: kbko.xhamova graftok, P=0,0008, Arány páros t-teszt, ábra. 4b).

(A) áramlási citometriás parcellák (életképes sejteken kapuzva), amelyek a H-2KB expresszió szelektív helyreállítását mutatják parenchymás sejteken. A hisztogramok a kbko (árnyékolt), A B6 (szaggatott) vagy a KbKO szigeteit képviselik.ons (vastag) egerek. (b) teljes megosztott OT-I a kbko bipoláris graftját követő 6 napon belül.a kbko és a kbko. 6ova.ons. szigetek (n=6 recipiens egér három független kísérletből). Ugyanazon egér adatait szaggatott vonalak kötik össze; p értékek arányosan párosítva T-teszt.
a T-sejtek a gyulladás helyén szaporodnak
a fenti eredményeink azt mutatják, hogy a célhelyen lokális proliferáció volt. Az aktívan szaporodó sejtek kimutatása érdekében az OT-I /CD45.1 egereket fuccirg egerekbe kereszteztük, hogy FucciRG/OT-I/CD45-et generáljunk.1 egér (rövidítve FucciOT-I). Az ilyen egerekben a sejtek vörös (FucciR) fluoreszkálnak G0/G1 és zöld (FucciG) az S/G2/M sejtciklus fázisában25,26. A FucciR és a FucciG riporterek fokozatos lebomlása és felhalmozódása a ciklusfázisok közötti átmenet során további megkülönböztetéseket tesz lehetővé: intenzívebb FucciR expresszió nyugalmi G0−ban a ciklikus G1 sejtekkel szemben, kettős negatív FucciR− G-sejtek a nagyon korai G1-ben, és gyengén kettős pozitív FucciR+G+ sejtek a G1/S-ban (refs 26, 27). Nyugalmi FucciOT-I sejtek be nem oltott egerek voltak FucciG – (ábra. 5A, felső panel, be nem vésett). A Fucci festékekkel való interferencia elkerülése érdekében a CFSE-t CTV-vel helyettesítettük. Olyan egerekben, amelyek B6-ot kaptak.a CTV hígítás analízise azt mutatta, hogy az osztott FucciOT-I jelen volt a leeresztő vese LN-ben, és ezek közül néhány fuccig+ aktív sejtosztódásra utal (ábra. 5A, felső panel, leeresztő LN). A graft helyén olyan FucciOT-I-t detektáltunk, amely sok osztódáson ment keresztül (a CTV már nem észlelhető), és ezek közül sok FucciG+ támogatta a folyamatos proliferációt (ábra. 5A, felső panel, friss graft). A fuccig+ sejtek arányának összehasonlítása a megosztott OT-I populáción belül (ábra. 5c) jelezte, hogy a friss oltványokon belüli folyamatos proliferáció (26,8 ~ 8,8% FucciG+) meghaladta a leeresztő vese LN-t (7,3 ~ 1,6%, P=0,008, párosítatlan Kétfarkú t-teszt Welch korrekciójával) vagy a nem ürítő vese Ln-t (2,1 ~ 2,1%, P=0,003, párosítatlan Kétfarkú t-teszt Welch korrekciójával). Valójában mind a FucciG, mind a FucciR expresszió vizsgálata azt mutatta, hogy a legtöbb graft-infiltráló OT-i aktívan osztódott, vagyis nagyon kevés sejt mutatott magas FucciR expressziót, amely jellemző volt a nyugalmi sejtekre a Be nem oltott egerek LN-jében (ábra. 5A, alsó panelek). Bár feltételeztük, hogy ez a proliferáció a gyulladás helyén in situ keletkezett, nem tudtuk teljesen kizárni annak lehetőségét, hogy ez egyszerűen a proliferáló sejtek közelmúltbeli érkezését tükrözi. Ennek tisztázása érdekében betakarítottuk a B6 bipoláris oltványait.az egyik graftot közvetlenül a kivágás után elemezni kell, a másik graftot pedig 1 napig tenyészteni (ábra. 5a). Míg az OT – I száma nem nőtt a kultúra időszakában (ábra. 5B), feltehetően a sejthalált tükrözve szuboptimális ex-vivo körülmények között, sok FucciG + OT-i sejtet továbbra is kimutattak (14,2 kb 4,2% FucciG+, ábra. 5c). A tenyésztett graft profilja, egy napra történő lehetséges toborzás nélkül, azt jelzi, hogy magas volt de novo proliferáció a graftban.

(a) sematikus és reprezentatív áramlási citometriás diagramok (életképes CD45.1+CD8+Va2+ limfocitákon kapuzva), amelyek a fucciot-I sejtek válaszát mutatják vese LNs-ben vagy bipoláris B6-ban.ojtott graftok. Az LNs-t és az egyik pólus graftját azonnal megvizsgáltuk (frissen a graft után 6 nappal), míg az ellenkező pólus graftját az elemzés előtt 1 napig tenyésztettük. Egy be nem oltott egér LN-jét bevontuk, hogy megmutassuk a szétválás hiányát és a Fuccir expressziót (felső panel), valamint a fuccir magas sejtek túlsúlyát (Alsó panel) nyugalmi FucciOT-I-ben. (b) teljes megosztott FucciOT-I friss és tenyésztett graftokban. Átlag+s. d., n=5, P értékek kiszámítása Kétfarkú Arány párosított t-teszt. (c) % FucciG+ osztott OT-I friss, nem ürítő és graft elvezetését vese LN, valamint a friss és tenyésztett graftok. Átlag+s. d., n=5, kivéve a nem ürítő LN-t, amelyre n=4 egy Ln elvesztése miatt a feldolgozás során. A P értékeket Kétfarkú párosítatlan t-teszttel számítottuk ki Welch korrekciójával. Az adatok két független kísérletből származnak.
a parenchymás sejtekkel való rokon kölcsönhatás vezet proliferáció
ezután kihasználtuk a FucciOT-I modell előnyeit a T-sejt proliferációjának egy másik potenciális helyi mozgatórugójának szerepének felmérésére a graft, gazdaszervezetből származó APC, például gyulladásos DC. A host APC bármilyen hozzájárulásának kiküszöbölése érdekében először kbko hátteret származtattunk. Mivel a KbKO egerek elutasították az OT-I sejteket, a KbKO BM-et B6 kimérákká hoztuk létre, hogy gazdaként használhassuk; így a hematopoietikus sejtekből hiányzott a H-2kb, de megengedőek voltak az OT-I sejtekkel szemben. Ezeknek a chimaeráknak FucciOT-I T sejteket és kbko bipoláris graftokat adtak.a (H-2kb expresszió és így a petesejtek antigénjének bemutatására való képesség hiánya) és a kbko-szigetek.6ova.(mind a H-2kb, mind az OVA antigén csak a sejtek számára volt elérhető). Mivel a kimérából hiányzott a H-2kb pozitív APC, OVA257-264 peptidbevonatú lépsejteket kellett beadni az OT-I válasz megindításához. Ennek az alapozásnak a sikerét a CTV-hígítás mutatta a vese Ln FucciOT-I sejtjeiben, bár a betakarítás idején ezek FucciG-voltak, és úgy tűnt, hogy nem osztódnak aktívan (0,1 ~ 0,0% FucciG+, ábra. 6a,d). Nagyon kevés OT-i beszivárgott a KbKO-ba.a kbko-n belül egyértelműen kibővültek.6ova.ons (RRR 61,4 66,6 a kbko esetében.6ova.kb: kbko.xhamova, ábra. 6b, P=0,0008, Kétfarkú Arány páros t-teszt). Így még a rokon antigén hiányában is a gazda APC-n, a rokon antigén a parenchymás adapterek sejtjein elegendő volt a CD8 T-sejt expanziójának vezetéséhez a graft helyén. A kbko-ban jelen lévő néhány FucciOT-I T sejt.ßOVA graftok hasonlított az A, mind a hatékony progresszió, hogy a rendkívül megosztott frakció (Fig. 6a,c, 7,5 0,9% erősen osztva LN-re és 19,3 6,3% erősen osztva KbKO-ra.ojtott graftok) és a FucciG kifejezés hiánya (ábra. 6a, d, 0,1, 0,0% ln-ben és 0,1, 0,1% KbKO-ban.a graft helyén kis OT-I proliferáció fordult elő rokon antigén hiányában. Ezzel szemben az OT-I a KbKO-n belül.6ova.az ons graftok túlnyomórészt erősen megoszlottak (92,3 6,0%, ábra. 6a,c) és ezek közül néhány FucciG+ volt, és így aktívan szaporodott (ábra. 6a,d, 5,0 6,2%+). Ennélfogva, rokon antigén bemutatása szigetecske parenchymás sejtek által képes volt a fucciot-I de novo proliferációjának in situ vezetésére.

FucciOT-I válasz a kbko BM oltványaira B6 gazda egerekbe, amelyekben a gazda hematopoietikus sejtjeiben nincs H-2kb expresszió. Az oltott egerek az oltás napján peptidbevonatú lépsejteket kaptak az OT-I alapozás megindítása érdekében. (a) reprezentatív áramlási citometriás parcellák (életképes CD45.1+CD8+Va2+ limfocitákon kapuzva). A felső panel az osztódás hiányát és a FucciG expressziót mutatja nyugalmi OT-I in LN egérben, amelyet sem oltottak, sem alapoztak. Az alsó három panel egy bipoláris oltott és alapozott egér válaszát mutatja: a vese Ln elvezetése, KbKO.a kbko és a kbko.6ova.adapterek. Az oltott egerek megosztott sejtjeit két szektorra osztottuk, az erősen megosztott sejtek abba az ágazatba esnek, amelyben a CTV-t a kimutatási határon túl hígították. (b) összesen osztva FucciOT-I KbKO.a kbko és a kbko.6ova.ons bipoláris graftok, Kétfarkú Arány páros t-teszttel számított P értékek. (C) % erősen megosztott és (d) % FucciG+ OT-I a vese Ln elvezetésében és bipoláris oltott egerek graftjaiban. A P értékeket Kétfarkú páros t-teszttel számítottuk ki. Az egyes egerek eredményeit szaggatott vonalak kötik össze, n=6 recipiens egér két független kísérletből.
az IL-2 fontosabb a gyulladás helyén
megmutatjuk, hogy az IL-2RA expresszió fontosabb volt a CD8+ T-sejt proliferáció és felhalmozódás szempontjából a perifériás parenchyma (szigetecske graftok), mint az alapozás helyén az LN elvezetésében (ábra. 7a). Továbbá, elemeztük a választ egy második helyen, amely távol van az alapozás helyétől, vagyis, nem ürítő LN. Az OT-I. IL-2RAKO (IL-2RA-CD45.2+) és OT−i/Ly5.1 (IL-2RA+, CD45.1+ CD45.2+) egerek CTV-jelölt CD8+ T-sejtjeit együtt vitték át a B6.CD45.1 gazdaegerekbe (CD45.1+), mielőtt egyetlen B6 graftot kapna.hosszú-szigetek. Az átvitt T-sejtpopulációk különálló CD45 allél aláírásai (CD8 és Va2 festéssel kombinálva) lehetővé tették számunkra, hogy számszerűsítsük és összehasonlítsuk a megosztott WT:IL-2RAKO OT-I arányát (ábra. 7a, kiegészítő ábra. 3). Az IL-2RA WT egyértelműen felülmúlta az IL-2RA KO OT-I-t a graft helyén, mint bármelyik elvezetés (P=0,025, Kétfarkú párosított t-teszt) vagy nem elvezetés (P=0,044, Kétfarkú párosított t-teszt) LN. Ez összhangban van a CD8+ T-sejtek megnövekedett függőségével az IL-2-től a másodlagos antigénnel való találkozás idején a gyulladás helyén, összehasonlítva a lefolyó LN kezdeti alapozásával.
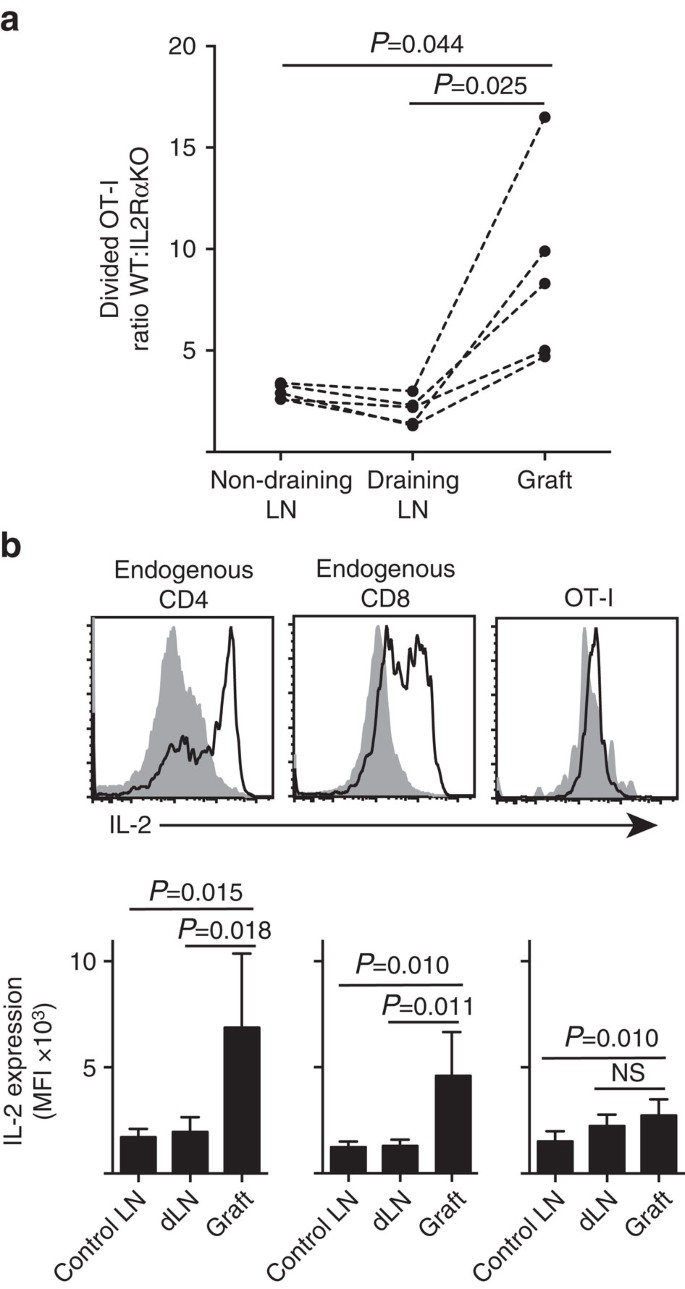
(a) A B6-ból kinyert osztott IL-2RA WT:IL-2RA Ko OT-i sejtek aránya.a vese LN-t és a nem ürítő inguinalis LN-t a B6.CD45.1 gazda egerekbe történő együttes transzfer után (mindegyikből 106). Az arányokat az egyes szervekre kiszámítottuk, szaggatott vonalakkal összekapcsolt egyes egerek eredményeivel, majd Kétfarkú páros t-teszttel hasonlítottuk össze. Az N=5 recipiens egerekre vonatkozó eredmények három független kísérlet reprezentatív eredményei. (B) IL-2 expresszió endogén CD4+ és CD8+ sejtekben és átvitt OT-i sejtek a B6 recipiensekben B6.ons-sziget oltványok. A felső panelek reprezentatív áramlási citometriás ábrákat mutatnak a graft draining renal Ln (szilárd szürke) és graft (fekete vonal) esetében. Az alsó panelek összefoglalják az IL-2 expresszió átlagos fluoreszcens intenzitását (MFI) a Be nem oltott (kontroll LN) vese LNs-jére, valamint az oltott egerek graftjára és elvezetésére szolgáló vese Ln-jére (dLN). Az eredmények átlag+SD, n=6 két független kísérletből összevonva, Kétfarkú párosítatlan t-teszttel összehasonlítva Welch korrekciójával.
az IL-2-től való fokozott függőség a CD8+ T-sejt proliferáció szempontjából a gyulladás helyén a helyi IL-2 termelés követelményére következtetett. Ezért megvizsgáltuk a különböző T-sejtek (endogén gazdaszervezetből származó CD4+ és CD8+, valamint átvitt OT-I CD8+ T-sejtek) potenciálját az IL-2 termelésére (ábra. 7b). A graftokból vagy LN-ből készített sejtszuszpenziókat rövid ideig (4 óra) restimuláltuk PMA-val és ionomicinnel, mielőtt festettük volna az intracelluláris IL-2 expressziójára. Az endogén gazdaszervezetből származó CD4 + és CD8 + T sejtek vizsgálata meggyőző bizonyítékot szolgáltatott az IL-2 termelésére a graft gyulladás helyén, az IL-2 festődés MPI-jének egyértelmű növekedésével a draining vagy a nem draining LN-hez képest. Az IL-2 szint az OT-I CD8+ T-sejtekben a gyulladás helyén mérsékelten emelkedett a nem ürítő LN-hez képest, de nem különbözött szignifikánsan a leeresztő LN-től. Ezeknek az adatoknak az egyik értelmezése az, hogy az OT-I rokon kölcsönhatása a parenchymás sejtekkel gyors proliferációt, de gyenge IL-2 termelést indukál, oly módon, hogy az OT-I függ az endogén CD4+ és CD8+ T sejtekből származó parakrin IL-2-től a helyi graft környezetben. Egy további kísérlet azonban azt mutatta, hogy az exogén IL-2 parenchymás antigén hiányában nem képes vezetni az OT-I CD8+ sejtek terjeszkedését. Az IL-2-t (rekombináns hIL-2, 25 000 NE) intraperitoneálisan adták be B6 egereknek, amelyek B6 bipoláris graftokat kaptak.a B6-os és a B6-os szigetek. Az IL-2-ből vagy vivőanyaggal kezelt egerekből kinyert szervek OT-i helyreállításának összehasonlítása az oltás után a 6.napon nem mutatott szignifikáns növekedést az osztott OT-i sejtek felhalmozódásában két olyan helyen, ahol nincs parenchimális antigén, nevezetesen a B6-sziget graftok (3 ~ 3 vivőanyaggal kezelt vivőanyagban, szemben az IL-2-vel kezelt egerekben 49 ~ 64-gyel, P=0.342) és nem ürítő inguinalis LN (1,648+633 a kezelt vivőanyagban, szemben az 1,660 + 1,023-mal az IL-2-vel kezelt egerekben, P=0,987, átlag 6d, n=3, Kétfarkú párosítatlan t-teszt Welch-korrekcióval).