Savak, bázisok és pH
|
|||||||||
savak és konjugált BÁZISAIK
emlékezzünk a sav Bronsted-Lowry definíciójára: a sav proton donor. Nyilvánvaló, hogy előző példánkban az ecetsav protonját h-nak adományozja2o az előremenő reakcióban, ami az acetátion képződését eredményezi. A fordított reakcióban azonban az acetátion Elfogad egy protont H-BÓL3O+ hogy visszatérjen Ch-vé3cooh. A Bronsted-Lowry definícióból egy bázis egy proton akceptor.
|
így az acetátion a fordított reakcióban bázisként működik, és az ecetsav konjugált bázisának nevezik. Az ecetsav és az acetátion sav-bázis konjugátum párként ismert. Érdekes módon a fenti reakcióban van egy második sav-bázis konjugált pár. Figyelje meg, hogy a fordított reakcióban H3O+ adományoz egy protont (savvá téve), míg az előremenő reakcióban H2O Elfogad egy protont (bázissá téve). A H2O és a H3O+ egy konjugált sav-bázis pár, a H3O+ a konjugált sav, a H2O pedig a konjugált bázis.
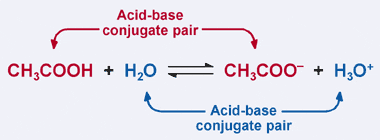
konjugált sav-bázis párban a konjugált savnak még egy protonja van, mint a megfelelő konjugált bázisnak.