17.3: La formazione di ioni complessi
L’effetto della formazione di ioni complessi sulla solubilità
Cosa succede alla solubilità di un sale scarsamente solubile se un ligando che forma uno stable complesso stabile viene aggiunto alla soluzione? Uno di questi esempi si verifica nella fotografia convenzionale in bianco e nero. Ricordiamo che la pellicola fotografica in bianco e nero contiene microcristalli sensibili alla luce di AgBr o miscele di AgBr e altri alogenuri d’argento. AgBr è un sale scarsamente solubile, con un Ksp di 5,35 × 10-13 a 25°C. Quando l’otturatore della fotocamera si apre, la luce proveniente dall’oggetto fotografato colpisce alcuni dei cristalli sulla pellicola e avvia una reazione fotochimica che converte AgBr in metallo nero Ag. Le immagini negative ben formate e stabili appaiono in toni di grigio, corrispondenti al numero di grani di AgBr convertiti, con le aree esposte alla luce più scure. Per fissare l’immagine e impedire che più cristalli AgBr vengano convertiti in metallo Ag durante la lavorazione del film, l’AgBr non reagito sul film viene rimosso utilizzando una reazione di complessazione per sciogliere il sale scarsamente solubile.
La reazione per la dissoluzione del bromuro d’argento è la seguente:
\
con
\
L’equilibrio si trova molto a sinistra e le concentrazioni di equilibrio degli ioni Ag+ e Br sono molto basse (7,31 × 10-7 M). Di conseguenza, rimuovere AgBr non reagito anche da un singolo rotolo di pellicola utilizzando acqua pura richiederebbe decine di migliaia di litri di acqua e una grande quantità di tempo. Il principio di Le Chatelier ci dice, tuttavia, che possiamo guidare la reazione a destra rimuovendo uno dei prodotti, che causerà la dissoluzione di più AgBr. Lo Brom bromuro è difficile da rimuovere chimicamente, ma lo silver argento forma una varietà di complessi stabili a due coordinate con ligandi neutri, come l’ammoniaca, o con ligandi anionici, come il cianuro o il tiosolfato (S2O32 -). Nell’elaborazione fotografica, l’eccesso di AgBr viene sciolto utilizzando una soluzione concentrata di tiosolfato di sodio.
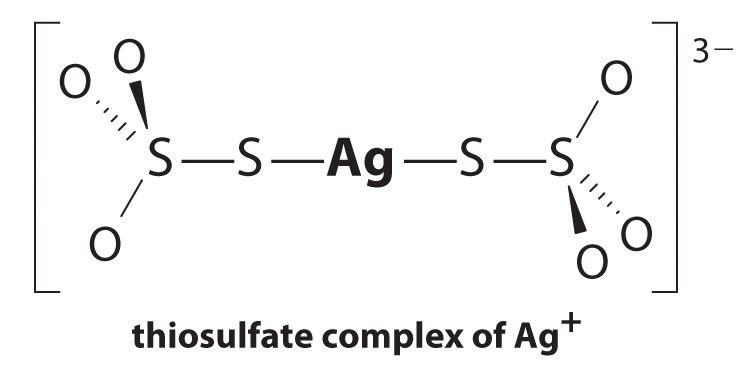
La reazione di Ag + con tiosolfato è la seguente:
\^{3−}_{(aq)} \ etichetta{17.3.5a}\]
con
\
L’entità della costante di equilibrio indica che quasi tutti gli ioni Ag+ in soluzione saranno immediatamente complessati dal tiosolfato per formare 3 -. Siamo in grado di vedere l’effetto di tiosolfato sulla solubilità di AgBr scrivendo le opportune reazioni e aggiungerli insieme:
\\ \mathrm{Ag^+(aq)}+\mathrm{2S_2O_3^{2-}(aq)}\rightleftharpoons\mathrm{^{3-}(aq)}\hspace{3mm}K_\textrm f&=2.9\times10^{13}
\\ \mathrm{AgBr(s)}+\mathrm{2S_2O_3^{2-}(aq)}\rightleftharpoons\mathrm{^{3-}(aq)}+\mathrm{Br^-(aq)}\hspace{3mm}K&=K_{\textrm{sp}}K_{\textrm f}=15\end{align} \label{17.3.6}\)
Confrontando K con Ksp mostra che la formazione di complessi di ioni aumenta la solubilità di AgBr di circa 3 × 1013. Il drammatico aumento della solubilità combinato con il basso costo e la bassa tossicità spiega perché il tiosolfato di sodio è quasi universalmente utilizzato per lo sviluppo di film in bianco e nero. Se lo si desidera, l’argento può essere recuperato dalla soluzione di tiosolfato utilizzando uno qualsiasi dei diversi metodi e riciclato.
Se uno ion complesso ha un grande Kf, la formazione di uno ion complesso può aumentare drasticamente la solubilità dei sali scarsamente solubili.
Esempio \(\PageIndex{2}\)
A causa dell’effetto ionico comune, potremmo aspettarci che un sale come AgCl sia molto meno solubile in una soluzione concentrata di KCl che in acqua. Tale ipotesi sarebbe errata, tuttavia, perché ignora il fatto che lo silver d’argento tende a formare un complesso a due coordinate con ioni cloruro (AgCl2 -). Calcolare la solubilità di AgCl in ogni situazione:
- in acqua pura
- a 1.0 M KCl soluzione, ignorando la formazione di complessi di ioni
- la stessa soluzione, come in (b), ad eccezione di prendere la formazione di complessi di ioni in considerazione, supponendo che AgCl2− è l’unico Ag+ complesso che si forma in concentrazioni significative,
- Scrivere l’espressione del prodotto di solubilità di AgCl e calcolare la concentrazione di Ag+ e Cl− in acqua.
- Calcolare la concentrazione di Ag + nella soluzione KCl.
- Scrivi equazioni chimiche bilanciate per la dissoluzione di AgCl e per la formazione del complesso AgCl2. Aggiungere le due equazioni e calcolare la costante di equilibrio per l’equilibrio complessivo.
- Scrivi l’espressione costante di equilibrio per la reazione complessiva. Risolvi per la concentrazione dello ion complesso.
- A Se poniamo uguale x la solubilità di AgCl, quindi all’equilibrio = = x M. Sostituendo questo valore nell’espressione del prodotto di solubilità,
- B Se x è uguale a la solubilità di AgCl in soluzione di KCl, quindi all’equilibrio = x M e = (1.0 + x) M. Sostituendo tali valori nell’espressione del prodotto di solubilità e supponendo che x << 1.0,
- C Per tenere conto degli effetti della formazione di ioni complessi, dobbiamo prima scrivere le equazioni di equilibrio sia per la dissoluzione che per la formazione di ioni complessi. Aggiungendo le equazioni corrispondenti a Ksp e Kf ci dà un’equazione che descrive la dissoluzione di AgCl in una soluzione KCl. La costante di equilibrio per la reazione è quindi il prodotto di Ksp e Kf:
A 25°C, Ksp = 1.77 × 10-10 per AgCl e Kf = 1.1 × 105 per AgCl2 -.
Data: Kps di AgCl, Kf di AgCl2− e KCl concentrazione
Chiese: la solubilità di AgCl in acqua e in soluzione KCl con e senza la formazione di complessi di ioni
Strategia:
Soluzione
Quindi la solubilità di AgCl in acqua pura a 25°C è di 1,33 × 10-5 M.
Se il comune effetto dello ione erano l’unico fattore importante, prevediamo che AgCl è di circa cinque ordini di grandezza in meno solubile in un 1.0 M KCl soluzione che in acqua.
\\ \mathrm{Ag^+(aq)}+\mathrm{2^{-}}\rightleftharpoons\mathrm{^{-}}\hspace{3mm}K_\textrm f&=1.1\times10^{5}
\\ \mathrm{AgCl(s)}+\mathrm{Cl^{-}}\rightleftharpoons\mathrm{^{-}}\hspace{3mm}K&=K_{\textrm{sp}}K_{\textrm f}=1.9\times10^{-5}\end{align}\)
D Se facciamo x uguale la solubilità di AgCl in soluzione di KCl, quindi all’equilibrio = x e = 1.0 − x. Sostituendo tali quantità nell’espressione della costante di equilibrio per la reazione netta e supponendo che x << 1.0,
Cioè, AgCl si dissolve in 1,0 M KCl per produrre una soluzione 1,9 × 10-5 M dello ion complesso AgCl2. Quindi prevediamo che AgCl abbia approssimativamente la stessa solubilità in una soluzione KCl da 1,0 M come in acqua pura, che è 105 volte maggiore di quella prevista in base all’effetto ionico comune. (Infatti, la solubilità misurata di AgCl in 1,0 M KCl è quasi un fattore di 10 maggiore di quello in acqua pura, in gran parte dovuto alla formazione di altri complessi contenenti cloruro.)
Esercizio di \(\PageIndex{2}\)
Calcolare la solubilità di mercurio(II) ioduro (HgI2) in ogni situazione:
- acqua pura
- 3.0 M soluzione di NaI, assumendo 2− è l’unico Hg-contenenti specie presenti in quantità significativa
- 1.9 × 10-10 M
- 1.4 M
Ksp = 2.9 × 10-29 per HgI2 e Kf = 6.8 × 1029 2.
Risposta
Agenti complessanti, molecole o ioni che aumentano la solubilità dei sali metallici formando complessi metallici solubili, sono componenti comuni dei detergenti per bucato. Gli acidi carbossilici a catena lunga, i principali componenti dei saponi, formano sali insolubili con Ca2 + e Mg2+, che sono presenti in alte concentrazioni in acqua” dura”. La precipitazione di questi sali produce un anello da vasca e dà una sfumatura grigia all’abbigliamento. L’aggiunta di un agente complessante come pirofosfato (O3POPO34−, o P2O74−) o trifosfato (P3O105−) ai detergenti impedisce ai sali di magnesio e calcio di precipitare perché la costante di equilibrio per la formazione di ioni complessi è grande:
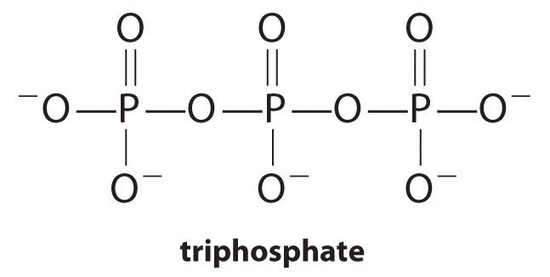
con
Tuttavia, i fosfati possono causare danni ambientali promuovendo l’eutrofizzazione, la crescita di quantità eccessive di alghe in un corpo idrico, che può portare a forti diminuzioni dei livelli di ossigeno disciolto che uccidono i pesci e altri organismi acquatici. Di conseguenza, molti stati degli Stati Uniti hanno vietato l’uso di detergenti contenenti fosfati e la Francia ne ha vietato l’uso a partire dal 2007. I detergenti “senza fosfati” contengono diversi tipi di agenti complessanti, come derivati dell’acido acetico o altri acidi carbossilici. Lo sviluppo di sostituti del fosfato è un’area di intensa ricerca.
Gli addolcitori d’acqua commerciali utilizzano anche un agente complessante per trattare l’acqua dura facendo passare l’acqua sulle resine a scambio ionico, che sono sali di sodio complessi. Quando l’acqua scorre sopra la resina, lo sodium del sodio è dissolto ed i sali insolubili precipitano sulla superficie della resina. L’acqua trattata in questo modo ha un sapore più salato a causa della presenza di Na+, ma contiene meno minerali disciolti.
Un’altra applicazione di agenti complessanti si trova in medicina. A differenza dei raggi X, la risonanza magnetica (MRI) può dare immagini relativamente buone di tessuti molli come gli organi interni. La risonanza magnetica si basa sulle proprietà magnetiche del nucleo 1H degli atomi di idrogeno nell’acqua, che è un componente importante dei tessuti molli. Poiché le proprietà dell’acqua non dipendono molto dal fatto che si trovi all’interno di una cellula o nel sangue, è difficile ottenere immagini dettagliate di questi tessuti che abbiano un buon contrasto. Per risolvere questo problema, gli scienziati hanno sviluppato una classe di complessi metallici noti come “agenti di contrasto MRI.”L’iniezione di un agente di contrasto MRI in un paziente influenza selettivamente le proprietà magnetiche dell’acqua nelle cellule dei tessuti normali, nei tumori o nei vasi sanguigni e consente ai medici di “vedere” ciascuno di questi separatamente (Figura \(\PageIndex{2}\)). Uno degli ioni metallici più importanti per questa applicazione è Gd3+, che con sette elettroni spaiati è altamente paramagnetico. Poiché Gd3+(aq) è abbastanza tossico, deve essere somministrato come un complesso molto stabile che non si dissocia nel corpo e può essere escreto intatto dai reni. Gli agenti complessanti utilizzati per il gadolinio sono ligandi come DTPA5− (dietilene triamina acido pentaacetico), la cui forma completamente protonata è mostrata qui.
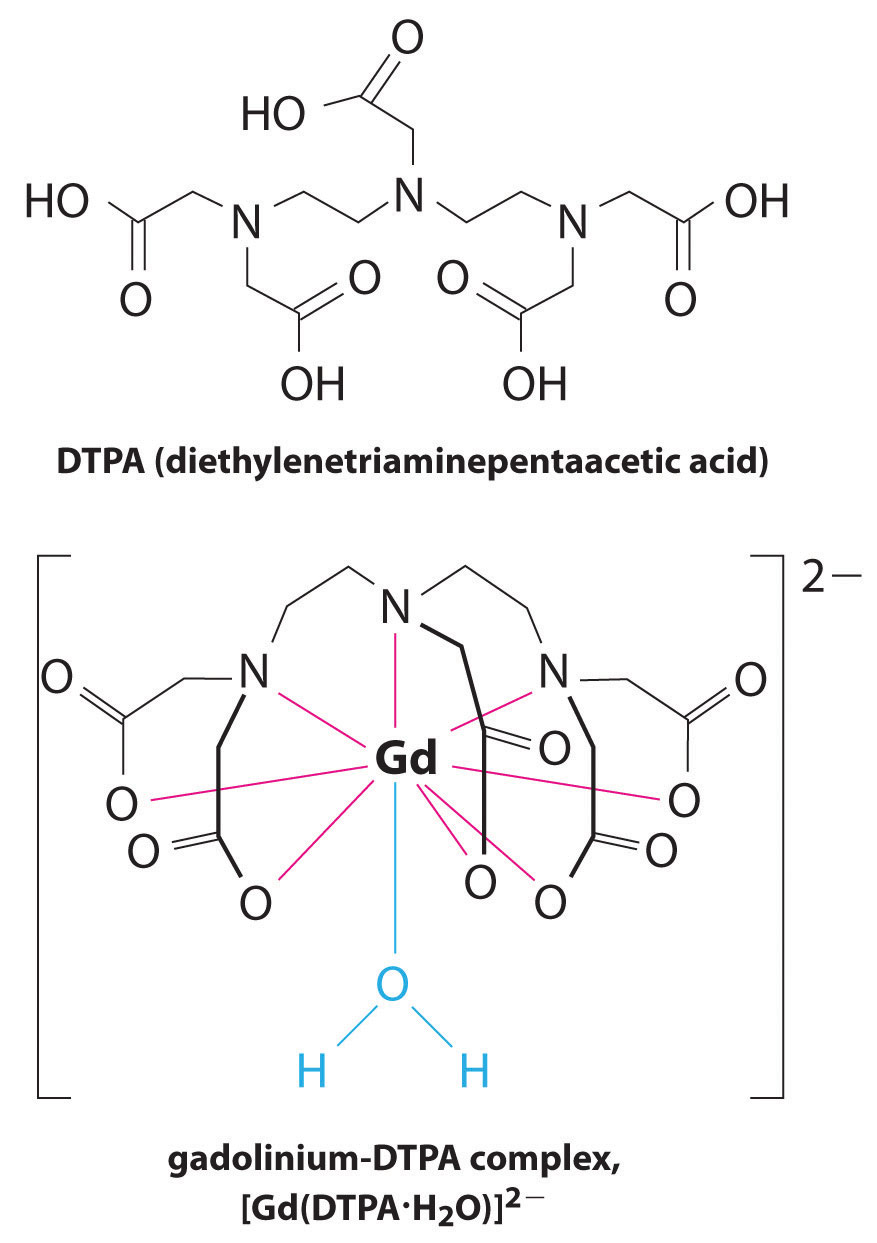
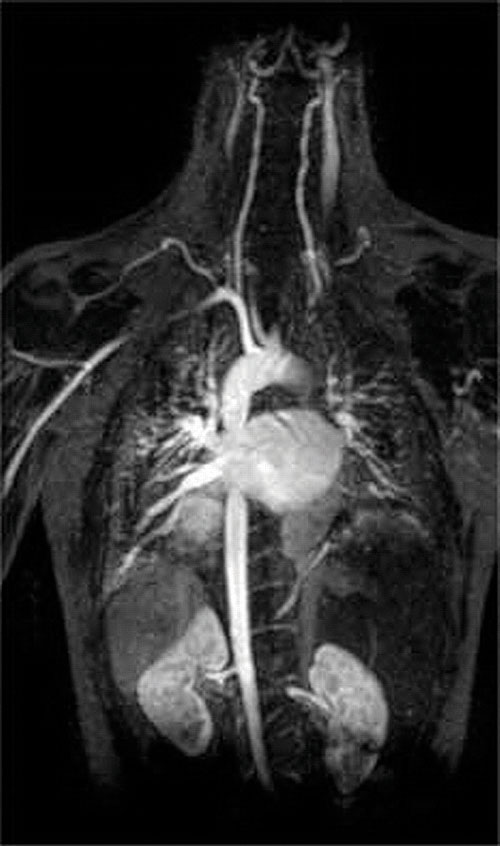
Figura \(\PageIndex{2}\): Un’immagine MRI del cuore, delle arterie e delle vene. Quando un paziente viene iniettato con un catione metallico paramagnetico sotto forma di un complesso stabile noto come agente di contrasto MRI, le proprietà magnetiche dell’acqua nelle cellule vengono alterate. Poiché i diversi ambienti in diversi tipi di cellule rispondono in modo diverso, un medico può ottenere immagini dettagliate dei tessuti molli.