2.3: Monossido di carbonio e backbonding
Proprietà generali
CO è un dativo, L-tipo ligando che non pregiudica lo stato di ossidazione del centro del metallo al momento del legame, ma fa aumentare il numero totale di elettroni da due unità. Recentemente abbiamo visto che ci sono davvero due interazioni di legame in gioco nel ligando carbonilico: un’interazione ligando-metallo n → dσ e un’interazione metallo-ligando dn → π*. Quest’ultima interazione è chiamata backbonding, perché il metallo dona la densità elettronica al ligando. Per ricordare a me stesso l’esistenza di backbonding, mi piace usare la struttura di risonanza della mano destra quando possibile; tuttavia, è importante ricordare di trattare CO come un ligando di tipo L, indipendentemente dalla forma di risonanza.

Interazioni orbitali in M = C = O.
CO è un forte σ-donatore (o σ-base) e un buon π-accettore (o π-acido). Le proprietà del CO legato dipendono profondamente dall’identità del centro metallico. Più specificamente, le proprietà elettroniche del centro metallico dettano l’importanza del backbonding nei complessi carbonilici metallici. La maggior parte senza mezzi termini, più centri metallici ricchi di elettroni sono migliori a backbonding a CO. Perché è importante accertare la forza di backbonding?
La spettroscopia infrarossa è stata notoriamente utilizzata per supportare empiricamente l’idea di backbonding. La tabella seguente organizza alcuni complessi metallici carbonilici in ordine “periodico”e fornisce la frequenza corrispondente alla modalità di allungamento C=O. Si noti che, senza eccezioni, ogni CO complessato ha una frequenza di allungamento inferiore a quella del CO libero. Backbonding è la colpa! L’ordine di legame C – O nel monossido di carbonio complessato è (quasi sempre) inferiore a quello del CO libero.

C = O allungamento delle frequenze in complessi metallo-carbonilici. C’e ‘ qualcosa che non va qui?
La figura sopra mostra un chiaro aumento della frequenza (un aumento dell’ordine del legame C–O) mentre ci spostiamo da sinistra a destra attraverso la tavola periodica. Questo risultato può sembrare strano se consideriamo che il numero di elettroni d nel metallo neutro aumenta man mano che ci spostiamo da sinistra a destra. I centri metallici con più elettroni d non dovrebbero essere migliori nel backbonding (e più “ricchi di elettroni”)? Che succede qui? Ricorda l’andamento periodico dell’energia orbitale. Mentre ci spostiamo da sinistra a destra, le energie orbitali d diminuiscono e le energie degli orbitali dn e π* si separano. Di conseguenza, l’interazione orbitale di backbonding peggiora (ricorda che le forti interazioni orbitali richiedono energie orbitali ben abbinate) mentre ci spostiamo verso i metalli di transizione tardiva più elettronegativi! Possiamo tracciare un’analogia con le enamine e gli eteri enolici dalla chimica organica. L’atomo di ossigeno più elettronegativo negli eteri enolici è un donatore di elettroni peggiore dell’atomo di azoto dell’enamina.

L’importanza del backbonding dipende dall’elettronegatività del metallo e dalla sua densità elettronica.
Naturalmente, il contributo di altri ligandi sul centro del metallo al backbonding non può essere dimenticato. Logicamente, i ligandi che donano elettroni tenderanno a rendere il backbond più forte (rendono il metallo un donatore di elettroni migliore), mentre i ligandi che ritirano elettroni peggioreranno il backbonding. L’aggiunta di ligandi fosfina ricchi di elettroni ad un centro metallico, ad esempio, diminuisce la frequenza di allungamento del CO a causa di una migliore backbonding.
I leganti carbonilici sono notoriamente in grado di colmare più centri metallici. Il legame nei complessi carbonilici a ponte può essere “tradizionale” o delocalizzato, a seconda della struttura del complesso e della modalità di ponte. La varietà di modi di bridging deriva dai diversi donatori di elettroni e accettori presenti sul ligando CO (e la possibilità di legame delocalizzato). Le modalità di bridging conosciute sono mostrate nella figura seguente.
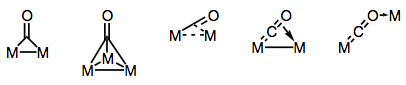
Costruire ponti con leganti carbonilici!