7.5: Complex IV
Complex IV è la destinazione finale nella catena di trasporto degli elettroni. Qui, gli elettroni che hanno viaggiato attraverso gli altri membri del supercomplesso respiratorio vengono infine consegnati a O2, riducendolo in acqua. Questa è un’impresa impressionante, perché un certo numero di specie reattive dell’ossigeno deve essere formato tra l’aggiunta iniziale di un elettrone e il rilascio finale di acqua, ma la reazione è controllata in modo tale che la possibilità di danni cellulari sia ridotta al minimo. Allo stesso tempo, più protoni vengono pompati attraverso la membrana mitocondriale interna.
- Nel Complesso IV, gli elettroni vengono consegnati alla loro destinazione finale, una molecola di O2.
- L’O2 è ridotto all’acqua.
Esercizio \(\PageIndex{1}\)
Scrivi una mezza reazione redox bilanciata per mostrare quanti elettroni sono necessari per ridurre una molecola di ossigeno all’acqua.
Risposta
O2 → H2O
O2 → 2 H2O (O bilanciato)
O2+ 4 H + → 2 H2O (H bilanciato)
O2 + 4e – + 4 H + → 2 H2O (carica bilanciato)
La struttura a raggi X del complesso IV è mostrata di seguito. Ancora una volta, la matrice si trova all’estremità inferiore dell’immagine e lo spazio intermembrana è in alto. Ecco dove il citocromo c attracca, in cima.
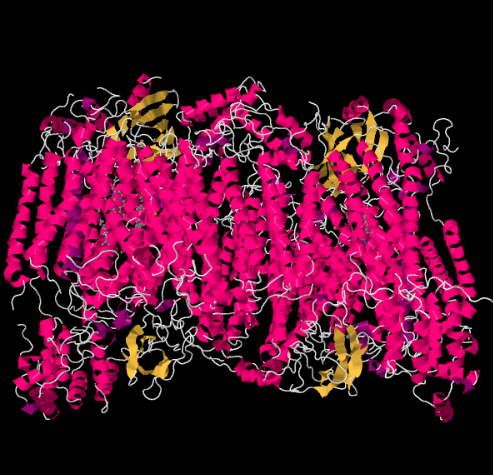
Il vettore elettronico mobile, il citocromo c, si lega al Complesso IV e trasporta un elettrone in un sito di rame binucleare chiamato CuA. Possiamo vedere quel sito di rame binucleare quando guardiamo all’interno della proteina, sotto. È legato solo alla proteina e nient’altro, quindi vediamo solo i due ioni di rame da soli nella parte superiore dell’immagine. Questa coppia di atomi di rame invia l’elettrone a un eme, il citocromo a, che potete vedere sotto e a sinistra. Da lì, l’elettrone procede ad un altro ammasso binucleare, questa volta costituito da un ferro legato all’eme (citocromo a3) e un rame vicino (CuB). Questo sito binucleare effettua la riduzione del diossigeno in acqua. Nella struttura, c’è una molecola di monossido di carbonio legata nel sito attivo tra il citocromo a3 e il CuB. Gli atomi di carbonio è attaccato al ferro e l’ossigeno è attaccato al rame. Ecco dove la molecola di ossigeno si legherebbe, in attesa di essere ridotta all’acqua.
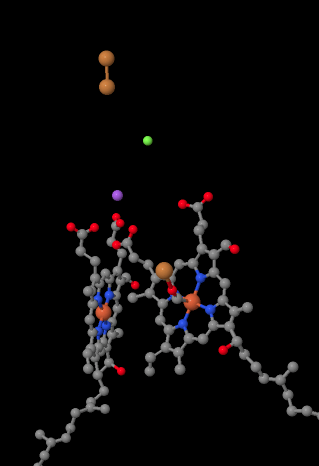
Se ci pensi, significa che gli elettroni viaggiano nella direzione opposta a quella che abbiamo visto nei primi tre complessi. Nei complessi I e II, gli elettroni venivano consegnati dalla matrice mitocondriale e viaggiavano verso lo spazio intermembrana, fermandosi a un ubiquinone nella membrana mitocondriale. Nel complesso III, gli elettroni continuavano in quella direzione” verso l’alto”, dalla membrana mitocondriale al citocromo c nello spazio intermembrana. Nel complesso IV, gli elettroni stanno invertendo la rotta, viaggiando indietro verso la matrice mitocondriale. Ricorda, la matrice mitocondriale è drogata con n a causa del pompaggio di protoni, quindi questi elettroni viaggiano dal lato positivo della membrana al lato negativo. Dev’essere difficile.
- Nel Complesso IV, il trasporto di elettroni è nella direzione opposta rispetto agli altri complessi.
- Gli elettroni viaggiano dal lato dello spazio intermembrana al lato della matrice mitocondriale, contro il gradiente di carica.
Diamo un’altra occhiata ai ligandi importanti per il complesso. Un cartone animato è mostrato di seguito. Nel cartone animato, la molecola O2 viene mostrata legandosi in quella posizione tra l’eme a3 e il cucciolo. Quel sito metallico dinucleare è dove la molecola di ossigeno è ridotta all’acqua.
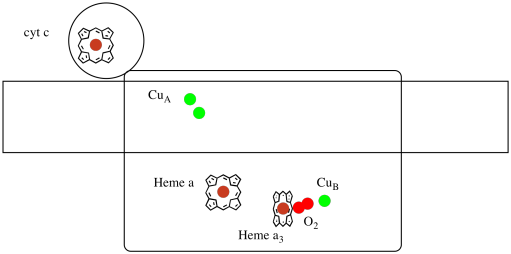
Poiché sono necessari quattro elettroni per ridurre O2 a H2O, quattro molecole del citocromo c devono legarsi al Complesso IV prima che la riduzione possa procedere. È probabile che l’ambiente di coordinazione della molecola di ossigeno-tra due metalli, piuttosto che solo legati a uno-permette di essere essere più rapidamente ridotto fino all’acqua piuttosto che formare specie reattive dell’ossigeno che persistono nella cellula, come i perossidi.
Esercizio \(\PageIndex{2}\)
Supponiamo che il ferro nell’eme a3 inizi in uno stato Fe(II) ridotto e che il CuB inizi in uno stato Cu(I) ridotto. Fornire un meccanismo per la riduzione dell’ossigeno in acqua, con l’aggiunta di quattro elettroni e quattro protoni. Utilizzare Fe (II) come donatore di elettroni e lisina come donatore di protoni.
Risposta
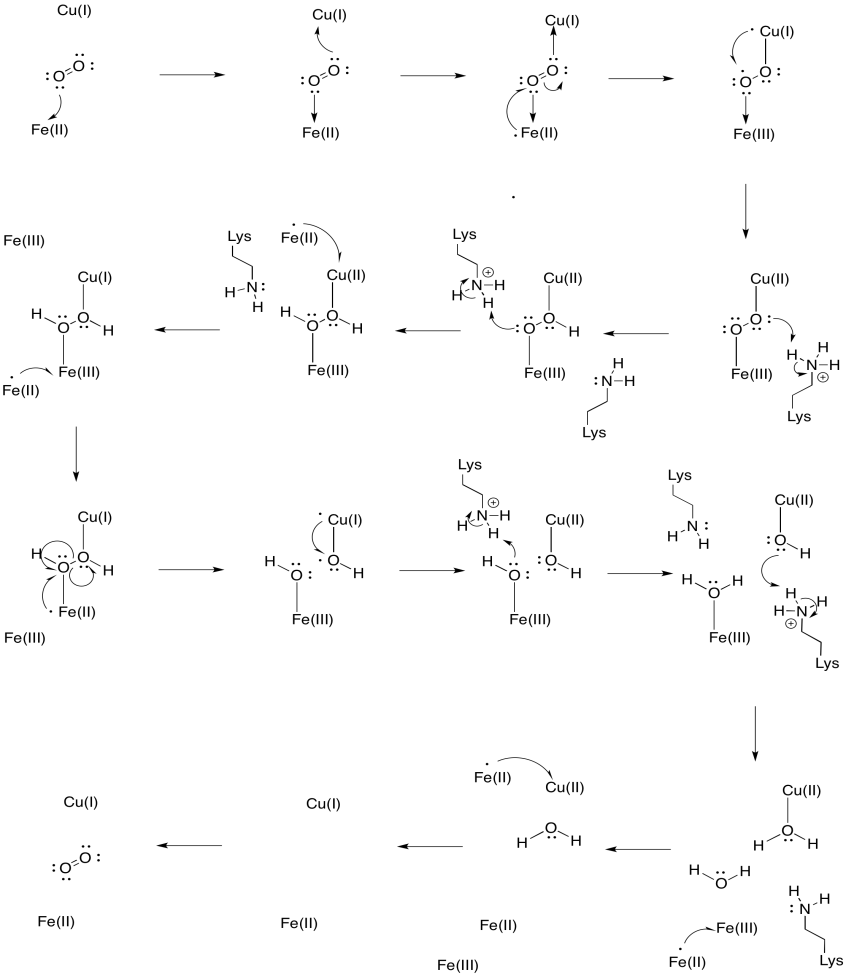
Oltre a questi due metalli, c’è anche un coniugato istidina-tirosina modificato legato al CuB. È stato suggerito che questa tirosina fornisce un’altra fonte di elettroni immediati che possono essere utilizzati in riduzione.
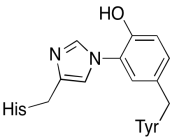
Esercizio \(\PageIndex{3}\)
Mostra perché una tirosina può essere una fonte sia di un protone che di un elettrone nei processi biochimici.
Risposta
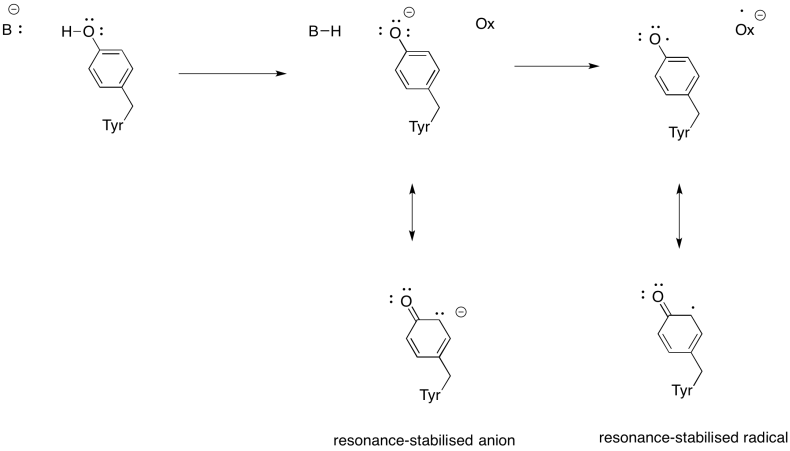
Oltre alla necessità di ridurre l’ossigeno all’acqua, il Complesso IV contribuisce anche al gradiente protonico, pompando protoni aggiuntivi attraverso la membrana mitocondriale. Questo compito presenta ulteriori sfide. Un semplice meccanismo di accoppiamento non è possibile, perché gli elettroni si muovono nella direzione opposta. È però che il meccanismo comporta cambiamenti conformazionali nella proteina che si verificano come i metalli cambiano stati di ossidazione. Sottili cambiamenti nell’ambiente di coordinazione possono causare lo spostamento dei residui di aminoacidi nelle vicinanze. È facile immaginare che se un particolare amminoacido si sposta verso l’alto verso lo spazio intermembrana, potrebbe tirare un protone con esso.
- Il pompaggio di protoni e il trasporto di elettroni funzionano in direzioni opposte nel Complesso IV e devono essere disaccoppiati.
- Il pompaggio di protoni nel Complesso IV deve basarsi su cambiamenti conformazionali.
Esercizio \(\PageIndex{4}\)
Il sito CuA contiene due coppers, boound da due cisteine ponte. Entrambi sono legati da istidine terminali. Inoltre, un rame è legato da una metionina aggiuntiva, mentre l’altro è legato da un carbonile dalla spina dorsale della proteina.
- Disegna i coppers nei loro siti di rilegatura.
- Descrivere la geometria di ogni rame.
- Se ogni rame è Cu(I), qual è il numero di elettroni coordinato su ciascun rame nel complesso?
- Se ogni rame è Cu(I), qual è la carica complessiva sul complesso?
Risposta)
un)
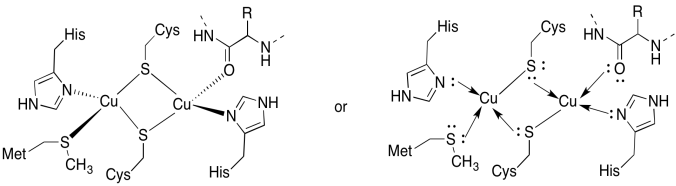
Risposta b)
b) tetraedrico
la Risposta c)
c) Cu(I) = d10
4 donatori = 8 e-
totale = 18e-
Risposta d)
d) 2 x Cu(I) = 2+
2 x Cys-S- = 2-
Tutti gli altri neutro
Totale = 0
Esercizio di \(\PageIndex{5}\)
Il rame nel CuB sito è vincolato da due histidines e l’istidina-tirosina coniugato.
- Disegnare il rame nel sito di rilegatura.
- Descrivere la geometria del rame.
- Se il rame è Cu (I), qual è il numero di elettroni coordinato nel complesso?
- Se il rame è Cu (I), qual è la carica complessiva sul complesso?
Risposta)
un)
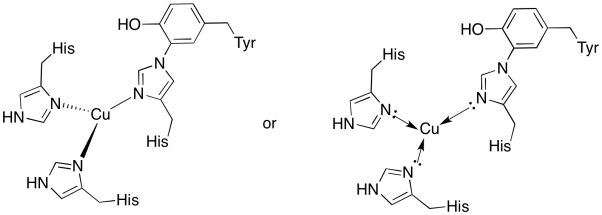
Risposta b)
b) trigonale planare
la Risposta c)
c) Cu(I) = d10
3 donatori = 6 e-
totale = 16 e-
Risposta d)
d) Cu(I) = 1+
histidines neutro
Totale = 1+
Esercizio di \(\PageIndex{6}\)
e ‘ difficile misurare il potenziale di riduzione di un sito all’interno di una proteina. Tuttavia, i ricercatori sono stati in grado di stimare questi valori misurando gli spettri EPR in varie condizioni. Supponendo i potenziali di riduzione di seguito, disegnare un diagramma di avanzamento della reazione per il trasporto di un elettrone tutta la strada dal citocromo c all’ossigeno molecolare.
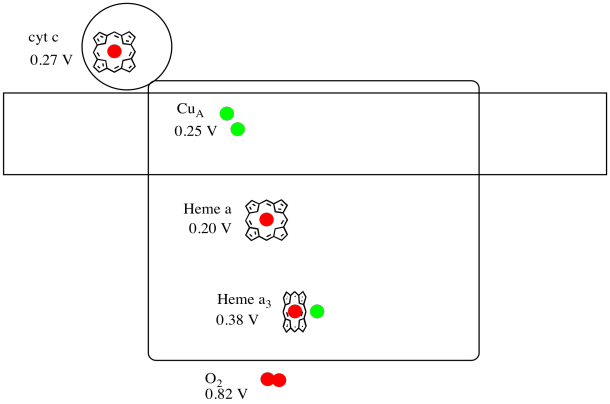 Risposta
Risposta
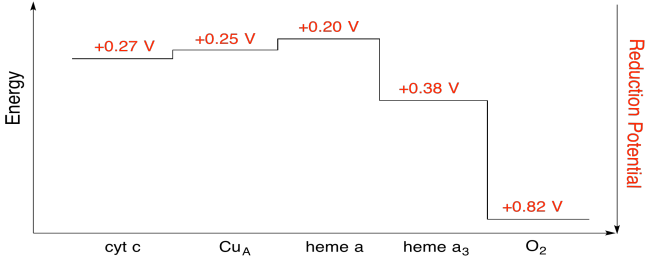
Esercizio \(\PageIndex{7}\)
Utilizzando i valori nella figura sopra, calcolare la variazione di energia quando un elettrone viene trasferito da eme a a eme a3.
Risposta
Supponendo che i potenziali di riduzione siano:
heme a(ox) + e- → heme a(rosso) Eored = 0.20 V
heme a3(ox) + e- → heme a3(rosso) Eored = 0.38 V
Quindi la differenza di potenziale per la reazione, ΔEo = 0.38 – (0.20) V = 0.18 V.
Faraday relazione ∆ G = – n F ΔEo dà
∆ G = – 1 x 96,485 J V-1 mol-1 x 0,13 V = 17,367 J mol-1 = 17.4 kJ mol-1
Attribuzione
Chris P Schaller, Ph. D., (Collegio di San Benedetto / Saint John’s University)