Acidi, Basi e pH
|
|||||||||
ACIDI E CONIUGATO BASI
Ricordate il Bronsted–Lowry definizione di un acido: acido è un donatore di protoni. Chiaramente, nel nostro esempio precedente l’acido acetico dona il suo protone a H2O nella reazione in avanti, con conseguente formazione dello acetate acetato. Tuttavia, nella reazione inversa, lo acetate acetato accetta un protone da H3O+ per tornare a CH3COOH. Dalla definizione di Bronsted-Lowry, una base è un accettore di protoni.
|
Così, lo ione acetato agisce come base per la reazione inversa, ed è chiamato la base coniugata dell’acido acetico. L’acido acetico e lo acetate acetato sono noti come coppia coniugata acido-base. Abbastanza interessante, c’è una seconda coppia coniugata acido–base nella reazione sopra. Si noti come nella reazione inversa, H3O + dona un protone (rendendolo un acido), mentre nella reazione in avanti, H2O accetta un protone (rendendolo una base). H2O e H3O + sono una coppia acido-base coniugata, con H3O+ che è l’acido coniugato e H2O che è la base coniugata.
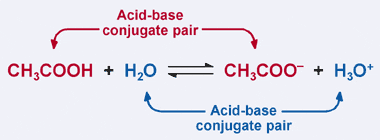
In una coppia acido-base coniugata, l’acido coniugato ha un protone in più rispetto alla sua corrispondente base coniugata.