Atlante di istologia vegetale e animale
1. Coesine
2. Condensine
L’organizzazione della cromatina cambia drasticamente durante il ciclo cellulare. Durante l’interfase (fasi G1, S e G2), gran parte della cromatina rimane sciolta e non condensata (euchromatina) e l’altra parte appare in uno stato condensato (eterocromatina). Ci sono regioni della cromatina che possono alternare fra gli stati condensati e non condensati durante il comportamento normale della cellula. Molti geni devono essere espressi durante l’interfase e devono essere accessibili alle RNA polimerasi e ai fattori di trascrizione, il che è più facile in uno stato meno condensato della cromatina. Tuttavia, durante la mitosi (fase M), la cromatina raggiunge un elevato grado di compattazione e organizzazione per formare cromosomi. La segregazione dei cromosomi tra le due cellule figlie è un processo molto importante durante la divisione cellulare. La condensazione della cromatina per formare i cromomi è conseguenza delle modifiche dell’istone. Inoltre, un gruppo di proteine note come SMC (structural maintenance chromosome) sono coinvolte in questo meccanismo di compattazione. Le coesine e le condensine sono proteine SMC.
Coesine
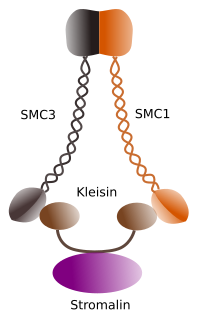
Figura 1. Struttura e composizione molecolare della coesina SMC 1 e 3 (immagine preparata da ÁnGela L. Debenedetti y Daniel García, studenti di Biologia . Adattato da Barbero 2009).
La prima funzione concessa alle coesine (Figura 1), ed è per questo che il loro nome, è di mantenere insieme i cromatidi fratelli lungo il ciclo cellulare fino a quando non sono separati in anafase. In Saccharomyces cerevisae, un lievito, i complessi di coesina sono attaccati alla cromatina in fase G1 e S, nello stesso momento in cui il DNA è stato replicato. Questo processo è noto come “caricamento” ed è ATP dipendente.
Durante la mitosi, è essenziale un corretto ordine dei cromosomi nella placca metafasica. È anche cruciale la perdita di coesione tra cromatidi fratelli che consente la migrazione di ciascun cromatide ai poli del fuso mitotico opposti durante l’anafase. Questo meccanismo di segregazione istantanea e coordinata è possibile perché le choesin smettono di collegare cromatidi fratelli tra loro. Il processo deve avvenire in tutti i cromosomi contemporaneamente e deve essere coordinato con i movimenti delle proteine motorie dei microtubuli e con la polimerizzazione e depolimerizzazione dei microtubli del polo mandrino. La separazione dei cromatidi fratelli e l’attività correlata ai microtubuli che si verificano contemporaneamente è il risultato della convergenza di due percorsi molecolari avviati dall’attività dell’enzima chinasi dipendente dalla ciclina M, M-CdK.
All’inizio della mitosi, le coesine creano collegamenti tra cromatidi fratelli, lungo l’intera lunghezza dei cromatidi (Figura 2). M-CdK fosforila la kleisina, un componente delle coesine (Figura 1), durante la profasi e la prometafasi, portando alla dissociazione delle coesine dai bracci cromatidici ma rimanendo nella regione del centromero. Pertanto, i cromatidi rimangono attaccati attraverso i centromeri. La fosforilazione delle coesine centromeriche è impedita dalla fosfatasi PP2A, che è associata a questa regione. In questo modo, i cromosomi (cromatidi fratelli attaccati attraverso i centromeri) sono allineati nella piastra metafase.
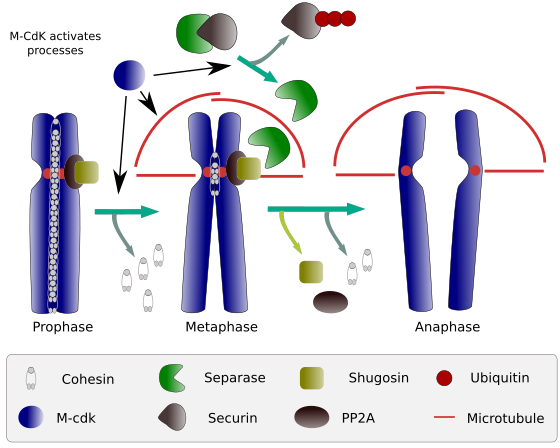
Figura 2. Funzione di coesina durante la mitosi. Le coesine mantengono i cromatidi fratelli attaccati dalla profase all’anafase. M-CdK inizia tre processi molecolari che convergono nella fase M: stimola la formazione del fuso mitotico, si disconnette cohesins trova al di fuori centromes, innesca la separase-securin complesso, consentendo separase per rimuovere proteine shugoshin-PP2A, che mantiene centromeri insieme, grazie al cohesins, e quindi anafase è in grado di avviare (immagine preparato da L. Debenedetti y Daniel García, gli studenti di biologia, adattato da Barbero 2009).
Durante i primi stadi della mitosi, M-CdK fosforila il complesso APC (anafase promoting factor) che divide il complesso separasi-securina. M-CdK fosforila anche proteine che rende possibili microtubuli e proteine del fuso mitotico per trascinare e separare i cromatidi sorella, una volta cromatidi sono disimpegnati tra loro. Queste forze vengono eseguite durante il tempo della mitosi.
Choesins sono anche giocatori sindaco nel movimento cromosomico durante meisois. Il comportamento dei cromosomi durante la meiosi è molto più complesso che nella mitosi, e così fa la funzione delle coesine. Durante il primo mioitic divisione, cohesins il collegamento sia la sorella cromatidi (braccia e centromeri) e cromosomi omologhi, talmente semplice mantenere aggiornati i cromosomi bivalenti insieme per il corretto fodera in equatoriale piastra di metafase I. All’inizio dell’anafase I, mediata separase proteine, cohesins staccare da entrambi i bracci del cromosoma o sorella cromatidi e i cromatidi di cromosomi omologhi. Ancora una volta, le coesine delle regioni centromeriche rimangono attaccate. Ogni cromosoma omologo, con i due cromatidi fratelli, migra ai poli del fuso opposto. In questo modo, termina la prima divisione meiotica. Nella seconda divisione mioitica, nella prometafase II, i cinetocori di ciascun cromosoma si attaccano ai microtubuli provenienti rispettivamente dai poli opposti del fuso. Le coesine sono ancora collegate alle regioni centromeriche. Nella prometafasi II, almeno nei mammiferi, i microtubuli causano forze meccaniche nelle regioni centromeriche che portano al trasferimento della fosfatasi PP2A dai centromeri e, mediata dalle proteine della separasi, al rilascio di coesina dai centromeri. Succede durante la transizione metafase II / anafase II. Come è successo nella mitosi, i cromatidi fratelli vengono liberati e possono essere spostati in poli del fuso oposite per formare cellule aploidi.
Le coesine sono state coinvolte in altre funzioni come la riparazione del DNA, il controllo dell’espressione genica e con diversi nuovi ruoli nei processi biochimici non correlati al comportamento cromosomico durante la fase M.
Condensine
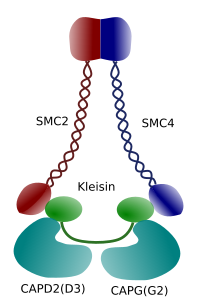
Figura 3. Struttura e composizione molecolare di una condensina (immagine preparata da ÁnGela L. Debenedetti y Daniel García, studenti di Biologia . Tratto da Maeshima y Eltsov, 2008).
La condensazione della cromatina nei cromosomi è un buon meccanismo per resistere alle forze di trazione che lavorano nella mitosi durante la metafase e l’anafase. Inoltre, sarebbe difficile una corretta distribuzione della cromatina tra le cellule figlie se il DNA fosse sciolto e distribuito uniformemente attraverso il nucleo. Ci sarebbe un enorme intreccio di filamenti di DNA che ostacolerebbe l’integrità del DNA e un’allocazione uguale tra le due nuove cellule. Le condensine (Figura 3) sono coinvolte nella condensazione della cromatina.
Esperimenti in vitro hanno dimostrato che la condensina induce la tensione del DNA mediante un meccanismo ATP-dipendente. In primo luogo, aiutato dall’enzima topoisomerasi I, la condensina produce super-avvolgimento del DNA. In secondo luogo, promuove la formazione di cicli di cromatina, in collaborazione con topoisomerasi II. Si pensa che questi processi si verifichino anche nella profase delle cellule viventi.
Condensina SMC dimero può aumentare l’angolo che SMC forma tra di loro e quindi il contatto con regioni cromatina distanti attraverso i domini testa molecolare di ogni SMC. Successivamente, la struttura del dimero torna alla posizione iniziale, generando in questo modo una forza di trazione che trascina il DNA che viene piegato in un loop (Figura 4). Dalle interazioni di dimeri SMC di diverse molecole di condensina, i complessi molecolari-cromatina di ordine superiore sono formati e organizzati in anelli o anelli. Questo meccanismo porta all’emergere di cromosomi mitotici.
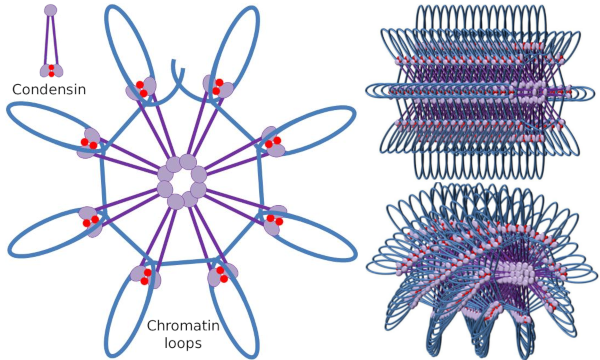
Figura 4. Formazione di loop per condensine (immagine a destra). La linea blu è DNA. Le immagini a destra cercano di rappresentare l’effetto delle condesine sull’organizzazione tridimensionale della cromatina. Si noti che la regolarità molecolare qui raffigurata non si trova probabilmente nel mondo reale (immagini preparate da ÁnGela L. Debenedetti y Daniel García, studenti di biologia. Tratto da Maeshima y Eltsov, 2008).
Tutti gli organismi, inclusi i batteri, hanno un certo tipo di condensina. I funghi hanno solo condensina di tipo I, le alghe hanno due tipi e C. elegans ha tre tipi. La maggior parte degli animali e delle piante ha condensine di tipo I e II. Nel lignaggio cellulare HeLa, il tipo I e II sono ugualmente abbondanti (1/1), ma in Xenopus è 5/1 e 10/1 nel pollo.
Le condensine I e II partecipano a diverse fasi della condensazione cromosomica. Condensin I lavora principalmente sui cromosomi durante la prohase e li lascia in telofase. Nell’interfase, la condensina I si trova nel citoplasma durante G1, ma può in seguito scomparire. La condensina II è associata alla cromatina nell’interfase e si concentra nei cromosomi durante la profase. La sua funzione non è ancora chiara, anche se avrebbe influenzato l’organizzazione della cromatina. La condensina II è coinvolta nella fase iniziale della compattazione cromosomica, mentre la condensina I, aiutata dalla condensina II, darebbe forma e stabilità ai cromosomi in una fase più avanzata del processo di condensazione.
La distribuzione spaziale e temporale differenziale di entrambe le condensine influisce sul loro accesso alla cromatina. Pertanto, la condensazione iniziale della cromatina durante la profasi è prodotta dalla condensina II, dopo che è stata fosforilata da diverse chinasi. Alla fine della profase, l’involucro nucleare è disorganizzato e la condensina I, che si trova nel citoplasma, può accedere alla cromatina. Quindi, entrambe le condensine possono cooperare nella condensazione della cromatina per raggiungere i livelli di compattazione trovati nei cromosomi (Figura 5).
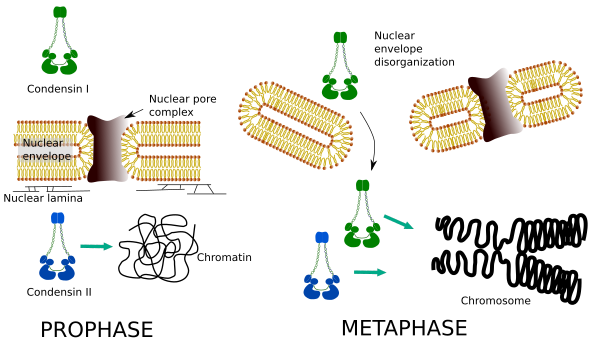
Figura 5. Ruoli della condensina I e II nelle diverse fasi della mitosi. (Immagini preparate da ÁnGela L. Debenedetti y Daniel García, studenti di Biologia. Adattato da et et al., 2004).
Le condensine non si attaccano casualmente al cromosoma. Hanno più affinità per centromeri, telomeri, geni e regioni del DNA per iniziare e terminare la trascrizione. Quindi, sembra che la loro funzione non sia solo strutturale. Inoltre, la condensina I lega specificamente gli istoni H2A e H4 durante la mitosi.
Sebbene i cromosomi dei vertebrati possano condensarsi quasi spontaneamente, la mancanza di condensa porta a perdere la struttura organizzata durante l’anafase. Inoltre, dopo che l’attività di M-CdK termina durante l’anafase, la condensina sembra essere necessaria per assicurarsi una corretta migrazione dei cromosomi ai poli del mandrino. I ruoli delle condesine durante la meiosi devono ancora essere studiati attentamente e finora non ci sono molti dati a riguardo.
Le funzioni della condensina II sono scoperte dopo lo studio di cellule mutanti prive di condesine. Queste cellule mostrano cromosomi più lunghi e piegati causati da una scarsa condensazione assiale. I cromatidi sembrano più impigliati, anche in anafase, e la profase è più corta. Quando manca la condensina I, c’è una debole condensazione laterale dei cromosomi, la citocinesi fallisce e le cellule diventano poliploidi.
Le condensazioni sono anche coinvolte nella condensazione regionale della cromatina durante l’interfase. Può essere modulato quanto sia facile per l’insieme di trascrizione delle molecole ottenere l’accesso a un particolare gene modificando il livello di compattazione della cromatina. Più compatto significa più difficoltà. Sembra che questo meccanismo di regolazione della compattazione della cromatina non si basi nelle stesse molecole che agiscono durante la compattazione cromosomica, sebbene le condensine partecipino a entrambe. Condensine e coesine possono svolgere diverse funzioni indipendentemente l’una dall’altra, ma entrambe le famiglie proteiche lavorano insieme durante la mitosi (Figura 6).
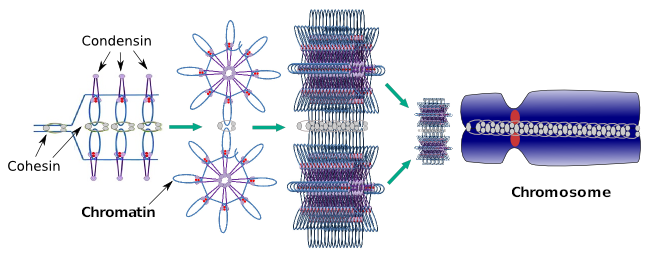
Figura 6. Condensine e coesine che lavorano insieme durante la formazione dei cromosomi. (Immagini preparate da ÁnGela L. Debenedetti y Daniel García, studenti di Biologia. Adattato da Maeshima e Eltsov, 2008).
Bibliografia
Barbero JL. 2009. Coesine: architetti della cromatina nella segregazione cromosomica, controllo dell’espressione genica e molto altro. Scienze della vita cellulari e molecolari. 66:2025-2035.
Hirano T. 2005. Proteine SMC e meccanica cromosomica: dai batteri all’uomo. Transazioni filosofiche della Royal Society B. 360:507-514
Hudson DF, Marshall KM, Earnshaw WC. 2009. Condensin: Architetto dei cromosomi mitotici. Ricerca cromosomica. 17:131-144
Kalitsis P, Zhang T, Marshall KM, Nielsen GF, Hudson DF. 2017. Condensin, maestro organizzatore del genoma. Ricerca cromosomica. 25: 61-76
Maeshima K, Eltsov M. 2008. Confezionamento del genoma: la struttura dei cromosomi mitotici. Rivista di biochimica. 143:145-53.
Nashmyth K, Haering CH. 2005. La struttura e la funzione dei complessi SMC e kleisin. Revisione annuale della biochimica. 74:595-648
On T, Fang Y, Spector DL, Hirano T. 2004. Regolazione spaziale e temporale delle Condensine I e II nell’assemblaggio dei cromosomi mitotici nelle cellule umane. Biologia molecolare della cellula. 15: 3296-3308
Peters JM. 2008. Il complesso di coesina e i suoi ruoli nella biologia dei cromosomi. Geni e sevelopment. 22: 3089-3114
Uhlmann F, Lottspelch F, Nasmyth K. 1999. La separazione dei cromatidi sorella all’inizio dell’anafase è promossa dalla scissione della subunità di coesina Scc1. Natura. 400, 6739:37-42