Citrate anticoagulazione durante la CRRT per danno renale acuto
- danno renale Acuto
- Gestione delle terapie sostitutive AKI – renali per AKI
- Emodialisi, emofiltrazione ed emodiafiltrazione
- Inizio e tempi di RRT per AKI – intermittente rispetto a RRT continuo
- Anticoagulazione durante la terapia sostitutiva renale continua (CRRT)
- Citrato-il meccanismo della sua azione anticoagulante e la sua applicazione in CRRT
- Potenziali disturbi metabolici durante la CRRT citrato-anticoagulante
- Monitoraggio biochimico dei pazienti trattati con CRRT citrato-anticoagulante
danno renale Acuto
danno renale Acuto (AKI), una sindrome clinica con molte possibili cause, è semplicemente definito come una brusca diminuzione della funzione renale nel corso di un periodo di ore o giorni, evidenziato dal recente aumento la concentrazione di creatinina sierica e/o alla riduzione della produzione di urina .
È distinto dalla malattia renale cronica (CKD) in cui la diminuzione della funzione renale è lentamente ma irreversibilmente progressiva, che si verifica in un periodo di mesi e anni. L’AKI può naturalmente verificarsi in quelli con CKD sottostante e una diagnosi di AKI è associata a un rischio maggiore del normale di un’eventuale diagnosi di CKD .
concordati a livello Internazionale, le linee guida dello stato che una diagnosi di AKI può essere effettuata se:
• la creatinina sierica aumenta da ≥ 0,3 mg/dL (26.5 µmol/L) entro 48 ore; o
• c’è stato un 50 % o maggiore aumento della creatinina negli ultimi 7 giorni; o
• il volume di urina è
AKI comprende l’intero spettro di gravità, da un lieve decremento della funzione renale (stadio 1 AKI) per l’insufficienza renale (stadio 3 AKI). Stadiazione dipende dalla creatinina sierica misura, con o senza produzione di urina dati (Tabella I)
|
Stage |
Creatinina Sierica |
la produzione di Urina |
|
1 |
1.5-1.9 volte rispetto al basale |
per 6-12 ore |
|
2 |
2.0-2.9 volte rispetto al basale |
⩾ 12 ore |
|
3 |
3.0 volte rispetto al basale |
per ⩾ 24 ore |
TABELLA I: Le tre fasi di AKI gravità (da rif 1)
Le cause di AKI sono convenzionalmente classificati in tre categorie: prerenal; renale (intrinseco); e postrenale, sottolineando il fatto che AKI può avere un’eziologia renale specifica ma può anche derivare da un problema primario al di fuori del rene.
Qualsiasi condizione che abbia l’effetto di ridurre il flusso sanguigno al rene (perfusione renale) è una potenziale causa di AKI prerenale; queste condizioni includono: ipovolemia dovuta a vomito, diarrea, emorragia, ustioni o shock settico; e ridotta gittata cardiaca dovuta, ad esempio, insufficienza cardiaca e insufficienza epatica (cirrosi). La principale causa di AKI intrinseco è la necrosi tubulare renale, derivante da ischemia renale o ingestione di farmaci/tossine nefrotossici.
La sepsi, la causa più comune di AKI nei malati critici, è dovuta in parte a una lesione renale intrinseca mal definita simile alla necrosi tubulare renale . Infine, l’AKI postrenale deriva da qualsiasi condizione che ostruisce il flusso di urina distale al rene; questi includono: calcoli renali( calcoli); malattia della prostata (tumore/ipertrofia); disfunzione della vescica; e stenosi uretrale.
Gestione delle terapie sostitutive AKI – renali per AKI
Non esiste un trattamento specifico per AKI e la gestione è ampiamente di supporto con il trattamento diretto alla causa sottostante. Il ritiro dei farmaci nefrotossici, la rianimazione fluida e la correzione del disturbo elettrolitico e acido-base fanno tutti parte di questa gestione generale di supporto . Può essere necessaria la somministrazione di vasopressori o farmaci inotropi per ripristinare la normale pressione sanguigna e la gittata cardiaca.
La terapia sostitutiva renale (RRT), al centro di questo articolo, rappresenta il trattamento di ultima istanza per i pazienti con AKI grave che non risponde a una gestione conservativa di supporto. Circa il 23% dei pazienti in terapia intensiva con AKI (cioè circa il 13% di tutti i pazienti in terapia intensiva) riceve RRT .
La terapia sostitutiva renale (RRT) è il termine generico per tutti i trattamenti che cercano di sostituire la funzionalità renale. Il trapianto di rene da donatore a quelli con malattia renale allo stadio terminale può essere considerato l’ultimo RRT, ma il termine è più spesso riservato a quelle terapie che sostituiscono il filtraggio del sangue e le funzioni omeostatiche del rene mediante dialisi, un processo che utilizza una membrana semipermeabile come filtro del sangue. Due ampi tipi di RRT dialitico sono disponibili per il trattamento di AKI (e per quella materia, CKD della fase finale): dialisi peritoneale ed emodialisi.
Al contrario, l’emodialisi comporta il filtraggio del sangue in una macchina al di fuori del corpo (extracorporea). Il sangue viene pompato al filtro / dializzatore, dove i prodotti di scarto e il liquido in eccesso vengono rimossi e quindi restituiti al corpo. Questo circuito extracorporeo (la macchina per dialisi e i suoi tubi di collegamento da e verso il paziente) è un ambiente procoagulante.
Emodialisi, emofiltrazione ed emodiafiltrazione
Le moderne macchine per dialisi hanno l’opzione per l’emofiltrazione (HF) e l’emodialisi (HD), consentendo la possibilità di tre diverse modalità dialitiche per il trattamento dell’AKI: emodialisi (HD); emofiltrazione (HF); ed emodiafiltrazione (HDF).
Al centro di tutte e tre le modalità è la membrana semipermeabile che costituisce un filtro del sangue. Mentre il sangue pompato dal paziente scorre su un lato di questa membrana, l’acqua in eccesso e i soluti di scarto passano attraverso la membrana. Il filtrato o l’effluente viene pompato per sprecare mentre il sangue filtrato viene restituito al paziente.
Il processo di emodialisi (HD) prevede l’uso di un fluido di dialisi che scorre continuamente e controcorrente al sangue dall’altra parte della membrana. La composizione e la portata del fluido di dialisi assicurano un gradiente di concentrazione costante attraverso la membrana semipermeabile rispetto ai soluti del sangue. Questi gradienti di concentrazione a loro volta facilitano la diffusione controllata delle molecole di soluto attraverso la membrana.
Per soluti, come l’urea e la creatinina, che deve essere rimosso dal sangue, il gradiente di concentrazione è tale che la direzione di diffusione dal sangue al liquido di dialisi, mentre per i soluti come bicarbonato, che spesso deve essere aggiunta al sangue per correggere l’acidosi lattica associato con grave AKI, liquido di dialisi con bicarbonato di alta concentrazione relativa di sangue assicura che la diffusione è nella direzione opposta, dal liquido di dialisi del sangue. La regolazione della composizione del fluido di dialisi e della portata consente quindi una correzione metabolica specifica del paziente.
L’eccesso di liquidi è spesso una caratteristica dell’AKI che viene corretta durante l’emodialisi. Ciò è ottenuto mediante ultrafiltrazione, che dipende dal gradiente di pressione idrostatica che esiste attraverso la membrana semipermeabile. La pressione idrostatica positiva relativa sul lato sanguigno della membrana “spinge” efficacemente l’acqua dal sangue al fluido di dialisi.
Questa ultrafiltrazione facilita anche il passaggio di molecole di soluto, che vengono trascinate insieme all’acqua durante l’ultrafiltrazione da un meccanismo chiamato convezione del soluto (o resistenza al solvente). L’effetto combinato della diffusione del soluto, della convezione del soluto e dell’ultrafiltrazione durante l’emodialisi mira a garantire che il volume e la composizione del fluido all’interno del compartimento sia extracellulare che intracellulare siano ripristinati, il più vicino possibile, a quello che appartiene a quelli con reni normalmente funzionanti.
L’emodiafiltrazione (HDF) è la combinazione di HF e HD. Consente una clearance ottimale dei soluti a basso peso molecolare per diffusione al fluido di dialisi, combinata con una clearance ottimale dei soluti ad alto peso molecolare per convezione e ultrafiltrazione. Come con HF, HDF richiede fluido di sostituzione continuo; e come con HD, HDF richiede fluido di dialisi.
Inizio e tempi di RRT per AKI – intermittente rispetto a RRT continuo
Tutte le terapie di sostituzione renale (PD, HD, HF e HDF) possono essere somministrate in modo intermittente (cioè tipicamente in 3-4 sedute orarie) o in modo continuo fino al ripristino della funzionalità renale. Per i pazienti con insufficienza renale allo stadio terminale, che richiedono una RRT (cronica) per tutta la vita, il trattamento è esclusivamente emodialisi intermittente (IHD), quasi invariabilmente erogata in quattro sessioni orarie, tre volte alla settimana .
I pazienti con AKI hanno solo un requisito temporaneo per la RRT per supportare la funzionalità renale durante la risoluzione della malattia critica/acuta che ha precipitato AKI. La durata media della RRT tra i pazienti con AKI è di circa 13 giorni, anche se in casi particolari può essere necessaria solo per alcuni giorni o protrarsi per molte settimane.
Tradizionale (in valore assoluto) indicatori per l’avvio di RRT in AKI includono:
• iperkaliemia (potassio nel plasma > 6.0-6.5 mmol/L)
• grave uremia (plasma urea > 30 mmol/L)
• segni di encefalopatia uremica
• acidosi (pH • edema polmonare acuto
può essere utile iniziare il trattamento prima di queste conseguenze estreme di AKI sono evidenti, ma la tempistica ottimale per l’avvio (e fermare) RRT è attualmente poco chiaro e oggetto di ricerca in corso . Attualmente non esistono dati affidabili a supporto di un particolare tipo di RRT per AKI e di conseguenza sono stati impiegati tutti i tipi di RRT.
Le linee guida attuali, tuttavia, riflettono un consenso sul fatto che, qualunque sia la modalità, la RRT dovrebbe essere erogata in modo continuo piuttosto che intermittente ai pazienti più critici (emodinamicamente instabili). Recenti indagini indicano che al giorno d’oggi le terapie sostitutive renali continue (CRRT) sono utilizzate molto più frequentemente delle terapie intermittenti per AKI e che la CRRT più comunemente utilizzata è l’emofiltrazione venosa venosa continua (CVVHF), seguita dall’emodiafiltrazione venosa venosa continua (CVVHDF).
Anticoagulazione durante la terapia sostitutiva renale continua (CRRT)
La CRRT, in comune con tutte le altre terapie sostitutive renali ad eccezione della dialisi peritoneale, comporta il pompaggio del sangue attraverso un circuito extracorporeo non fisiologico. La proprietà intrinseca del sangue di coagulare (coagulo) a contatto con superfici non fisiologiche determina che per mantenere un circuito extracorporeo del paziente “privo di coaguli”, il sangue deve essere anticoagulato.
Il CRRT ha una particolare necessità di anticoagulazione, rispetto alle modalità intermittenti, a causa delle sessioni di trattamento prolungate e della velocità relativamente lenta con cui il sangue viene pompato attraverso il circuito . Inoltre, il sangue dei pazienti che richiedono CRRT è spesso già in uno stato procoagulante relativo a causa di malattia critica sottostante (ad esempio sepsi) o trauma .
Per molti anni l’eparina, eparina non frazionata (UF) o eparina a basso peso molecolare (LMWH), è stato l’unico anticoagulante utilizzato nelle procedure dialitiche, inclusa la CRRT. L’eparina continua ad essere utilizzata; è un mezzo economico e generalmente sicuro di anticoagulazione per la maggior parte dei pazienti che richiedono RRT.
Tuttavia, l’anticoagulazione sistemica dell’eparina, che non può essere evitata, porta inevitabilmente con sé un aumento del rischio di sanguinamento, in modo che l’anticoagulazione dell’eparina durante le procedure dialitiche sia assolutamente controindicata per coloro che stanno attualmente sanguinando o con un rischio di sanguinamento superiore al normale.
Inoltre, l’eparina può, in una piccola minoranza (
Il potenziale sanguinamento e i rischi di HIT-II associati all’uso di eparina hanno evidenziato la necessità di un anticoagulante alternativo per alcuni pazienti che richiedono RRT. Il citrato ha fornito una tale alternativa. L’anticoagulazione regionale del citrato del circuito di dialisi, utilizzata per la prima volta con successo nei primi anni ‘ 80 , era originariamente riservata a quella piccola minoranza di pazienti per i quali l’eparina è controindicata. Ciò è cambiato con i risultati di studi randomizzati controllati che confrontano il CRRT eparina-anticoagulante con il CRRT citrato-anticoagulante; questi hanno dimostrato che il citrato è sia un anticoagulante più efficace che più sicuro dell’eparina .
Il citrato è di conseguenza emerso negli ultimi anni come anticoagulante di scelta per tutti i pazienti AKI che richiedono CRRT . Le unità di terapia intensiva in tutto il mondo stanno ora segnalando il passaggio dall’eparina all’anticoagulante citrato regionale per la CRRT . Alcune autorità raccomandano addirittura l’uso di citrato piuttosto che di anticoagulante eparina per l’emodialisi intermittente (cronica) (IHD).
Citrato-il meccanismo della sua azione anticoagulante e la sua applicazione in CRRT
Citrato, che è stato utilizzato per anticoagulante / preservare il sangue donato per trasfusione per oltre un secolo, impedisce al sangue di coagulazione attraverso la sua capacità di legare (chelato) il calcio ionizzato (iC) che circola nel plasma sanguigno. Questo iC è un cofattore necessario sia per l’aggregazione piastrinica che per parecchi punti chiave nelle vie intrinseche ed estrinseche di coagulazione che sono responsabili della produzione della fibrina e quindi, formazione del coagulo della fibrina.
La coagulazione del sangue è impedita dalla riduzione della concentrazione plasmatica di iC a circa 0,35 mmol / L (normale intervallo ref 1,15-1,30 mmol/L). Questo stato non fisiologico e gravemente ipocalcemico si ottiene aumentando la concentrazione di citrato plasmatico a circa 3 mmol / L (normale concentrazione di citrato plasmatico ~0,1 mmol/L ).
Sebbene ci siano differenze nel dettaglio delineate da Morabito et al, tutti i protocolli per l’anticoagulazione del citrato durante la CRRT comportano l’infusione continua di soluzione contenente citrato (solitamente citrato trisodico o soluzione acido-citrato-destrosio (ACD)) alla linea di prefiltro/dialisi, vicino a dove lascia il paziente, sia come soluzione separata o combinata con fluido sostitutivo prediluzione. La portata di questa infusione viene regolata per ottenere una concentrazione di citrato nel sangue di ~3 mmol / L, e quindi un plasma plasmatico di circa 0,35 mmol / L.
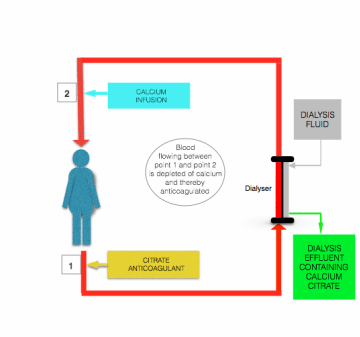
L’ipocalcemia indotta dall’infusione di citrato viene corretta prima che il sangue ritorni al paziente, mediante infusione di soluzione contenente calcio (cloruro di calcio o gluconato di calcio) sulla linea postfiltro vicino a dove entra nel paziente (vedere la figura sopra).
Il principale vantaggio di sicurezza dell’anticoagulazione citrato rispetto all’anticoagulazione eparina è che l’anticoagulazione è limitata al circuito extracorporeo. Questo cosiddetto “anticoagulante regionale” si ottiene perché la maggior parte del citrato infuso viene rimosso (come anioni di citrato o chelato di citrato di calcio) dal sangue durante il passaggio attraverso il filtro/dializzatore .
Qualsiasi citrato rimanente nel sangue postfiltro viene diluito in circolazione sistemica e rapidamente metabolizzato in anidride carbonica e acqua dal ciclo di Krebs dipendente dall’ossigeno nel mitocondrio delle cellule tissutali (prevalentemente cellule epatiche ).
Il metabolismo del citrato è associato alla produzione di bicarbonato: per ogni 1 mmol citrato metabolizzato, viene generato 3 mmol bicarbonato. La rapida clearance del citrato (l’emivita del citrato nel sangue è normalmente di circa 5 minuti ) attraverso questa via principalmente epatica garantisce normalmente l’assenza di anticoagulazione sistemica durante la CRRT, e quindi nessun ulteriore rischio di sanguinamento.
Potenziali disturbi metabolici durante la CRRT citrato-anticoagulante
L’apparente riluttanza ad abbracciare completamente la CRRT citrato-anticoagulante per tutti i pazienti AKI fino a poco tempo fa è stata attribuita alla preoccupazione per i disturbi acido-base ed elettrolitici che possono verificarsi nei pazienti che ricevono il trattamento .
I seguenti disturbi elettrolitici e acido-base sono stati riportati in pazienti trattati con CRRT citrato-anticoagulante :
• ipocalcemia/ipercalcemia
• hypomagnesia/hypermagnesia
• iponatremia/ipernatriemia
• alcalosi metabolica
• acidosi metabolica
Questi disturbi possono verificarsi per una serie di motivi, ma l’accumulo di citrate in circolazione periferica (citrate tossicità) può essere centrale per la maggior parte di questi disturbi. I motivi per cui il citrato può accumularsi durante la CRRT includono:
• Metabolismo alterato del citrato a causa di malattie epatiche e/o ridotta erogazione di ossigeno a causa di perfusione inadeguata (ad es. in settico/shock cardiogeno)
• Progressiva riduzione membrana pervietà durante la dialisi con conseguente ridotta filtrazione di citrato e concomitante aumento citrate consegna a circolazione sistemica
• errore di funzionamento accidentale aumento del tasso di citrato di infusione per il circuito extracorporeo e concomitante aumento della distribuzione del citrato di circolazione sistemica
• prodotto Sangue trasfusione citrate conservante presente nel sangue prodotti aggiunge citrate carico nella circolazione sistemica derivanti da CRRT
Indipendentemente dalla causa, l’accumulo di citrato nella circolazione periferica può provocare la chelazione citrata del calcio ionizzato circolante, con conseguente riduzione della concentrazione plasmatica di calcio ionizzato (ipocalcemia). Se l’ipocalcemia sufficientemente grave può causare aritmia cardiaca e, in definitiva, arresto cardiaco .
Sebbene il calcio ionizzato plasmatico sia ridotto durante l’accumulo di citrato (tossicità), il calcio totale è aumentato (indicando ipercalcemia) perché il calcio legato al citrato è incluso nel calcio totale misurato. Un aumento del rapporto tra totale e calcio ionizzato (normalmente 2,0) a > 2.1 è risultato essere il segnale più affidabile della tossicità del citrato in assenza di una stima del citrato plasmatico regolarmente disponibile .
Il rischio di aumento del sodio plasmatico (ipernatriemia) associato all’anticoagulazione del citrato è dovuto all’elevato contenuto di sodio (ipertonicità) di alcune soluzioni di citrato utilizzate nella CRRT. Ad esempio, la soluzione al 4% di citrato trisodico utilizzata in alcuni protocolli contiene sodio ad una concentrazione di 420 mmol/L. In pratica, l’uso di dialisi ipotonica/fluidi sostitutivi può mitigare questo rischio e l’ipernatriemia è a tutti gli effetti una rara complicazione dell’anticoagulazione del citrato .
Il rischio di ipomagnesia (magnesio sierico ridotto) durante l’anticoagulazione del citrato riflette il fatto che, in comune con il calcio, il magnesio è uno ion bivalente che può anche legarsi al citrato (chelato). Se le perdite di magnesio dovute all’azione chelante del citrato non sono completamente compensate dal magnesio nei liquidi di dialisi/sostituzione, può verificarsi ipomagnesia .
Monitoraggio biochimico dei pazienti trattati con CRRT citrato-anticoagulante
Test point-of-care utilizzando un analizzatore di gas del sangue situato all’interno dell’unità di terapia intensiva consente una misurazione rapida e conveniente della maggior parte dei parametri (calcio ionizzato, pH, bicarbonato, eccesso di base, sodio e lattato), ma la stima del calcio totale e del magnesio del siero non sono solitamente disponibili su queste piattaforme e i campioni devono essere inviati
Due recenti studi dimostrano che alcuni analizzatori di gas nel sangue potrebbero non essere affidabili nel misurare il calcio ionizzato alle concentrazioni estremamente basse e non fisiologiche (~0.3 mmol/L) presente nel sangue postfiltro, sebbene la loro capacità di misurare con precisione il calcio ionizzato plasmatico nella circolazione sistemica (dove la concentrazione è molto più alta) non sia in dubbio.
|
Parametro misurato |
Intervallo di monitoraggio |
Valori obiettivo o ca. intervalli di riferimento |
Scopo della misurazione |
Azione correttiva se fuori bersaglio |
|
Concentrazione di calcio ionizzato postfilter (Post), cioè sangue prelevato dalla porta postfilter. |
Entro 1 ora dall’inizio e dopo ogni cambio di dose di citrato, quindi ogni 4-6 ore |
0.25-0.35 mmol/L |
|
Regolazione citrate dose: se aumento iCa > 0.35, diminuire se iCa |
|
Sistemica calcio ionizzato (iCa), cioè il sangue campionato dal paziente |
Basale (prima di iniziare), poi 1 ora dopo la partenza, quindi almeno ogni 4-6 ore |
1.15-1.30 mmol/L |
|
Regolazione della velocità di infusione di calcio; se aumento iCa 1.30 |
|
Sistemica di calcio totale (TotCa), cioè sangue campionato dal paziente (TotCa = iCa + calcio legato all’albumina + calcio associato citrate) |
almeno ogni 12-24 ore (deve essere simultanea sistemica calcio ionizzato stima) |
Solo necessarie per la determinazione dell’ totCa:iCa rapporto (vedi sotto) |
||
|
Rapporto di totale di calcio ionizzato (TotCa:iCa) |
almeno ogni 12-24 ore |
Per rilevare citrate accumulo di tossicità a volte chiamato “citrate blocco” |
le Opzioni includono:
|
|
|
emogasanalisi
|
Basale (prima di iniziare) . Entro 1 ora dall’inizio, quindi almeno ogni 4-6 ore. |
pH 7.35-7.45 bicarb 23-28 mmol/L ESSERE–2-+3 mmol/L |
Per rilevare acido-base disturbi: alcalosi metabolica acidosi metabolica |
Opzioni in caso di alcalosi metabolica includono:
|
|
Siero di sodio |
una Volta al giorno |
135-145 mmol/L |
Per rilevare ipernatriemia/iponatriemia |
Raro – verificare il corretto dialisi e/o sostituzione del fluido |
|
lattato Sierico |
Basale (prima di iniziare), poi in base alle esigenze cliniche |
Per aiutare a identificare coloro che sono a rischio di tossicità citrate |
prendere in Considerazione, insieme con TotCa:iCa rapporto, il rischio di tossicità citrate |
|
|
magnesio nel Siero |
almeno una volta al giorno |
Per rilevare hypomagnesia |
Correzione con infusione di magnesio |
TABELLA II: Biochimica di monitoraggio durante citrate-anticoagulati CRRT (Rif 24)