Cloruro di canali ionici e trasportatori: dalla curiosità per la natura e l’origine delle malattie umane per obiettivi di droga
Pubblicato il: 20 agosto 2013 | |
all’Inizio della loro formazione universitaria, lo studente viene introdotto ai vari tipi di proteina integrale di membrana: recettori, proteine di adesione, canali ionici, pompe ioniche e trasportatori di ioni. Mentre progrediscono attraverso i loro studi, scoprono che le famiglie di geni discreti e le strutture proteiche sono responsabili di queste diverse classi proteiche e non c’è mai alcun motivo per considerare che potrebbe esserci qualche ambiguità nell’assegnare una particolare proteina alla sua classe proteica appropriata.
Questo soddisfa praticamente ogni caso dalla classe al laboratorio di ricerca fino a quando non consideriamo i canali del cloruro. Sappiamo che esistono, sono importanti e potrebbero essere buoni bersagli farmacologici in diverse aree della malattia, ma fino a poco tempo fa sono rimasti un po ‘ stigmatizzati e fuori moda nel mondo della terapia. La mancanza di ligandi selettivi non ha aiutato affatto. L’unica eccezione a questo è stato il recettore GABA-A che è accoppiato ad un canale cloruro intrinseco che si apre al legame del neurotrasmettitore inibitorio GABA. Le benzodiazepine hanno potenziato questo recettore da quando il Valium è diventato disponibile negli 1960, fornendo effetti sedativi e anticonvulsivanti. Questo introduce un concetto importante: ci sono diverse famiglie di geni e diversi tipi di proteine che possono essere descritti come canali del cloruro.
Questo è in contrasto con ciò che comprendiamo dei canali ionici selettivi cationici dove c’è poca flessibilità nella struttura proteica che può formare un poro selettivo per potassio, sodio o calcio; la diversità di questi canali ionici è causata dalle variazioni nei domini proteici distinti dal poro che influenzano il comportamento di apertura-chiusura. Per essere onesti, non sembrano esserci molte ragioni fisiologiche per cui un canale anionico dovrebbe esibire la selettività del cloruro in quanto c’è poco ruolo fisiologico nel trasporto della membrana di altri alogenuri o piccoli anioni; qualsiasi canale anionico sarà per impostazione predefinita un canale di cloruro da un punto di vista fisiologico. D’altra parte, le correnti di membrana di potassio, sodio e calcio svolgono ruoli fondamentali diversi e la permeabilità selettiva della membrana a questi cationi è cruciale per la funzione cellulare e in effetti la vita stessa.
I recettori GABA-A sono membri delle famiglie di canali ionici ligand-gated pentamerici cys-loop, che includono diversi tipi di canali gated neurotrasmettitori eccitatori e inibitori. La proteina del regolatore transmembrana della fibrosi cistica (CFTR) è un canale del cloruro regolato da nucleotidi. È un membro della diversa famiglia di trasportatori ABC (ATP-binding cassette) ed è l’unico che non sembra trasportare alcun substrato attraverso una membrana, ma piuttosto funziona come un canale di cloruro. La famiglia CLC dei canali del cloruro voltaggio-gated deriva da un’altra famiglia distinta del gene ed ha una struttura generale unica fra le proteine di membrana. Questa famiglia di proteine ha portato molte sorprese negli ultimi 30 anni e i membri di questa famiglia saranno introdotti qui e anche come potrebbero essere considerati bersagli farmacologici.
Altri sviluppi interessanti dal campo del canale del cloruro sono emersi in seguito all’identificazione molecolare delle proteine sottostanti i canali del cloruro attivato dal calcio (ClCa). Funzionalmente, conosciamo da tempo i loro ruoli fisiologici, ma la recente identificazione molecolare delle proteine del canale ha permesso lo sviluppo di strumenti molecolari e farmacologici per sondare e alterare la loro attività. Questa revisione si concentra sul potenziale farmacologico del targeting dei canali ClCa e delle proteine CLC; la loro funzione e localizzazione subcellulare sono riassunte nella Figura 1.
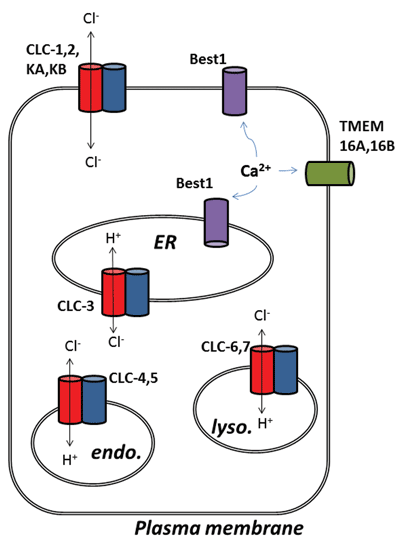
Figura 1
Introduzione alle proteine CLC
I nove membri di questa famiglia proteica sono CLC-1 a 7, CLC-KA e KB. Il membro fondatore, CLC-1, è il canale del cloruro voltaggio-gated del muscolo scheletrico e sarà discusso sotto. Molti studi funzionali sono stati condotti su un omologo con il titolo onorifico di CLC-0, isolato dall’organo elettrico Electroplax, che consente al raggio di stordire le sue vittime acquatiche. La ricostituzione di CLC-0 in doppi strati lipidici e la registrazione elettrofisiologica delle correnti che fluiscono attraverso singoli canali ionici hanno rivelato una proprietà intrigante. Di solito, quando si registra la corrente da una piccola porzione di membrana contenente un singolo canale ionico, si osservano fluttuazioni tra due ampiezze di corrente: una che rappresenta il canale chiuso e l’altra che rappresenta la corrente che scorre attraverso il canale aperto. Le fluttuazioni riflettono le transizioni tra stati cinetici aperti e chiusi. Con CLC-0, tuttavia, era evidente che la singola proteina del canale ionico consisteva in due pori equivalenti che potevano aprirsi indipendentemente1. Questo canale è stato quindi descritto come a doppia canna (Figura 2). Non fu quindi una grande sorpresa che le strutture cristalline degli omologhi dei batteri enterici rivelassero che il complesso proteico era un dimero, con ogni subunità che possedeva un percorso di conduzione ionica2 (Figura 2).
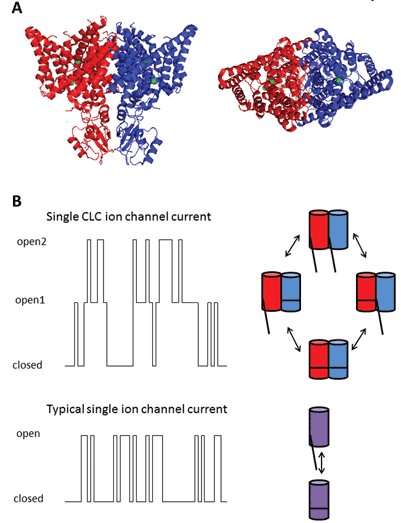
Figura 2
La seconda sorpresa è emersa quando sono stati condotti esperimenti funzionali dettagliati su CLC-ec1 da E. coli. Piuttosto che funzionare come un canale di cloruro, come il suo parente a lungo perso nel muscolo scheletrico dei vertebrati, CLC-ec1 è un trasportatore di scambio 2Cl-/H+, o antiporter, con una rigorosa stechiometria di scambio 2:13. Questa proteina è importante per la sopravvivenza dei batteri enterici a basso pH4 ed è probabile che sfrutti un gradiente di cloruro per mantenere il pH cellulare ad un livello tollerabile. Le CLC procariotiche potrebbero quindi essere bersagli per gli inibitori nel trattamento dell’infezione patogena da E. coli o Salmonella4. La scoperta del comportamento di scambio ionico ha naturalmente stimolato ulteriori sforzi per determinare se uno qualsiasi di questo scambio cloruro-per-protone esistesse nei CLC dei mammiferi, partendo dal presupposto che lo scambio Cl–/H+ potrebbe essere la vera funzione dei CLC archetipici e quelli identificati come canali del cloruro potrebbero essere solo eccezioni alla regola. Questo sembra essere il caso in quanto vi è una forte evidenza che CLC-3 fino a CLC-7 funzionano come trasportatori di scambio 2Cl–/H+, che risiedono principalmente negli organelli intracellulari, mentre CLC-1, CLC-2, KA e KB sono veri canali ionici conduttori di cloruro di membrana plasmatica5-9. Poiché la proprietà archetipica del CLC è il trasporto di scambio, che si trova in tutte le forme di vita cellulare, quest’ultima sottoclasse di proteine, i canali del cloruro in buona fede, può quindi essere considerata trasportatori di cloruro “rotti”, che hanno perso l’accoppiamento del trasporto del cloruro al movimento di un secondo substrate substrato.
CLC-1
Questo fondatore della famiglia CLC è il canale del cloruro voltaggio-gated del muscolo scheletrico e serve per regolare il potenziale di membrana e ripolarizzare la membrana dopo i potenziali di azione per rilassare il muscolo. Nella maggior parte dei tessuti, ci si aspetterebbe che i canali del potassio svolgano questo ruolo, cosa che fanno nel muscolo cardiaco e liscio, oltre a regolare l’eccitabilità della membrana in altri tipi di cellule. Il sistema tubulare trasversale è un’estensione della membrana plasmatica (sarcolemma) e penetra nel tessuto contrattile. È fondamentale per la rapida diffusione dell’attività elettrica in tutto il muscolo e orchestra la contrazione rapida e controllata. L’efflusso di potassio dalle cellule muscolari nello spazio ristretto del tubulo t aumenterebbe la concentrazione extracellulare di potassio e collasserebbe questo gradiente ionico, il che porterebbe a una prolungata depolarizzazione della membrana. Con i canali del cloruro che svolgono il ruolo repolarizzante predominante, questo è impedito. Perdita della funzione le mutazioni nel CLC-1 portano alla miotonia nell’uomo, nelle capre e nei topi (per una recente revisione vedere10) ed è caratterizzata da un compromesso rilassamento muscolare, coerente con la perdita di una corrente di membrana ripolarizzante.
Con l’espressione limitata al muscolo scheletrico, CLC-1 potrebbe essere un bersaglio attraente per i farmaci che controllano la contrazione muscolare aumentando o diminuendo la funzione CLC-1 e quindi ridurre o aumentare l’eccitabilità muscolare, rispettivamente. I composti che aumentano la funzione CLC-1 potrebbero essere in grado di trattare la miotonia, in particolare nei casi in cui potrebbero compensare la perdita parziale dell’attività del canale del cloruro. L’inibizione di CLC-1 potrebbe ridurre la soglia per la contrazione muscolare e può essere utile nei casi di debolezza muscolare o malattie degenerative come la distrofia muscolare.
CLC-2
Il canale cloruro rettificante verso l’interno, CLC-2, ha una distribuzione tissutale piuttosto diffusa. Può essere trovato nei neuroni centrali dove regola l’attività neuronale11-13. Negli astrociti, il suo targeting subcellulare alle giunzioni cellulari è regolato da un’interazione con GlialCAM (MLC1), mutazioni in cui interrompono questo targeting e causano leucoencefalopatia megalencefalica14. I recenti interessi terapeutici coinvolgono l’espressione di CLC-2 nella mucosa intestinale e nei bronchioli polmonari, dove svolge un ruolo rispettivamente nelle secrezioni intestinali e polmonari. Lubiprostone, un farmaco usato clinicamente per alleviare la stitichezza è stato proposto di esercitare il suo effetto attivando CLC-2, ma questo effetto è controverso. Mentre questo composto attiva i canali CLC-2 in alcuni studi, in altri regola il traffico di CLC-2 e aumenta la funzione CFTR tramite l’attivazione del recettore delle prostaglandine15,16. Tuttavia, rimangono prove sufficienti che l’aumento della funzione CLC-2 delle vie aeree potrebbe fornire una via alternativa del cloruro nella fibrosi cistica17.
CLC-KA / KB
Questi canali del cloruro sono espressi notevolmente negli epiteli renali e contribuiscono alla permeabilità delle membrane cellulari al flusso passivo del cloruro. Hanno un ruolo chiave nell’arto ascendente e nei tubuli distali del nefrone, fornendo una via basolaterale per il riassorbimento del cloruro, in seguito al trasporto dall’urina primaria attraverso la membrana apicale. Il gene CLCKB, che codifica CLC-KB, è uno dei cinque geni alla base della sindrome di Bartter. Le mutazioni di perdita di funzione nel risultato di CLC-KB nel riassorbimento difettoso del cloruro e così piombo ad un disordine di spreco del sale, che è associato con poliuria. Una delle caratteristiche principali degli individui affetti da mutazioni CLC-KB (tipo III di Bartter) è la bassa pressione sanguigna. Una forma più grave della malattia è causata da mutazioni nel gene BSND (Bartter’s type IV), che codifica la Barttina, una proteina accessoria importante per il traffico di CLC-KA e KB nella membrana plasmatica18. Questa forma del disturbo comprende anche la sordità sensoriale, che si pensa sia causata dalla perdita di traffico di CLC-KA e KB alle membrane epiteliali nell’orecchio interno. Presumibilmente, la perdita di attività CLC-KA o KB, ma non entrambe, può essere tollerata dal sistema uditivo. Ciò suggerisce che gli inibitori selettivi per CLC-KA o CLC-KB, o l’inibizione parziale di entrambi, possono agire come un nuovo diuretico del ciclo con il potenziale per abbassare la pressione sanguigna e con pochi effetti collaterali. Ciò ha portato allo studio della loro farmacologia e allo sviluppo di nuovi derivati inibitori con bassa affinità micromolare19, che hanno avuto effetti diuretici quando somministrati ai rats20. D’altra parte, i farmaci che attivano i canali CLC-KB possono migliorare l’attività residua dei canali difettosi nei pazienti di tipo III di Bartter.
CLC-7
Della sottoclasse del trasportatore di scambio 2Cl–/H+, CLC-7 è un obiettivo promettente per azione della droga e la sua inibizione può essere utile nell’osteoporosi. Ancora una volta, questa indicazione prende la sua origine dalle osservazioni della malattia umana causata dalle mutazioni di perdita di funzione in CLC-7, che causano osteropetrosis21. In questo disturbo, il rimodellamento osseo da parte degli osteoclasti è carente, che si pensa sia causato da una secrezione difettosa di acidi ed enzimi. Questo porta a osso denso, che se riprodotto da un inibitore CLC-7 potrebbe ridurre la dissoluzione dell’osso e quindi rafforzare lo scheletro dei pazienti con osteoporosi22,23. Negli studi proof-of-concept, l’inibizione farmacologica dell’acidificazione24 o l’interruzione della funzione CLC-7 da parte degli antibodies25 hanno ridotto il riassorbimento osseo. Tuttavia, l’inibizione di CLC-7 non può essere senza complicazioni perché gli studi del topo e dell’uomo suggeriscono che la mancanza di funzione di CLC-7 può anche essere associata con i disordini neuronali di degenerazione e di stoccaggio a causa della funzione lisosomiale ridotta26.
Mutazioni umane a perdita di funzione-lezioni da CFTR
Vale la pena una breve pausa a questo punto per considerare che alcune delle indicazioni terapeutiche per nuovi farmaci mirati alla CLC mirano a trattare disturbi distinti e all’estremità opposta dello spettro rispetto a quelli causati da una funzione CLC difettosa. Oltre a quelli sopra descritti, la malattia I di Dent è una malattia renale legata all’X causata dalla perdita della funzione CLC-5 (vedere27 per una recente revisione). Tutti sono rari disturbi ereditari e un grave difetto proteico comporta una ridotta attività proteica o il traffico verso la membrana bersaglio. Infatti, molte mutazioni individuali causano ER-ritenzione e una mancanza di maturazione delle proteine. Un parallelo potrebbe essere fatto con la fibrosi cistica, con la maggior parte delle persone colpite che possiedono la mutazione ΔF508 mantenuta da ER. Approcci recenti e stratificati per il trattamento della fibrosi cistica sono stati il risultato di un attacco a doppia punta per correggere il ripiegamento delle proteine mutanti (correttori CF) e/o aumentare l’attività dei canali del cloruro CFTR della membrana plasmatica (potenziatori CF). Il successo sta emergendo con i potenziator class28, che sono efficaci nei pazienti con mutazioni che riducono l’attività CFTR senza perdita di biosintesi proteica o traffico (ad esempio G551D), tuttavia l’efficacia dei correttori pieghevoli (che è necessaria nella maggior parte dei casi) rimane da stabilire29. Sebbene le malattie associate alla perdita della funzione CLC siano tutte malattie genetiche rare, potremmo un giorno essere in grado di trattare individui con miotonia, sindrome di Bartter, malattia di Dent e osteopetrosi, così come la fibrosi cistica con farmaci che correggono la causa reale del loro disturbo.
Canali del cloruro attivati dal calcio
Infine, si farà menzione dei canali del cloruro attivato dal calcio (ClCa), che hanno ruoli fisiologici chiaramente definiti in un certo numero di tipi di cellule, ma la loro identificazione molecolare ha subito alcuni inizi falsi e balbuzienti. La storia coinvolge quattro tipi di proteine: membri delle famiglie di geni CLCA, Bestrophin, Titti e TMEM16. In tutti i casi, la loro sovraespressione ricombinante ha determinato la generazione di correnti di cloruro di membrana che sono stimolate aumentando la concentrazione intracellulare di calcio e, in misura variabile, la depolarizzazione di membrana. Il viaggio per CLCA si è concluso quando si è scoperto che si trattava di una proteina secreta, ma che probabilmente ha anche sovraregolato l’espressione di membrana dei canali ClCa endogeni al sistema di espressione30. Le proteine Tweety e Bestrophin non presentano tutte le proprietà dei canali ClCa studiati nei principali tessuti, sebbene Best1 appaia responsabile di un componente di ClCa nei neuroni sensori31 e possa anche essere un importante regolatore del rilascio di calcio dal reticolo endoplasmatico32,33. Tre studi indipendenti hanno proposto TMEM16A (chiamato anche Ano1) come candidato per un componente principale, se non nella sua interezza, per un canale di cloruro attivato dal calcio34-36. Molti studi successivi, facilitati dalla generazione di strumenti molecolari, lo hanno supportato. TMEM16A è importante per la regolazione dell’eccitabilità della membrana nel muscolo liscio vascolare, è sovraregolato in un modello animale di ipertensione polmonare e il tono può essere ridotto dall’inibizione del canale37, 38. Nei neuroni sensoriali, TMEM16A accoppia la presenza di mediatori infiammatori all’ipereccitabilità della membrana e l’inibizione di TMEM16A ha effetti antinociceptivi39. Nei modelli animali di asma, l’espressione di questo particolare canale del cloruro è aumentata e la sua inibizione può avere effetti beneficiari40. Si trova anche nelle cellule interstiziali del Cajal dell’intestino e la funzione del canale è necessaria per la contrazione ritmica della muscolatura liscia nella parete intestinale41. Inoltre, l’attivazione di TMEM16A può fornire una via alternativa per la secrezione di cloruro epiteliale nella fibrosi cistica42. Mentre c’è ancora qualche dibattito sulla funzione precisa del resto della famiglia TMEM16, la funzione ClCa è stata anche attribuita a TMEM16B (Ano2), che si pensa sia alla base del canale ClCa nelle cellule olfattive dei capelli43,44. Ci possono anche essere ruoli per questa classe di canale ionico nella biologia delle cellule tumorali e la sua inibizione può prevenire la proliferazione delle cellule45-48.
Osservazioni conclusive
Questa recensione ha evidenziato i diversi ruoli delle proteine che conducono o trasportano il cloruro e come la loro disfunzione sia accoppiata a disturbi umani o sintomi simili a malattie nei modelli animali. Vi è una grave mancanza di reagenti farmacologici che inibiscono, attivano o migliorano il traffico di membrana dei canali e dei trasportatori del cloruro. Si stanno facendo progressi con farmaci che invertono la funzione difettosa della CFTR nella fibrosi cistica, che si spera si tradurrà in farmaci specifici per i diversi tipi di mutazione ereditaria. Gli inibitori e gli attivatori dei canali del cloruro calcio-attivati TMEM16A42, 49 si stanno dimostrando utili strumenti di laboratorio e nuovi composti potrebbero produrre farmaci efficaci, in particolare se possono fornire effetti specifici per i tessuti. Le molecole specifiche per particolari CLC sono probabilmente le più sfuggenti. Comprendere le basi strutturali dell’attivazione di CLC voltage-gated 50 potrebbe identificare i domini proteici che sono bersagliabili dalla progettazione razionale dei farmaci basati sulla struttura. Tali strumenti ci permetteranno di mettere alla prova alcune delle nuove idee terapeutiche che sono state riviste e presentate qui.
Biografia dell’autore

Dr Jon Lippiat ha completato il suo dottorato di ricerca sulla struttura, funzione e farmacologia dei canali del potassio presso l’Università di Leicester. Ha studiato la funzione delle beta-cellule pancreatiche e il diabete presso l’Università di Oxford prima della sua nomina a docente di Farmacologia presso l’Università di Leeds. La sua ricerca coinvolge chiarire le proprietà strutturali e fisiologiche di diversi tipi di canali ionici e trasportatori e il loro potenziale targeting da nuovi reagenti farmacologici.
Problema
Problema 4 2013
Argomenti correlati
Canali cloruro, bersagli farmacologici, Canali ionici