Dr. Chittaranjan Das
L’obiettivo principale del laboratorio è quello di comprendere il ruolo funzionale deubiquitinating enzimi (deubiquitinases o DUBs) in percorsi cellulari, in particolare quelli implicati nella neurodegenerazione (progressiva perdita di neuroni), come il morbo di Alzheimer (AD) e il morbo di Parkinson (PD). Un’ampia varietà di processi biologici è controllata dalla modifica reversibile e post-traslazionale delle proteine mediante l’attaccamento covalente dell’ubiquitina, un polipeptide eucariotico a 76 residui altamente conservato. L’ubiquitinazione può essere considerata come l’evento iniziale di una cascata di segnalazione (segnalazione di ubiquitina) che alla fine viene terminata dalla rimozione idrolitica del tag ubiquitina da parte di un DUB. Un’indagine sul genoma umano rivela la presenza di circa 90 DUBs, suggerendo il loro coinvolgimento in un’ampia varietà di percorsi biochimici. Il nostro approccio allo studio dei DUBs si basa sull’applicazione combinata di una serie di strumenti che includono la sintesi chimica di sonde di piccole molecole, la cristallografia a raggi X e la proteomica basata sulla spettrometria di massa.
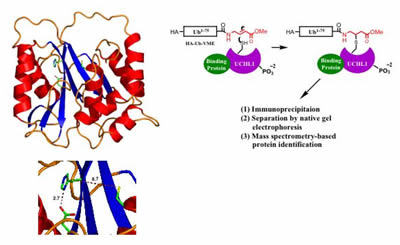
Struttura di UCHL1 determinato dalla cristallografia a raggi X suggerisce che l’enzima può adottare due stati, uno stato inattivo (in cui i residui catalitici sono allineati, mostrato a sinistra) e un putativo stato attivo – in cui i residui sono portati in allineamento interazione della proteina con sconosciuto cofattori. Un metodo proposto per l’identificazione dei cofattori di UCHL1 tramite purificazione basata sull’attività da estratti di cellule intere (a destra).
Attualmente, stiamo studiando la normale funzione del neuronal DUB ubiquitin C-terminal hydrolase L1 (UCHL1)- una proteina neurone-specifica associata al PD di funzione fisiologica sconosciuta. I nostri sforzi in questa direzione sono finalizzate a sviluppare la cellula permeabile a piccole molecole inibitori della UCHL1 che può essere utilizzato per sondare la sua funzione (sia normale e associata a malattia), determinando il suo partner di associazione per affinità in base purificazione di estratti di cellule intere, e di definire le basi molecolari di come una naturale variante di questo enzima nella quale Ser alla posizione 18 è sostituito da Tyr (chiamato S18Y polimorfo)-fornisce una protezione da malattia di Parkinson (PD). Oltre a UCHL1, stiamo anche conducendo indagini strutturali e meccanicistiche di altri enzimi correlati che si ritiene siano coinvolti in processi biochimici fondamentali come la riparazione del DNA, la modifica degli istoni e l’endocitosi delle proteine della membrana plasmatica.
Istruzione
- Dottorato di ricerca., Indian Institute of Science, 2001
- Postdoctoral Fellow, Harvard Medical School e Brandeis University, 2006
Riconoscimenti
- Senior Research Fellowship, University Grants Commission, India , 1996
Pubblicazioni
Elenco delle pubblicazioni