Frontiere in Endocrinologia
- Introduzione
- Materiali e metodi
- Progettazione dello studio e caratteristiche dei partecipanti
- Intervento
- Valutazione dei risultati
- Isolamento delle cellule linfocitarie
- Estrazione di RNA e PCR in tempo reale (RT-PCR)
- Dimensione del campione e metodi statistici
- Risultati
- Discussione
- Effetti del cromo sull’espressione genica dell’insulina e del metabolismo lipidico
- Effetti del cromo sull’espressione genica dei marcatori infiammatori
- Contributi dell’autore
- Finanziamento
- Dichiarazione sul conflitto di interessi
Introduzione
sindrome dell’ovaio Policistico (PCOS), la principale causa di anovulazione e infertilità nelle donne in età riproduttiva, è il più comune disordine endocrino che colpisce il 5-10% delle donne in tutto il mondo (1). La lipolisi accelerata e la successiva dislipidemia nelle donne con PCOS sono associate ad anomalie metaboliche tra cui obesità, insulino-resistenza e diabete di tipo 2 (T2DM) (2). I cambiamenti riflessi nel fluido follicolare (FF) del follicolo dominante (3, 4) possono influenzare direttamente la qualità e il metabolismo dell’ovocita. L’infiammazione cronica di basso grado è comunemente accusata come meccanismo eziopatogenetico di infertilità. Le citochine infiammatorie sono significativamente più alte tra le donne con infertilità inspiegata (5). È stato dimostrato che i fattori proinfiammatori sono significativamente associati a più alti tassi di fallimento della fecondazione in vitro (IVF), specialmente nella fase di impianto, tra le donne con infertilità inspiegata (6). Gli studi hanno rilevato livelli elevati di interferone gamma (IFN-γ) e interleuchina-2 (IL-2) e livelli ridotti del fattore di crescita trasformante beta (TGF-β), un importante mediatore antinfiammatorio endogeno, (7) nel plasma di donne con infertilità inspiegata rispetto ai controlli fertili durante la finestra di impianto (fase luteale) (8). Inoltre, pazienti infertili inspiegabili hanno dimostrato livelli elevati di IL-2, IL-4, IL-6, IL-21, fattore di necrosi tumorale alfa (TNF-α) e IFN-γ, rispetto alle donne fertili (5).
Gli effetti benefici degli integratori di cromo sono già stati segnalati sulle anomalie metaboliche tra le donne che soffrono di PCOS. In una meta-analisi condotta da Fazelian et al. (9), il completamento del cromo ha diminuito l’insulina del siero ed il testosterone libero ed ha migliorato il peso corporeo in pazienti con PCOS. Abbiamo già pubblicato i vantaggi di prendere integratori di cromo per 8 settimane sul controllo glicemico, i parametri di rischio cardiometabolico e lo stress ossidativo nelle donne infertili con PCOS che erano candidati per la fecondazione in vitro (10). Inoltre, la supplementazione di cromo nei ratti diabetici ha mostrato attività anti-diabetiche, che possono essere spiegate attraverso l’impatto del cromo sulla modulazione del recettore gamma attivato dal proliferatore del perossisoma (PPAR-γ), substrato del recettore dell’insulina 1 (IRS-1) e proteine del fattore nucleare kB (NF-kB) (11). Allo stesso modo, Wang et al. (12) ha scoperto che rispetto ai ratti di controllo obesi, quelli integrati con cromo avevano un miglioramento significativo dei loro tassi di smaltimento del glucosio e un aumento dell’attività p-IRS-1 e fosfatidilinositolo-3 chinasi stimolati dall’insulina nei muscoli scheletrici. In un altro esperimento animale, l’ingestione di cromo per 7 settimane, da ratti diabetici, ha ridotto significativamente i marcatori infiammatori tra cui la proteina C-reattiva (CRP), il TNF-α e IL-6 (13).
Considerando gli effetti anti-diabetici e ipolipemizzanti del cromo (11, 14), abbiamo ipotizzato che la supplementazione di cromo potrebbe essere utile nelle donne con PCOS e candidato per la fecondazione in vitro, che soffre di diverse anomalie metaboliche. Secondo la nostra migliore conoscenza, nulla è stato pubblicato sugli effetti della supplementazione di cromo sull’espressione genica di insulina, lipidi e marcatori infiammatori in donne infertili con PCOS candidate alla fecondazione in vitro. Questo studio mirava a determinare gli effetti della supplementazione di cromo sull’espressione genica di insulina, lipidi e marcatori infiammatori in donne infertili che soffrivano di PCOS ed erano candidate per la fecondazione in vitro.
Materiali e metodi
Progettazione dello studio e caratteristiche dei partecipanti
Questo studio randomizzato, in doppio cieco, controllato con placebo è stato registrato dal sito web iraniano per la registrazione degli studi clinici (http://www.irct.ir:IRCT20170513033941N32). Sono state incluse quaranta donne infertili con PCOS, di età compresa tra 18 e 40 anni, candidate alla fecondazione in vitro senza precedenti precedenti di fecondazione in vitro. Questo studio è stato condotto nell’ospedale Taleghani, Teheran, Iran, tra febbraio e maggio 2018. I criteri di Rotterdam sono stati utilizzati per confermare la diagnosi di PCOS (15). I partecipanti con anomalie metaboliche tra cui disfunzione tiroidea, diabete o ridotta tolleranza al glucosio sono stati esclusi dallo studio. Questa indagine è stata eseguita in conformità con la Dichiarazione di Helsinki e le linee guida sulla buona pratica clinica ed è stata approvata dal comitato etico di ricerca dell’Università di Scienze Mediche Shahid Beheshti (SUMS), Teheran, Iran. Il consenso informato scritto è stato firmato da tutti gli individui.
Intervento
I partecipanti sono stati assegnati in modo casuale in gruppi di intervento per assumere 200 µg/die di cromo picolinato (Nature Made, California, USA) (n = 20) o placebo (Barij Essence, Kashan, Iran) (n = 20) per 8 settimane. Integratori di cromo e placebo sono stati abbinati in termini di forma, aspetto, odore e confezione. La randomizzazione è stata effettuata utilizzando numeri casuali generati dal computer. La randomizzazione e il processo di allocazione sono stati nascosti sia ai ricercatori che ai partecipanti fino al completamento delle analisi finali. Un’altra persona, non coinvolta nel processo e ignara di sequenze casuali, ha assegnato i soggetti ai flaconi numerati di compresse. L’aderenza agli integratori e ai placebo, durante tutto lo studio, è stata monitorata chiedendo agli individui di riportare i contenitori del farmaco. Per aumentare il tasso di conformità, tutti i partecipanti ricevevano brevi messaggi di promemoria giornalieri sui loro telefoni cellulari per assumere gli integratori. I partecipanti allo studio hanno completato i record dietetici alla settimana 0, 4 e 8 dell’intervento.
Valutazione dei risultati
I livelli sierici di proteina C-reattiva ad alta sensibilità (hs-CRP) sono stati considerati come risultato primario e i profili metabolici sono stati misurati come risultati secondari. Campioni di sangue a digiuno (15 mL) sono stati raccolti all’inizio e alla fine dell’intervento di 8 settimane presso l’Ospedale Taleghani (Teheran, Iran). I livelli di Hs-CRP sono stati misurati utilizzando il kit ELISA commerciale (LDN, Nordhorn, Germania) con varianze dei coefficienti inter – e intra-assay (CVs) inferiori al 7%. I livelli plasmatici di ossido nitrico (NO) sono stati misurati con il metodo Griess (16) con CV intra-test di < 5%.
Isolamento delle cellule linfocitarie
Campioni di sangue sono stati utilizzati per estrarre le cellule linfocitarie, utilizzando il 50% di percoll (Sigma-Aldrich, Dorset, UK). Il conteggio delle cellule e il test di vitalità sono stati condotti utilizzando l’estrazione di trypan blue, RNA e DNA (17).
Estrazione di RNA e PCR in tempo reale (RT-PCR)
L’RNA è stato estratto da campioni di sangue utilizzando il kit RNX-plus (Cinnacolon, Teheran, Iran). La sospensione di RNA è stata congelata a -20°C fino alla derivazione del cDNA. Dopo l’estrazione di RNA totali da ciascun campione, l’RNA è stato quantificato utilizzando lo spettrofotometro UV. Ogni campione OD 260/280 rapporto di 1,7 – 2,1 non ha rappresentato alcuna contaminazione con proteine o DNA (17). Usando la trascrittasi inversa del virus della leucemia murina di moloney (RT), l’RNA isolato è stato trascritto inverso nella libreria cDNA. Le espressioni del Gene del PPAR-gamma, trasportatore di glucosio 1 (GLUT-1), lipoproteine a bassa densità del recettore (LDLR), IL-1, IL-8, TNF-α, TGF-β, e fattore di crescita endoteliale vascolare (VEGF) sono stati condotti su cellule mononucleate (PBMCs) di sangue periferico, utilizzando SYBR green di rilevamento e di Ampliconi Kit e l’applicazione di RT-PCR quantitativa e Light Cycler tecnologia (Roche Diagnostics, Rotkreuz, Svizzera) (Tabella 1). I primer della gliceraldeide-3-fosfato deidrogenasi (GAPDH) sono stati usati come gene di pulizia. I primer sono stati progettati utilizzando il software Primer Express (Applied Biosystems, Foster City, USA) e il software Beacon designer (Takaposizt, Teheran, Iran). I livelli relativi di trascrizione sono stati calcolati utilizzando metodi Pffafi o 2-ΔΔCT.

Tabella 1. Primer specifici utilizzati per PCR quantitativa in tempo reale.
Dimensione del campione e metodi statistici
La dimensione del campione è stata calcolata utilizzando la formula stabilita per gli RCT, con errori di tipo uno (α) e di tipo due (β) sono stati considerati come 0,05 e 0.20 per fornire la potenza dell ‘ 80%. Sulla base di un precedente studio pubblicato (18), una differenza media (d) di 1500,0 ng/mL e una deviazione standard (DS) di 1496,1 ng/mL per hs-CRP sono state utilizzate per calcolare la dimensione del campione. Considerando un probabile abbandono di 4 soggetti in ciascun gruppo di intervento, la dimensione del campione finale è stata determinata per essere 20 (16 + 4) soggetti per gruppo.
La normalità dei dati è stata valutata utilizzando il test Kolmogorov-Smirnov. Le analisi sono state eseguite utilizzando l’approccio intention-to-treat (ITT). Campioni indipendenti t-test è stato applicato per determinare le differenze nelle misure antropometriche e l’espressione genica di insulina, lipidi e infiammazione tra i gruppi di intervento. Gli effetti della supplementazione di cromo sui marcatori infiammatori sono stati valutati utilizzando misure ripetute ANOVA test. Le differenze nelle proporzioni sono state valutate dal test esatto di Fisher. I P < 0,05 sono stati considerati statisticamente significativi. Le analisi statistiche sono state condotte utilizzando il pacchetto statistico per le scienze sociali versione 18 (SPSS Inc., Chicago, Illinois, Stati Uniti d’America).
Risultati
In ciascun gruppo di intervento sono stati segnalati tre abbandoni per motivi personali. Quindi, complessivamente 34 partecipanti hanno completato lo studio (Figura 1). Utilizzando l’approccio ITT, tutti i 40 partecipanti (20 in ciascun gruppo) sono stati inclusi nell’analisi finale dei dati. Il tasso di conformità in questo studio è stato elevato, con oltre il 90% delle compresse consumate durante l’intervento in entrambi i gruppi. In questo studio non sono stati riportati effetti collaterali a seguito del consumo di cromo nelle donne con PCOS.

Figura 1. Riassunto del diagramma di flusso del paziente.
Le misure antropometriche non erano statisticamente diverse tra i gruppi di intervento (Tabella 2). Inoltre, dopo la supplementazione di cromo, i risultati della fecondazione in vitro tra cui lo spessore endometriale, il numero di ovociti recuperati, il numero di ovociti fecondati, il tasso di fecondazione, il tasso di gravidanza e il numero di embrioni non erano significativamente diversi tra i gruppi integrati e placebo.

Tabella 2. Caratteristiche generali dei partecipanti allo studio.
Anche la media delle assunzioni di macro e micro – nutrienti non era significativamente diversa tra due gruppi di intervento durante il trattamento (Dati non mostrati).

Tabella 3. Marcatori infiammatori al basale e dopo l’intervento di 8 settimane nella sindrome dell’ovaio policistico infertile donne candidate alla fecondazione in vitro che hanno ricevuto integratori di cromo o placebo.
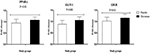
Figura 2. Fold change (means ± SDs) nei livelli di espressione genica di PPAR-γ, GLUT-1 e LDLR nelle donne con diagnosi di sindrome dell’ovaio policistico candidate alla fecondazione in vitro, che ricevevano integratori di cromo e placebo. Il valore P è stato ottenuto dal test t indipendente. N = 20 in ogni gruppo. IL-1, interleuchina-1; IL-8, interleuchina-8; LDLR, recettore delle lipoproteine a bassa densità ossidato; PPAR-γ, recettore attivato dal proliferatore del perossisoma gamma; TNF-α, fattore di necrosi tumorale alfa; TGF-β, fattore di crescita trasformante beta; VEGF, fattore di crescita endoteliale vascolare.
La supplementazione di cromo ha anche ridotto l’espressione genica di IL-1 (P = 0,004) nelle PBMC rispetto al placebo (Figura 3). Non vi è stato alcun effetto significativo della supplementazione di cromo sull’espressione genica di IL-8, TNF-α, TGF-β e VEGF nelle PBMC dei pazienti con PCOS.
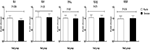
Figura 3. Variazione (media ± SDs) dei livelli di espressione genica di IL-1, IL-8, TNF-α, TGF-β e VEGF nelle donne con diagnosi di sindrome dell’ovaio policistico candidate alla fecondazione in vitro, che ricevevano integratori di cromo e placebo. Il valore P è stato ottenuto dal test t indipendente. N = 20 in ogni gruppo. IL-1, interleuchina-1; IL-8, interleuchina-8; LDLR, recettore delle lipoproteine a bassa densità ossidato; PPAR-γ, recettore attivato dal proliferatore del perossisoma gamma; TNF-α, fattore di necrosi tumorale alfa; TGF-β, fattore di crescita trasformante beta; VEGF, fattore di crescita endoteliale vascolare.
Discussione
Abbiamo trovato effetti benefici della somministrazione di cromo per 8 settimane in donne infertili con PCOS che erano candidati per la fecondazione in vitro. La supplementazione di cromo ha abbassato l’infiammazione e migliorato l’espressione genica di PPAR-γ, GLUT-1, LDLR e IL-1, anche se non ha influenzato l’espressione genica di IL-8, TNF-α, TGF-β e VEGF. Per la nostra migliore conoscenza, questo è il primo studio che riporta gli effetti della supplementazione di cromo sull’espressione genica relativa all’insulina, ai lipidi e ai marcatori infiammatori nelle donne infertili con diagnosi di PCOS e candidato alla fecondazione in vitro.
Effetti del cromo sull’espressione genica dell’insulina e del metabolismo lipidico
I pazienti con PCOS sono vulnerabili a diverse anomalie metaboliche, come aumento della resistenza all’insulina, dislipidemia e infiammazione cronica (19, 20). Lo studio corrente ha rivelato che il completamento del cromo per 8 settimane alle donne infertili con PCOS che erano candidati per IVF ha aumentato significativamente l’espressione genica di PPAR-γ, di GLUT-1 e di LDLR. Coerentemente con i nostri risultati, la somministrazione di cromo ai ratti diabetici ha mostrato attività anti-diabetiche, probabilmente correlate all’impatto del cromo sulla modulazione delle proteine PPAR-γ e IRS-1 (11). Wang et al. (12) ha anche scoperto che i ratti obesi integrati con cromo aumentavano significativamente i loro tassi di smaltimento del glucosio. Inoltre, rispetto ai controlli obesi, questi ratti hanno mostrato un aumento dell’attività della chinasi p-IRS-1 e della fosfatidilinositolo-3 stimolata dall’insulina nei muscoli scheletrici. In un altro studio, il cromo, la biotina o la loro combinazione hanno significativamente sovraregolato l’espressione PPAR-γ nel tessuto adiposo, che potrebbe avere un efficace impatto sensibilizzante all’insulina e ridurre la resistenza all’insulina in un modello di ratto diabetico (11). Il cromo può anche promuovere il traffico di GLUT-4 e il trasporto di glucosio stimolato dall’insulina (21). Allo stesso modo, i ratti con retinopatia diabetica che sono stati integrati con cromo per 12 settimane hanno mostrato un miglioramento nell’espressione genica di GLUT-1, GLUT-3 e insulina (22). PPAR-γ è il regolatore centrale di insulina, glucosio e metabolismo lipidico che è ampiamente espresso nel tessuto adiposo. PPAR-γ potrebbe migliorare la sensibilità all’insulina e i profili lipidici nei pazienti con diabete di tipo 2 e nei modelli di roditori diabetici (23). Le prove attuali suggeriscono che gli agonisti PPAR-γ possono essere utili nel ridurre i lipidi corticali renali e la proteinuria attraverso un meccanismo indipendente dal loro impatto ipoglicemico (24, 25).
Effetti del cromo sull’espressione genica dei marcatori infiammatori
Il nostro studio ha sostenuto che la somministrazione di cromo per 8 settimane ha ridotto significativamente l’espressione genica dei livelli di IL-1 e hs-CRP nel siero in donne infertili con PCOS candidate alla fecondazione in vitro, sebbene non abbia influenzato l’espressione genica di IL-8, TNF-α, TGF-β e VEGF. Le prove attuali che dimostrano gli effetti della supplementazione di cromo sull’espressione genica dei marcatori infiammatori e sui loro livelli circolanti sono scarse e per lo più limitate agli studi sugli animali. La supplementazione di cromo per 8 settimane ai ratti grassi diabetici Zucker (ZDF) ha ridotto significativamente i loro livelli sierici di CRP (26). In un altro studio, l’ingestione di cromo niacinato per 7 settimane ha ridotto i livelli di citochine pro-infiammatorie (TNF-α, IL-6 e CRP), lo stress ossidativo e le concentrazioni lipidiche nei ratti diabetici (13). Inoltre, la somministrazione di un integratore alimentare contenente cromo picolinato, fosfatidilserina, acido docosaesaenoico e boro per 12 settimane ha ridotto significativamente le concentrazioni di CRP e TNF-α nei ratti alimentati con una dieta ricca di grassi (27). Non abbiamo trovato alcun effetto significativo della supplementazione di cromo su IL-8, TNF-α, TGF-β e VEGF che potrebbe essere spiegato applicando diversi disegni di studio, tipo e dosaggi di cromo utilizzati, durata dell’intervento e caratteristiche dei partecipanti. Dosaggi più elevati di cromo possono migliorare significativamente i profili metabolici tra cui IL-8, TNF-α, TGF-β e VEGF. I marcatori di infiammazione e stress ossidativo sono elevati in molti pazienti diabetici, che rappresenta positivamente l’infiammazione vascolare (28). La resistenza all’insulina e la successiva infiammazione vascolare sono i principali fattori di rischio per lo sviluppo di CVD (29). L’effetto sopprimente del cromo sui marcatori pro-infiammatori può essere facilitato dall’inattivazione delle vie dello stress ossidativo e dalla riduzione della fosforilazione Akt associata alla cascata di insulino-resistenza nel fegato (30). Le prove attuali hanno dimostrato che un aumento delle citochine infiammatorie sono coinvolte negli esiti della fecondazione in vitro. In uno studio condotto da Haimovici et al. ( 31), le donne che hanno dato alla luce dal vivo il loro feto avevano livelli di IL-6 più bassi. L’inibizione delle cellule luteali che producono progesterone in presenza di IL-1β può essere uno dei fattori che portano al fallimento dell’impianto (32). Un aumento del TNF-α follicolare e del IL-6 potrebbe deteriorare il microambiente nel follicolo, influenzando così negativamente la qualità dell’ovocita e dell’embrione (33). In un altro studio condotto da Levin et al. (34), livelli più elevati di CRP, durante la stimolazione IVF, sono stati significativamente associati al fallimento del concepimento. Secondo le prove pubblicate sopra menzionate, abbiamo ipotizzato che i risultati della fecondazione in vitro possano essere influenzati da una ridotta infiammazione. Uno studio recente ha indicato che facendo uso dell’inibitore del TNF-α e dell’immunoglobulina endovenosa ha migliorato significativamente i risultati di IVF compreso; impianto, gravidanza clinica e tassi di natalità vivi in giovani donne infertili che avevano alti livelli di citochine T helper 1/T helper 2 (35).
C’erano alcune limitazioni in questo studio. A causa di finanziamenti inadeguati, non siamo stati in grado di misurare i livelli di cromo e non abbiamo potuto valutare gli effetti del cromo sull’espressione genica dello stress ossidativo.
Nel complesso, il nostro studio suggerisce i vantaggi della supplementazione di cromo sull’abbassamento dei marcatori infiammatori attraverso il miglioramento dell’espressione genica di PPAR-γ, GLUT-1, LDLR e IL-1in donne infertili con PCOS che erano candidate per la fecondazione in vitro.
Contributi dell’autore
ZA ha contribuito alla concezione, alla progettazione e all’analisi statistica del manoscritto. MA, SZ, NM, EA e SS hanno contribuito alla raccolta dei dati e alla stesura dei manoscritti. ZA ha supervisionato lo studio.
Finanziamento
Questo studio è stato sostenuto da una sovvenzione del Vice-cancelliere per la ricerca, Shahid Beheshti University of Medical Sciences, e Teheran, Iran.
Dichiarazione sul conflitto di interessi
Gli autori dichiarano che la ricerca è stata condotta in assenza di relazioni commerciali o finanziarie che potrebbero essere interpretate come un potenziale conflitto di interessi.
1. Yildiz BO, Bozdag G, Yapici Z, Esinler I, Yarali H. Prevalenza, fenotipo e rischio cardiometabolico della sindrome dell’ovaio policistico secondo diversi criteri diagnostici. Hum Reprod. (2012) 27:3067–73. doi: 10.1093/humrep / des232
PubMed Abstract / CrossRef Full Text / Google Scholar
2. Amò G, Conte M, Mazziotti G, Lalli E, Vitolo G, Tucker AT, et al. Siero e fluido follicolare citochine nella sindrome dell’ovaio policistico durante i cicli stimolati. Obstet Gynecol. (2003) 101:1177–82.
PubMed Abstract / Google Scholar
3. Valckx SD, Arias-Alvarez M, De Pauw I, Fievez V, Vlaeminck B, Fransen E, et al. Composizione in acidi grassi del fluido follicolare di donne di peso normale, sovrappeso e obese sottoposte a trattamento di riproduzione assistita: uno studio trasversale descrittivo. Reprod Biol Endocrinol. (2014) 12:13. doi: 10.1186/1477-7827-12-13
PubMed Abstract / CrossRef Testo completo / Google Scholar
4. Valckx SD, De Pauw I, De Neubourg D, Inion I, Berth M, Fransen E, et al. Composizione metabolica correlata al BMI del liquido follicolare delle donne sottoposte a trattamento di riproduzione assistita e conseguenze sulla qualità degli ovociti e degli embrioni. Hum Reprod. (2012) 27:3531–9. doi: 10.1093/humrep / des350
PubMed Abstract / CrossRef Full Text / Google Scholar
7. Letterio JJ, Roberts AB. Regolazione delle risposte immunitarie mediante TGF-beta. Immunol Rev annuale. (1998) 16:137–61
PubMed Abstract | Google Scholar
8. Fornari MC, Sarto A, Berardi VE, Martinez MA, Rocha MG, Pasqualini S, et al. Effect of ovaric hyper-stimulation on blood lymphocyte subpopulations, cytokines, leptin and nitrite among patients with unexplained infertility. Am J Reprod Immunol. (2002) 48:394–403.
PubMed Abstract | Google Scholar
10. Jamilian M, Zadeh Modarres S, Amiri Siavashani M, Karimi M, Mafi A, Ostadmohammadi V, et al. Le influenze della supplementazione di cromo sul controllo glicemico, marcatori del rischio cardio-metabolico e stress ossidativo nella sindrome dell’ovaio policistico infertile donne candidate per la fecondazione in vitro: uno studio randomizzato, in doppio cieco, controllato con placebo. Biol Trace Elem Res. (2018):48-55. doi: 10.1007 / s12011-017-1236-3
PubMed Abstract / CrossRef Testo completo / Google Scholar
11. Il suo nome deriva dal greco antico, che significa “Tuzcu”, “Tuzcu”, “Orhan”, “Sahin N”, “Kucuk O”, “Ozercan IH”, et al. Attività antidiabetica di cromo picolinato e biotina in ratti con diabete di tipo 2 indotto da dieta ricca di grassi e streptozotocina. Br J Nutr. (2013) 110:197–205. doi: 10.1017 / S0007114512004850
PubMed Abstract / CrossRef Full Text / Google Scholar
13. Jain SK, Rains JL, Croad JL. Effetto della supplementazione di cromo niacinato e cromo picolinato sulla perossidazione lipidica, TNF-alfa, IL-6, CRP, emoglobina glicata, trigliceridi e livelli di colesterolo nel sangue di ratti diabetici trattati con streptozotocina. Gratis Radic Biol Med. (2007) 43:1124–31. doi: 10.1016 / j.freeradbiomed.2007.05.019
PubMed Abstract | CrossRef Testo completo / Google Scholar
14. Martino F, Puddu PE, Pannarale G, Colantoni C, Martino E, Niglio T, et al. Il cromo-polinicotinato a basso dosaggio o il policosanol è efficace nei bambini ipercolesterolemici solo in combinazione con glucomannano. Aterosclerosi. (2013) 228:198–202. doi: 10.1016 / j.aterosclerosi.2013.02.005
PubMed Abstract | CrossRef Testo completo / Google Scholar
15. Rotterdam ESHRE / ASRM-Sponsorizzato PCOS Consensus Workshop Group. Consenso rivisto del 2003 sui criteri diagnostici e sui rischi per la salute a lungo termine legati alla sindrome dell’ovaio policistico. Fertil Steril. (2004) 81:19–25.
Google Scholar
17. Dunkley PR, Jarvie PE, Robinson PJ. Una procedura di gradiente Percoll rapida per la preparazione dei sinaptosomi. Protocollo Nat. (2008) 3:1718–28. doi: 10.1038 / nprot.2008.171
PubMed Abstract / CrossRef Testo completo / Google Scholar
18. Jamilian M, Bahmani F, Siavashani MA, Mazloomi M, Asemi Z, Esmaillzadeh A. Gli effetti della supplementazione di cromo sui profili endocrini, biomarcatori di infiammazione e stress ossidativo nelle donne con sindrome dell’ovaio policistico: uno studio randomizzato, in doppio cieco, controllato con placebo. Biol Traccia Elem Res. (2016) 172:72-8. doi: 10.1007 / s12011-015-0570-6
PubMed Abstract / CrossRef Testo completo / Google Scholar
19. Asemi Z, Foroozanfard F, Hashemi T, Bahmani F, Jamilian M, Esmaillzadeh A. L’integrazione di calcio e vitamina D influisce sul metabolismo del glucosio e sulle concentrazioni lipidiche nelle donne in sovrappeso e obese con carenza di vitamina D con sindrome dell’ovaio policistico. Clin Nutr. (2015) 34:586–92. doi: 10.1016 / j.clnu.2014.09.015
PubMed Abstract | CrossRef Testo completo / Google Scholar
20. Foroozanfard F, Jamilian M, Bahmani F, Talaee R, Talaee N, Hashemi T, et al. L’integrazione di calcio e vitamina D influenza i biomarcatori dell’infiammazione e dello stress ossidativo nelle donne in sovrappeso e con carenza di vitamina D con sindrome dell’ovaio policistico: uno studio clinico randomizzato in doppio cieco controllato con placebo. Clin Endocrinol. (2015) 83:888–94. doi: 10.1111 / cen.12840
PubMed Abstract / CrossRef Testo completo / Google Scholar
21. Chen G, Liu P, Pattar GR, Tackett L, Bhonagiri P, Strawbridge AB, et al. Il cromo attiva il traffico del trasportatore 4 del glucosio e migliora il trasporto stimolato dall’insulina del glucosio in adipociti 3T3-L1 via un meccanismo colesterolo-dipendente. Mol Endocrinol. (2006) 20:857–70. doi: 10.1210 / me.2005-0255
PubMed Abstract | CrossRef Testo completo / Google Scholar
24. Benigni A, Zoja C, Campana M, Corna D, Sangalli F, Rottoli D, et al. L’effetto benefico dell’antagonismo TGFbeta nel trattamento della nefropatia diabetica dipende dall’inizio del trattamento. Nefrone Exp Nefrolo. (2006) 104:e158-68. doi: 10.1159/000094967
PubMed Abstract / CrossRef Testo completo / Google Scholar
25. Bobulescu IA. Metabolismo lipidico renale e lipotossicità. Curr Opin Nephrol Hypertens. (2010) 19:393–402. doi: 10.1097 / MNH.0b013e32833aa4ac
PubMed Abstract / CrossRef Testo completo / Google Scholar
26. Jain SK, Croad JL, Velusamy T, Rains JL, Bull R. La supplementazione di cromo dinicocisteinato può abbassare la glicemia, CRP, MCP-1, ICAM-1, creatinina, apparentemente mediata da elevata vitamina C nel sangue e adiponectina e inibizione di NFkappaB, Akt e Glut-2 nei fegati di ratti grassi diabetici zucker. Mol Nutr Food Res. (2010) 54:1371-80. doi: 10.1002 / mnfr.200900177
PubMed Abstract | CrossRef Testo completo / Google Scholar
27. Sahin N, Akdemir F, Orhan C, Aslan A, Agca CA, Gencoglu H, et al. A novel nutritional supplement containing chromium picolinate, phosphatidylserine, docosahexaenoic acid, and boron activates the antioxidant pathway Nrf2/HO-1 and protects the brain against oxidative stress in high-fat-fed rats. Nutr Neurosci. (2012) 15:42–7. doi: 10.1179/1476830512Y.0000000018
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Haimovici F, Anderson JL, Bates GW, Racowsky C, Ginsburg ES, Simovici D, et al. Lo stress, l’ansia e la depressione di entrambi i partner nelle coppie infertili sono associati ai livelli di citochine e all’esito avverso della fecondazione in vitro. Am J Reprod Immunol. (2018) 79:e12832. doi: 10.1111 / aji.12832
PubMed Abstract / CrossRef Testo completo / Google Scholar
32. I nostri servizi Espressione di interleuchina-1beta su cellule di granulosa ovarica e sua implicazione clinica in donne sottoposte a fecondazione in vitro. Di Yi Jun Yi Da Xue Xue Bao. (2002) 22:934–6.
PubMed Abstract / Google Scholar
33. Wunder DM, Mueller MD, Birkhauser MH, Bersinger NA. Aumento dell’EN-78 nel liquido follicolare dei pazienti con endometriosi. Acta Obstet Gynecol Scand. (2006) 85:336–42. doi: 10.1080/00016340500501715
PubMed Abstract / CrossRef Full Text | Google Scholar