Frontiere in medicina
- Introduzione
- Pazienti e Metodi
- Selezione del Paziente in Surveillance, Epidemiology, and End Results Database
- Analisi statistica
- Risultati
- Caratteristiche del paziente
- Miglioramento del rischio di stadio T1 rispetto ad altri stadi T nel contesto dell’innalzamento del CEA sierico
- Effetto dell’innalzamento del CEA sierico preoperatorio nello stadio T
- Discussione
- Dichiarazione di disponibilità dei dati
- Dichiarazione etica
- Contributi dell’autore
- Conflitto di interessi
- Riconoscimenti
Introduzione
Il cancro del retto è una delle neoplasie più comuni in tutto il mondo (1). Secondo il sistema di stadiazione American Joint Committee on Cancer (AJCC), l’estensione anatomica del tumore primario (stadio T) è uno dei più importanti predittori prognostici. Tuttavia, i pazienti con lo stesso stadio T del cancro del retto possono mostrare risultati clinici notevolmente diversi.
Riportato per la prima volta nel 1965, l’antigene carcinoembrionico (CEA) è una glicoproteina di 180-200 kDa e un membro della superfamiglia delle immunoglobuline (2). CEA è secreto da una varietà di tumori solidi, tra cui il 90% dei tumori del colon-retto (3). Come il singolo biomarcatore prognostico siero più importante e affidabile nel cancro del colon-retto, elevati livelli di CEA preoperatoria sono trovati ad essere associati con prognosi peggiore del cancro del colon-retto (4-9).
Studi precedenti hanno dimostrato che il CEA era associato all’adesione delle cellule tumorali e all’immunità innata nel cancro del colon-retto. Inoltre, il CEA è stato anche segnalato per facilitare l’attaccamento delle cellule tumorali del colon-retto ai siti di metastasi e sostenere la progressione tumorale (10-12).
Tradizionalmente, la diffusione a distanza delle cellule tumorali è stata considerata un evento tardivo, tuttavia i risultati di diversi studi precedenti hanno indicato che l’acquisizione del potenziale metastatico potrebbe verificarsi nella fase molto precoce della progressione tumorale (13-16). Wo et al. (17) ha riferito che una dimensione del tumore molto piccola coinvolta nella positività dei linfonodi può essere un surrogato per la biologia aggressiva. Sospettiamo quindi che il cancro rettale in fase molto precoce con innalzamento del CEA sierico possa suggerire l’acquisizione precoce del potenziale metastatico e predire una sopravvivenza molto scarsa del cancro rettale.
Tuttavia, a nostra conoscenza, sono stati riportati pochi studi per indagare l’associazione dello stadio T e dei livelli sierici di CEA (C0 e C1) nel determinare la prognosi del cancro del retto. Pertanto, conduciamo questo ampio studio basato sulla popolazione per esaminare se lo stadio T molto precoce nel contesto dell’elevazione del CEA sierico possa essere un surrogato della malattia biologicamente aggressiva e prevedere una scarsa sopravvivenza causa-specifica (CSS) del cancro del retto. Per rimuovere l’effetto della positività linfonodale sulla nostra ricerca, abbiamo quindi escluso i pazienti positivi al nodo e focalizzato l’analisi sui pazienti dello stadio I-II.
Pazienti e Metodi
Selezione del Paziente in Surveillance, Epidemiology, and End Results Database
un’autorevole fonte di informazioni sull’incidenza del cancro e la sopravvivenza negli USA e una fonte completa di popolazione basati su informazioni tra tutti i neo diagnosticati casi di cancro che si verificano in Surveillance, Epidemiology, and End Results (SEER)-aree interessate, la VEGGENTE di database comprende ~28% della popolazione Americana. Il database VEGGENTE non conteneva alcun identificativo ed era pubblicamente disponibile per i ricercatori. SEER * Stat è un software fornito dal programma SEER per ottenere informazioni sui pazienti utilizzando l’accesso online. In un primo momento, la sessione di case-listing del software SEER*Stat (SEER*Stat 8.3.5) è stata utilizzata per elencare tutte le informazioni relative al paziente e i pazienti con diagnosi di cancro rettale di stadio I-II (negativo al nodo) tra il 1 gennaio 2004 e il 31 dicembre 2015 sono stati identificati dal database SEER (Figura 1). I pazienti affetti da cancro del retto sono stati identificati dai codici del sito ICD-O-3 C199 e C209 e dal codice di comportamento 3 (articoli NAACCR 522 e 523) (9). Abbiamo scelto di includere questi anni perché le informazioni del siero preoperatorio CEA sono state registrate a partire dal 2004 e il follow-up di SEER si è concluso nel 2015.

Figura 1. Diagramma di flusso delle definizioni di coorte di pazienti.
Quindi, coloro che hanno ricevuto radioterapia neoadiuvante, mancanza di conferma istologica positiva, con razza sconosciuta, istologie non adenocarcinoma o follow-up non attivo sono stati esclusi dal nostro studio. I pazienti con livello di CEA sierico preoperatorio disponibili sono stati inclusi nel nostro studio e abbiamo raggruppato “positivo / elevato” e ” negativo / normale; entro i limiti normali ” come C1 e C0 (informazioni sullo stadio C). I valori di cutoff di CEA sono stati rispettivamente di 2,5 ng / ml per i non fumatori e di 5 ng/ml per i fumatori. Inoltre, le seguenti variabili clinico-patologiche del paziente sono state recuperate dal database SEER: stadio T, razza, sesso, posizione del tumore, età alla diagnosi, anno di diagnosi, grado e istologia.
Analisi statistica
Nel presente studio, il test del chi-quadrato di Pearson è stato utilizzato per confrontare tutte le variabili clinicopatologiche dei pazienti recuperate dal database SEER tra i livelli di CEA sierici preoperatori normali ed elevati. Alcuni modelli di rischio proporzionale Cox multivariabile sono stati costruiti per identificare variabili prognostiche indipendenti del cancro del retto nelle nostre analisi. Le curve di sopravvivenza sono state generate utilizzando il metodo Kaplan–Meier e le differenze tra le curve sono state analizzate mediante test log-rank. I principali risultati di interesse nel presente studio sono stati CSS e sopravvivenza globale (OS). Il CSS è stato calcolato dalla data della diagnosi alla data della morte specifica per cancro. Le morti attribuite al cancro del retto sono state trattate come eventi e le morti per altre cause sono state trattate come osservazioni censurate alla data della morte. Per determinare se ci fosse un’interazione significativa tra il livello di CEA sierica preoperatoria e lo stadio T nella previsione dei CSS, abbiamo anche definito una variabile di interazione (stadio T e livello di CEA sierica). P bilaterale < 0,05 è stato considerato statisticamente significativo. Le analisi statistiche sono state eseguite principalmente utilizzando la versione SPSS 22 (IBM Corporation, Armonk, NY, USA).
Risultati
Caratteristiche del paziente
Nel complesso, 19.184 pazienti con diagnosi di cancro rettale di stadio I–II sono stati identificati dal database SEER tra il 1 gennaio 2004 e il 31 dicembre 2015 (Figura 1). Di questi pazienti, 13.007 (67,8%) pazienti sono stati assegnati allo stadio C0 e 6.177 (32,2%) pazienti sono stati assegnati allo stadio C1. Il sistema di stadiazione AJCC ha suggerito che 6.077 pazienti erano nello stadio T1, 4.783 pazienti nello stadio T2, 7.021 nello stadio T3 e 1.303 nello stadio T4. Un totale di 2.560 (13,3%) pazienti sono morti di cancro del retto alla fine del periodo di follow-up. Il tempo mediano di follow-up dell’intera coorte è stato di 44 mesi (0-143 mesi). Le caratteristiche basali dei pazienti sono riassunte nella Tabella 1.
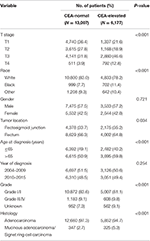
Tabella 1. Confronto delle caratteristiche basali del carcinoma rettale di stadio I–II in base al livello sierico dell’antigene carcinoembrionico (CEA).
Miglioramento del rischio di stadio T1 rispetto ad altri stadi T nel contesto dell’innalzamento del CEA sierico
È stato riscontrato che lo stadio C1 aveva maggiori probabilità di correlarsi con stadio T più alto, nero, giunzione rettosigmoidea, età avanzata, grado superiore e adenocarcinoma mucinoso/carcinoma a cellule ad anello con sigillo (Tabella 1, P < 0,05). Come mostrato nella Tabella 2, razza, sesso, posizione del tumore, età alla diagnosi, anno di diagnosi, grado, istologia, stadio T e livello sierico di CEA sono stati inclusi nell’analisi Cox multivariata. Quando è stata eseguita l’analisi Cox multivariata, abbiamo convinto le seguenti caratteristiche clinicopatologiche come fattori prognostici indipendenti nel cancro rettale di stadio I-II; questi includevano razza, sesso, posizione del tumore, età alla diagnosi, grado tumorale, stadio T e livello sierico di CEA, mentre il rischio tra T2,C0 e T1,C0 non era differenza statistica (P = 0,925). È stato dimostrato che, nel contesto dell’innalzamento del CEA sierico, lo stadio T1 presentava un rischio inatteso più elevato di mortalità specifica per cancro rettale rispetto agli stadi T2 e T3. Nella malattia in stadio T1, livelli elevati di CEA sierica sono stati associati ad un aumento del rischio di mortalità del 227,6% rispetto ai livelli normali di CEA sierica.

Tabella 2. Analisi di regressione Cox multivariata della sopravvivenza causa-specifica (CSS) nel cancro rettale di stadio I–II.
Le curve di sopravvivenza di Kaplan–Meier sono tracciate nelle figure 2, 3. Il tasso CSS a 5 anni era del 92,2% in T1C0, del 75,2% in T1C1, del 93,1% in T2C0, dell ‘86,7% in T2C1, dell’ 84,6% in T3C0, del 76,3% in T3C1, del 62,9% in T4C0 e del 43,6% in T4C1 (Figura 2, P < 0,001). Pertanto, T1C1 ha presentato un tasso CSS a 5 anni simile rispetto a T3C1 (75,2 contro 76,3%, P = 0,238). Inoltre, la scoperta è stata ancora più pronunciata nel sistema operativo. Il tasso di OS a 5 anni era del 78,6% in T1C0, del 48,3% in T1C1, del 77,1% in T2C0, del 62,3% in T2C1, del 68,5% in T3C0, del 54,5% in T3C1, del 45,3% in T4C0 e del 30,0% in T4C1 (Figura 3, P < 0,001). T1C1 ha presentato un tasso CSS a 5 anni significativamente più basso rispetto a T3C1 (48,3 contro 54,5%, P < 0,001).
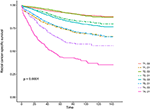
Figura 2. Curve di sopravvivenza causa–specifica di Kaplan-Meier (CSS) dello stadio T combinate con il livello sierico dell’antigene carcinoembrionico (CEA).
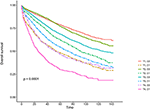
Figura 3. Curve di sopravvivenza globale di Kaplan–Meier (OS) dello stadio T combinate con il livello sierico dell’antigene carcinoembrionico (CEA).
Effetto dell’innalzamento del CEA sierico preoperatorio nello stadio T
La trama forestale è stata disegnata per mostrare gli hazard ratio (HRs) per confrontare i CSS tra gruppi CEA normali ed elevati nei rispettivi stadi T (Figura 4). Rispetto al normale livello di siero di CEA, in fase T2, elevato livello di siero CEA è stato associato con 69.0% di aumento del rischio di rettale-mortalità cancro-specifica ; in stadio T3, elevato livello di siero CEA è stato associato con il 67,2% di aumento del rischio di rettale-mortalità cancro-specifica (HR = 1.672, 95% CI = 1.486–1.882, P < 0.001); in fase di T4, elevato livello di siero CEA è stato associato con l ‘ 81,3% aumento del rischio di rettale-mortalità cancro-specifica (HR = 1.813, 95% CI = 1.485–2.213, P < 0.001); per contro, tuttavia, in fase T1, elevato livello di siero CEA presentato anche fino a 211.aumento del 6% del rischio di mortalità specifica per cancro rettale (HR = 3,116, IC al 95% = 2,639-3,679, P < 0,001).
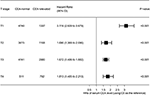
Figura 4. Hazard ratio (HRs) di sopravvivenza causa-specifica (CSS) tra livelli normali ed elevati di antigene carcinoembrionico sierico (CEA) secondo lo stadio T.
Discussione
Abbiamo mirato a indagare l’associazione dello stadio T e dei livelli sierici di CEA nel determinare i CSS del cancro del retto. Abbiamo ipotizzato che il cancro del retto con stadio T molto precoce (stadio T1) e l’elevazione del siero CEA possa essere un surrogato biologico per la malattia aggressiva, prevedendo così un esito oncologico scadente. Con ~ 20.000 pazienti con diagnosi di cancro rettale di stadio I-II incluso nel nostro studio.
In questo studio, è stato trovato che l’elevazione sierica del CEA era più probabile correlare con lo stadio T più alto, il nero, la giunzione rettosigmoidea, l’età più avanzata e il grado più alto e il carcinoma mucinoso dell’adenocarcinoma/anello con sigillo. Le analisi di sopravvivenza di Kaplan–Meier hanno mostrato che, nel contesto dell’innalzamento del CEA sierico, il tasso di CSS a 5 anni dello stadio T1 era del 75,2%, il che non ha raggiunto la differenza statistica dallo stadio T3 (76,3%). Per quanto riguarda la sopravvivenza globale, il tasso di OS a 5 anni dello stadio T1 con elevazione sierica preoperatoria del CEA (48,3%) era addirittura inferiore allo stadio T3 coinvolto nell’elevazione del CEA (54,5%) e non ha raggiunto la differenza statistica dallo stadio T4 (45.3%), il che significa che un elevato livello sierico preoperatorio di CEA potrebbe identificare un sottogruppo di tumori rettali di stadio T1 con CSS simile rispetto ad alcune malattie di stadio T3 e con OS simile rispetto ad alcune malattie di stadio T4.
Dopo la regolazione per i fattori prognostici noti del cancro del retto (razza, sesso, posizione del tumore, età alla diagnosi, anno di diagnosi, grado e istologia), la variabile di interazione (stadio T e livello sierico CEA) che abbiamo definito è stata dimostrata essere un fattore prognostico indipendente del cancro del retto. L’analisi multivariata della Cox ha mostrato che, nel contesto dell’innalzamento del CEA sierico, lo stadio T1 presentava un rischio inatteso più elevato di mortalità specifica per cancro rettale rispetto agli stadi T2 e T3. Nella malattia in stadio T1, livelli elevati di CEA sierica sono stati associati ad un aumento del rischio di mortalità del 227,6% rispetto ai livelli normali di CEA sierica. Inoltre, razza, sesso, posizione del tumore, età alla diagnosi e grado tumorale sono stati identificati anche come fattori prognostici indipendenti del cancro rettale di stadio I–II. Oltre a T1, è stato trovato che l’elevazione preoperatoria di CEA del siero ha presentato ~ 75% più alti rischi di mortalità rettale-cancro-specifica nel rispettivo stadio T, eppure il numero notevolmente aumentato a 211.6% nello stadio T1.
Nel 2000, il gruppo di lavoro colorettale dell’AJCC ha proposto l’inclusione del livello sierico di CEA (stadio C) nel convenzionale sistema di stadiazione AJCC TNM del cancro del colon-retto (18). Inoltre, l’American Society of Clinical Oncology e l’European Group on Tumor Markers hanno entrambi sostenuto l’inclusione del livello CEA sierico preoperatorio come strumento prognostico nel cancro del colon-retto (19-21).
Diverse ricerche precedenti hanno riportato il livello sierico di CEA come un forte ruolo prognostico nel cancro del colon (4-7, 22-26). Nel 2011, Thirunavukarasu et al. (25) ha riferito che il livello sierico preoperatorio di CEA era un biomarcatore prognostico indipendente del cancro del colon e la prognosi era peggiore nei pazienti con CEA alta con uno stadio più basso rispetto ai pazienti con CEA bassa con uno stadio più alto. In quello studio, l’alta CEA è stata persino considerata forte quanto la positività del nodo per la previsione di scarsi risultati oncologici del cancro del colon.
Tuttavia, pochi studi si concentrano sulla spiegazione del ruolo prognostico del livello sierico di CEA nel cancro del retto. Nel 2016, utilizzando anche il database SEER, Tarantino et al. (9, 27) ha condotto le due ampie indagini basate sulla popolazione, che hanno fornito prove convincenti che un elevato livello di CEA sierica preoperatoria era un forte predittore di una sopravvivenza complessiva peggiore e specifica per il cancro nel cancro del retto. Nel 2018, Liu et al. (8) ha dimostrato che preoperatoria siero CEA era un fattore prognostico indipendente di cancro del retto, e livelli elevati di CEA livello presentati evidentemente sopravvivenza minore rispetto al normale siero CEA livello in fasi I–IV. Tuttavia, solo due precedenti studi si sono concentrati sullo studio del ruolo prognostico preoperatorio di siero CEA livello, non esaminare l’associazione di CEA livello e la fase T nel predire il tumore esiti del cancro rettale.
Sebbene il convenzionale mostri che il cancro acquisisce il potenziale metastatico passo dopo passo man mano che cresce fino a grandi dimensioni (28), tuttavia, alcuni studi precedenti hanno indicato che l’acquisizione del potenziale metastatico potrebbe verificarsi molto presto nella progressione del tumore. Una precedente ricerca ha dimostrato la sopravvivenza estremamente scarsa di dimensioni tumorali molto piccole quando coinvolte nella positività dei linfonodi (17). Inoltre, i risultati della nostra ricerca mostrano che l’innalzamento del livello di CEA sierico preoperatorio nella fase molto precoce (stadio T1) del cancro del retto è associato a OS e CSS molto poveri e può essere un surrogato della biologia aggressiva. Crediamo che sia il coinvolgimento linfonodale che l’innalzamento del CEA sierico siano considerati come l’acquisizione della capacità metastatica. Il nostro studio, combinato con quello di Wo et al. sostenere costantemente l’idea di cui sopra che l’acquisizione del potenziale metastatico potrebbe verificarsi molto presto nella progressione del tumore, quindi associata a scarsi risultati oncologici, e la caratteristica biologica iniziale è più probabile che determini il potenziale di metastasi a distanza durante la progressione del cancro, piuttosto che la capacità metastatica accumulata (29).
Inoltre, i risultati del nostro studio hanno un significato clinico. Attualmente, il cancro del retto allo stadio I viene trattato con la sola resezione chirurgica radicale a causa di esiti oncologici relativamente favorevoli. Tuttavia, circa il 10-15% dei pazienti svilupperà recidiva tumorale dopo resezione radicale (30, 31). Nel presente studio, ci capita di identificare un sottogruppo di cancro rettale allo stadio T1 con prognosi molto scarsa rispetto al resto del cancro rettale allo stadio I, il che significa che quei tumori rettali allo stadio T1 con coinvolgimento dell’elevazione del siero CEA preoperatorio dovrebbero attirare più attenzione degli oncologi.
Tuttavia, ci sono due limitazioni nel nostro studio. Da un lato, questo studio non ha incluso alcuni fattori prognostici noti del cancro del retto nelle nostre analisi, tra cui lo stato di instabilità dei microsatelliti e le complicanze postoperatorie, che non erano disponibili dal database VEGGENTE e potrebbero introdurre pregiudizi in una certa misura. Non possiamo fornire intervalli e valori medi di CEA in entrambi i gruppi. D’altra parte, il presente studio era retrospettivo piuttosto che basato su dati prospettici. Pertanto, i nostri risultati devono ancora essere convalidati in altre coorti, specialmente in ampi studi clinici prospettici.
In conclusione, il nostro studio dimostra che il cancro del retto allo stadio T1, quando coinvolto nell’innalzamento del CEA sierico preoperatorio, può essere un surrogato della malattia biologicamente aggressiva e correlato con OS e CSS sfavorevoli. Inoltre, questo sottogruppo di cancro del retto merita più attenzione clinica degli oncologi. I nostri risultati, se convalidati in futuri studi di database, fornirebbero una nuova idea di terapia per il cancro del retto in fase iniziale.
Dichiarazione di disponibilità dei dati
I set di dati generati per questo studio sono disponibili su richiesta all’autore corrispondente.
Dichiarazione etica
I pazienti in questo studio sono stati identificati dal database SEER e l’approvazione per l’uso dei dati è stata ottenuta attraverso una richiesta presentata al programma SEER. L’approvazione da parte del comitato di revisione istituzionale non è stata necessaria perché il database SEER è disponibile al pubblico.
Contributi dell’autore
SW e WG hanno dato un contributo sostanziale e diretto a questo studio e lo hanno approvato per la presentazione.
Conflitto di interessi
Gli autori dichiarano che la ricerca è stata condotta in assenza di rapporti commerciali o finanziari che potrebbero essere interpretati come un potenziale conflitto di interessi.
Riconoscimenti
Questo lavoro è stato supportato in parte dal progetto di piano di sviluppo della scienza medica e della tecnologia di Yancheng (YK2015075).
1. Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: stime GLOBOCAN di incidenza e mortalità in tutto il mondo per 36 tumori in 185 paesi. CA Cancro J Clin. (2018) 68:394–424. doi: 10.3322 / caac.21492
PubMed Abstract / CrossRef Testo completo / Google Scholar
2. Oro P, Freedman COSÌ. Dimostrazione di antigeni specifici del tumore nel carcinoma del colon umano mediante tecniche di tolleranza e assorbimento immunologico. J Scad Med. (1965) 121:439–62. doi: 10.1084 / jem.121.3.439
PubMed Abstract | CrossRef Testo completo / Google Scholar
3. Il mio nome è Mitchell Antigene carcinoembrionico nella stadiazione e nel follow-up di pazienti con cancro del colon-retto. Cancro Investire. (2005) 23:338–51. doi: 10.1081 / CNV-58878
PubMed Abstract / CrossRef Testo completo / Google Scholar
4. Il sito utilizza cookie tecnici e di terze parti per migliorare la tua esperienza di navigazione. Valutazione del ruolo prognostico di elevati livelli preoperatori di antigene carcinoembrionico nei pazienti affetti da cancro del colon: risultati del national cancer database. Ann Chirurgo Oncol. (2016) 23:1554–61. doi: 10.1245 / s10434-015-5014-1
PubMed Abstract / CrossRef Testo completo / Google Scholar
5. Ogata Y, Murakami H, Sasatomi T, Ishibashi N, Mori S, Ushijima M, et al. Elevato livello di antigene carcinoembrionico sierico preoperatorio può essere un indicatore efficace per la necessità di chemioterapia adiuvante dopo resezione potenzialmente curativa del cancro del colon di stadio II. J Surg Onkol. (2010) 99:65–70. doi: 10.1002 / jso.21161
PubMed Abstract / CrossRef Testo completo / Google Scholar
6. Quah HM, Chou JF, Gonen M, Shia J, Schrag D, Landmann RG, et al. Identificazione di pazienti con carcinoma del colon di stadio II ad alto rischio per la terapia adiuvante. Dis Colon retto. (2008) 51:503–7. doi: 10.1007 / s10350-008-9246-z
PubMed Abstract / CrossRef Full Text / Google Scholar
7. Il suo nome deriva dal greco antico, che significa “terra”, “terra”, “terra”, “terra”, “terra”, “terra”, “terra”, “terra”, “terra”, “terra”, “terra”, “terra”, “terra”, “terra”. L’incorporazione di CEA migliora la stratificazione del rischio nel cancro del colon di stadio II. J Gastrointest Surg. (2017) 21:770-7. doi: 10.1007 / s11605-017-3391-4
PubMed Abstract / CrossRef Testo completo / Google Scholar
8. Liu Q, Lian P, Luo D, Cai S, Li Q, Li X. Combinazione di antigene carcinoembrionico con l’American Joint Committee on Cancer TNM staging system nel cancro del retto: uno studio reale e ampio basato sulla popolazione. L’Onco prende di mira Ther. (2018) 11:5827–34. doi: 10.2147 / OTT.S171433
PubMed Abstract / CrossRef Testo completo / Google Scholar
9. Tarantino I, Warschkow R, Schmied BM, Güller U, Mieth M, Cerny T, et al. Valore predittivo di CEA per la sopravvivenza nel cancro rettale di stadio I: un’analisi basata su un punteggio di propensione basato sulla popolazione. J Gastrointest Surg. (2016) 20:1213-22. doi: 10.1007/s11605-016-3137-8
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Beauchemin N, Arabzadeh A. Carcinoembryonic antigen-related cell adhesion molecules (CEACAMs) in cancer progression and metastasis. Cancer Metastasis Rev. (2013) 32:643–71. doi: 10.1007/s10555-013-9444-6
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Arabzadeh A, Chan C, Nouvion AL, Breton V, Benlolo S, DeMarte L, et al. Host-related carcinoembryonic antigen cell adhesion molecule 1 promotes metastasis of colorectal cancer. Oncogene. (2013) 32:849–60. doi: 10.1038 / onc.2012.112
PubMed Abstract / CrossRef Testo completo / Google Scholar
12. Cai Z, Xiao J, He X, Ke J, Zou Y, Chen Y, et al. Accesso al nuovo significato prognostico dell’antigene carcinoembrionico preoperatorio nel cancro del colon-retto che riceve la resezione del tumore: più che positivo e negativo. Biomark del cancro. (2017) 19:161–8. doi: 10.3233 | CBM-160287
PubMed Abstract / CrossRef Full Text / Google Scholar
13. Engel J, Eckel R, Kerr J, Schmidt M, Fürstenberger G, Richter R, et al. Il processo di metastasi per il cancro al seno. Eur J Cancro. (2003) 39:1794–806. doi: 10.1016 / S0959-8049(03)00422-2
PubMed Abstract / CrossRef Testo completo / Google Scholar
14. Hüsemann Y, Geigl JB, Schubert F, Musiani P, Meyer M, Burghart E, et al. La diffusione sistemica è un primo passo nel cancro al seno. Cellule tumorali. (2008) 13:58–68. doi: 10.1016 / j.ccr.2007.12.003
PubMed Abstract | CrossRef Testo completo / Google Scholar
15. Podsypanina K, Du YC, Jechlinger M, Beverly LJ, Hambardzumyan D, Varmus H. Semina e propagazione di cellule mammarie di topo non trasformate nel polmone. Scienza. (2008) 321:1841–4. doi: 10.1126 / scienza.1161621
PubMed Abstract / CrossRef Testo completo / Google Scholar
16. Schmidt-Kittler O, Ragg T, Daskalakis A, Granzow M, Ahr A, Blankenstein TJ, et al. Dalle cellule disseminate latenti alle metastasi palesi: analisi genetica della progressione sistemica del cancro al seno. Proc Natl Acad Sci Stati Uniti d’America. (2003) 100:7737–42. doi: 10.1073 / pnas.1331931100
PubMed Abstract / CrossRef Testo completo / Google Scholar
17. Wo JY, Chen K, Neville BA, Lin NU, Punglia RS. Effetto di dimensioni molto ridotte del tumore sulla mortalità specifica per cancro nel cancro al seno positivo al nodo. J Clin Oncol. (2012) 23:32–3. doi: 10.1016 / j. breastdis.2012.01.026
CrossRef Testo completo / Google Scholar
18. Compton C, Fenoglio-Preiser CM, Pettigrew N, Fielding LP. American joint committee on cancer prognostic factors consensus conference: gruppo di lavoro colorettale. Cancro. (2015) 88:1739–57. doi: 10.1002/(SICI)1097-0142(20000401)88:7<1739::AIUTO-CNCR30>3.0.CO;2-T
PubMed Abstract / CrossRef Testo completo / Google Scholar
19. Il suo nome deriva dal greco antico, che significa “terra”, “terra”, “terra”, “terra”, “terra”, “terra”, “terra”, “terra”, “terra”, “terra”, “terra”, “terra”, “terra”, “terra”, “terra”, “terra”. Marcatori tumorali nel cancro del colon-retto: European Group on Tumour Markers (EGTM) guidelines for clinical use. Eur J Cancro. (2007) 43:1348–60. doi: 10.1016 / j. ejca.2007.03.021
PubMed Abstract | CrossRef Testo completo / Google Scholar
20. Il nostro sito utilizza cookie tecnici e di terze parti. ASCO 2006 aggiornamento delle raccomandazioni per l’uso di marcatori tumorali nel cancro gastrointestinale. J Clin Oncol. (2006) 24:5313–27. doi: 10.1200 / JCO.2006.08.2644
PubMed Abstract | CrossRef Testo completo / Google Scholar
21. Duffy MJ, Lamerz R, Haglund C, Nicolini A, Kalousová M, Holubec L, et al. Marcatori tumorali nel cancro del colon-retto, cancro gastrico e tumori stromali gastrointestinali: aggiornamento delle linee guida del gruppo europeo sui marcatori tumorali 2014. Int J Cancro. (2014) 134:2513–22. doi: 10.1002 / ijc.28384
PubMed Abstract / CrossRef Testo completo / Google Scholar
22. Harrison LE, Guillem JG, Paty P, Cohen AM. L’antigene carcinoembrionico preoperatorio predice i risultati nei pazienti con cancro del colon negativo al nodo: un’analisi multivariata di 572 pazienti. J Am Coll Surg. (1997) 185:55-9. doi: 10.1016 / S1072-7515(97)00012-4
PubMed Abstract / CrossRef Testo completo / Google Scholar
23. Huh JW, Oh BR, Kim HR, Kim YJ. Livello di antigene carcinoembrionico preoperatorio come fattore prognostico indipendente nel cancro del colon potenzialmente curativo. J Surg Onkol. (2010) 101:396–400. doi: 10.1002 / jso.21495
PubMed Abstract / CrossRef Testo completo / Google Scholar
24. Il suo nome deriva dal latino “Hosaka M”, “Hirata A”, “Nakagawa Y”, “Fujita S”, et al. Incorporazione dei livelli sierici di antigene carcinoembrionico nel sistema di raggruppamento prognostico del cancro del colon. Int J Colorect Dis. (2017) 32:1–9. doi: 10.1007 / s00384-017-2772-1
PubMed Abstract / CrossRef Testo completo / Google Scholar
25. Thirunavukarasu P, Sukumar S, Sathaiah M, Mahan M, Pragatheeshwar KD, Pingpank JF, et al. Stadio C nel cancro del colon: implicazioni del biomarcatore dell’antigene carcinoembrionico nella stadiazione, nella prognosi e nella gestione. J Natl Cancro Inst. (2011) 103:689–97. doi: 10.1093/jnci / djr078
PubMed Abstract / CrossRef Full Text / Google Scholar
26. La maggior parte di essi è costituita da Valutazione del valore prognostico dei livelli di antigene carcinoembrionico nel cancro del colon di stadio I e II. Eur J Cancro. (2018) 94:1–5. doi: 10.1016 / j. ejca.2018.01.112
PubMed Abstract / CrossRef Full Text / Google Scholar
27. Tarantino I, Warschkow R, Worni M, Merati-Kashani K, Köberle D, Schmied BM, et al. CEA preoperatoria elevata è associata a una sopravvivenza peggiore nei pazienti affetti da cancro rettale di stadio I-III. Br J Cancro. (2012) 107:266. doi: 10.1038 / bjc.2012.267
PubMed Abstract / CrossRef Testo completo / Google Scholar
28. Norton L, Massague J. Il cancro è una malattia di auto-semina? Nat Med. (2006) 12:875–8. doi: 10.1038 | nm0806-875
PubMed Abstract / CrossRef Testo completo / Google Scholar
29. Il suo nome deriva dal greco antico. Effetto di grandi dimensioni del tumore sulla mortalità specifica del cancro nel cancro al seno negativo al nodo. Mayo Clin Proc. (2012) 87:1171–80. doi: 10.1016 / j.mayocp.2012.07.023
PubMed Abstract | CrossRef Testo completo / Google Scholar
30. Blumberg D, Paty PB, Picon AI, Guillem JG, Klimstra DS, Minsky BD, et al. Cancro rettale di stadio I: identificazione di pazienti ad alto rischio. J Am Coll Surg. (1998) 186:574-9; discussione: 579-80. doi: 10.1016 / S1072-7515(98)00018-0
PubMed Abstract / CrossRef Testo completo / Google Scholar
31. Gunderson LL, Sargent DJ, Tepper JE, Wolmark N, O’Connell MJ, Begovic M, et al. Impatto dello stadio T e N e trattamento sulla sopravvivenza e ricaduta nel cancro rettale adiuvante: un’analisi aggregata. J Clin Oncol. (2004) 22:1785-96. doi: 10.1200 / JCO.2004.08.173
PubMed Abstract / CrossRef Full Text / Google Scholar